甲状腺乳头状癌患者超声及临床特征与BRAF 基因检测结果的相关性分析
王 妍,王小颖
(石家庄市人民医院超声科 河北 石家庄 050000)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌中常见的一种类型,大部分患者预后良好,但是仍有一定比例患者存在复发转移的风险[1]。超声是一种无创、简便及检查成本低的方式,是甲状腺疾病诊断及评估预后的首选方法[2-3]。目前,越来越多的甲状腺癌相关基因被发现,常见的有鼠类肉瘤滤过毒菌致癌同源体B1(V-rafmurinesarcomaviraloncogenehomolo gB1,BRAF)、RAS 和TERT 等基因突变,由此引起人们对PTC 癌起源的新认识[4]。BRAF 基因受到上游RAS蛋白激酶的调控,在细胞增殖、分化及凋亡中发挥重要作用,且其在MAPK 信号通路中也有一定作用[5-6]。有研究显示,BRAF 基因突变在PTC 中发生率很高,且其与患者病理特性及患者临床特征有关[7]。在中国,PTC 患者中常出现BRAF V600E 基因突变,突变率随着年龄增加而增大,且还与淋巴结转移及临床分期具有相关性[8-9]。临床考虑该基因突变可以作为PTC 淋巴结转移的独立危险因素[10]。目前,关于PTC 患者超声及临床特征与BRAF基因检测结果的相关性的研究较少,本研究则基于此问题进行探究。
1 资料与方法
1.1 一般资料
回顾性选取2022 年1 月—2023 年5 月在石家庄市人民医院接受治疗的甲状腺乳头状癌患者60 例,对所有患者均进行BRAF 基因检测,根据其检测结果(有无BRAF 基因突变)将患者分为两组,27 例发生BRAF 基因突变的患者纳入突变组,33 例未发生BRAF 基因突变的患者纳入野生组。
纳入标准:①患者在本院接受超声检查及BRAF 基因检测;②经手术病理学检验结果证实为甲状腺乳头状癌;③临床资料完整;④首次确诊患者,无既往甲状腺恶性肿瘤史;⑤无既往头颈放化疗史。排除标准:①临床诊断结果不明确患者;②合并其他恶性肿瘤患者;③患有严重血液系统疾病及凝血功能障碍患者;④伴精神疾病患者。
1.2 方法
超声检查:使用荷兰飞利浦公司EPIQ7 型彩色多普勒超声诊断仪,探头频率(3~12)MHz。行甲状腺超声检查,记录病灶位置、病灶数目、肿瘤最大直径、是否侵犯包膜、纵横比、边界、肿瘤回声类别、钙化等特征。由两名超声医生独立进行判读,最后统一检查结果。
BRAF 基因突变检测:手术切取PTC 组织进行检查。使用武汉海吉力生物科技有限公司生产的CatNO.ADx-TI01DNA 分离试剂盒提取DNA,利用紫外分光光度计测定DNA 浓度。利用琼脂糖凝胶电泳检测DNA 的完整性,使用ADx-ARMS-BRAF 检测试剂盒反转录反应合成cDNA,然后使用荧光定量PCR 仪进行PCR 扩增,将上述扩增产物进行琼脂糖凝胶电泳分析。BRAF 上游引物:5'-ACCACCCAATACCACAGGAA-3',下游引物:5'-CATTGGGAGCTGATGAGGAT-3'。标本突变位点扩增且CT 值<28,判定为基因检测结果阳性,记为突变型;突变位点无扩增或CT 值≥28,记为野生型。
1.3 观察指标
①对两组患者行超声检查,探究其超声征象的异同;②检测患者的实验室指标,如患者的游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、甲状腺刺激素(TSH)、甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)水平;③收集患者的一般资料,进行单因素分析,探究可能对患者BRAF 基因突变产生影响的因素;④根据上述结果,采用皮尔逊相关系数探究超声及患者临床特征与患者BRAF 基因突变的相关性。
1.4 统计学方法
采用SPSS 23.0 统计软件进行数据处理,符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验;采用皮尔逊(Pearson)相关系数对患者超声征象、临床特征与患者BRAF 基因的相关性进行分析。本研究以α=0.05 为检验水准。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组超声征象比较
两组间在峡部距离是否>2 mm、边界是否清晰、内部回声、有无钙化、血流是否丰富方面差异存在统计学意义(P<0.05)。见表1。

表1 两组超声征象比较[n(%)]
2.2 两组间FT4、FT3、TSH、TgAb、TPOAb 水平比较
突变组患者的FT4、FT3、TSH、TgAb、TPOAb 水平均高于野生组(P<0.05),见表2。
表2 两组间FT4、FT3、TSH、TgAb、TPOAb 水平比较()

表2 两组间FT4、FT3、TSH、TgAb、TPOAb 水平比较()
2.3 两组临床特征比较
两组间在结节数目、肿瘤原发灶情况方面差异有统计学意义(P<0.05),见表3。

表3 BRAF 基因突变临床特征分析
2.4 甲状腺乳头状癌患者超声征象及临床特征与BRAF 基因突变的相关性分析
对患者的超声征象、临床特征与患者BRAF 基因突变的相关性采用皮尔逊相关系数进行分析,结果见表4,可知BRAF 基因突变与患者的内部回声、血流特征、FT3、TSH、TgAb、TPOAb 间存在强正相关(P<0.001),其r值分别为0.596、0.607、0.746、0.648、0.969、0.872。
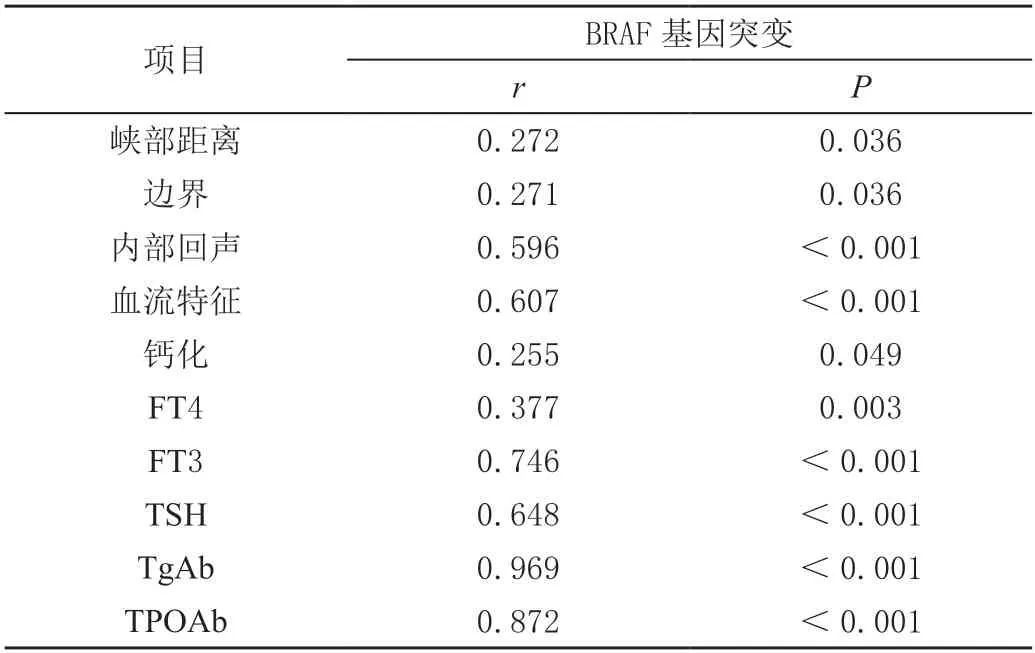
表4 甲状腺乳头状癌患者超声征象及临床特征与BRAF 基因突变的相关性分析
3 讨论
PTC 在临床具有较高的发病率,且女性患者较男性多,该病经历多步骤、多节段、多因素的生物演变过程,但目前其确切的发病机制尚无定论[11]。BRAF 是RAF基因家族的成员,存在40 多种突变类型,该基因突变会影响细胞分裂、增殖过程,进而参与肿瘤的生成[12]。基因突变与PTC 的发生、淋巴结或远处转移具有密切关系,因此探讨该基因与PTC 的关系具有重要意义。
本研究利用超声来揭示PTC 进展情况在BRAF 基因突变组及未突变组间中的差异。结果显示:BRAF 基因突变组及未突变组间超声征象比较,在峡部距离是否>2 mm、边界是否清晰、内部回声、有无钙化、血流特征是否丰富方面差异存在统计学意义,说明BRAF 基因突变与PTC 的侵袭性特征有关。现有的研究表明,多种原癌基因的激活及抑癌基因突变会促进PTC 的发生发展,而BRAF 是与PTC 关系最为密切的基因[13]。BRAF 基因第600 位氨基酸从缬氨酸(V)转变为谷氨酸(E),会使MAPK 通路激活,促进癌细胞增殖。已有研究证实,PTC BRAF 突变会增加淋巴结受累、远处转移概率,认为BRAF 基因突变和PTC 的高侵袭有相关性[14]。超声检查能够无创、实时获取甲状腺肿瘤形态、内部回声、血流信号、钙化特征等信息,这些特征同样可反映肿瘤的侵袭性。钙化是超声鉴别甲状腺良恶性肿瘤的特异性指标之一[15]。恶性肿瘤中,由于肿瘤细胞生长过快,其内血管及纤维过度增殖,易形成钙盐沉积,进而导致钙化的出现。PTC 细胞分裂较快,细胞侵袭力增强,使得细胞易向外侵袭,形成边界模糊、血流丰富的特征,使得其内部具有高回声[16]。本研究证明BRAF 基因突变与PTC 高侵袭性的超声特征有关,两者联合可成为PTC 的有效评估手段。
本研究结果显示,突变组患者的FT4、FT3、TSH、TgAb、TPOAb 水平高于野生组,在结节数目、肿瘤原发灶情况方面差异存在统计学意义。PTC 临床表现具有多样性,PTC 患者常出现多发结节及弥漫性肿大甲状腺,甲状腺素的生成受到影响,使患者处于甲状腺功能异常,FT4、FT3、TSH 水平往往异常,同时患者血清中抗体水平(TgAb、TPOAb)亦有明显升高。有研究显示,TSH升高是PTC 发生的危险因素,其水平与发病率及疾病进展呈正相关,PTC 中,BRAF 突变率达30%~80%,高于其他相关通路蛋白编码基因[17]。PTC 中BRAF-V600E突变后,会促进细胞衰老,使病变细胞停止分化,阻止肿瘤的恶化,进而使FT4、FT3、TSH、TgAb、TPOAb升高;同时BRAF-V600E 突变会增加导致TSH 受体表达增多,肿瘤在上述因子的刺激下会进一步增殖。本研究的PTC 患者中,肿瘤侵袭能力增加与BRAF-V600E突变状态有关,上述指标水平的增加也是肿瘤侵袭性改变的代偿反应。近年来国内外学者对PTC 患者肿瘤细胞的基因突变情况做了大量的研究[18-19]。本研究结果的出现可能与不同基因型的出现对PTC 的发生发展过程的影响不同有关。
本研究对PTC 患者的超声征象、临床特征与患者BRAF基因突变的相关性采用皮尔逊相关系数进行分析,结果可知BRAF 基因突变与患者的内部回声、血流特征、FT3、TSH、TgAb、TPOAb 间存在强正相关。提示PTC 患者BRAF 基因突变可能与患者超声征象、临床特征存在一定关联。以往有研究称,BRAF 基因突变与甲状腺肿瘤的分期、腺体外浸润及淋巴结转移具有重要关系[20-22]。结合本研究结果,分析是BRAF-V600E 突变能通过甲基化使抑癌基因沉默,降低PTC 的摄碘能力,增加其恶性程度及肿瘤侵袭转移能力。本研究结果中突变组及野生组之间的超声特征及临床特征存在差异。血清FT3、TSH、TgAb、TPOAb 检测结合颈部超声检查对PTC 的诊断帮助较大,结合BRAF 基因突变情况与上述特征的相关性,为临床诊疗提供更加全面的信息。
综上所述,PTC 患者BRAF 基因突变可能与患者超声征象及临床特征存在一定关联,患者BRAF 基因发生突变后,多表现为边界不清晰、内部回声非低回声、血流丰富,且TgAb、TPOAb 水平升高。

