基于转录组学的Vip3Aa杀美洲大蠊的作用机制研究
和梦颖,黎尔彤,田方圆,汪 洁,金小宝,刘文彬
(广东药科大学生命科学与生物制药学院/广东省生物活性药物研究重点实验室,广州 510006)
Vip是苏云金芽孢杆菌Bacillusthuringiensis营养期产生的一类杀虫蛋白(Guptaetal., 2021)。目前已发现4大类Vip蛋白,分别是Vip1、Vip2、Vip3和Vip4蛋白。Vip1和Vip2蛋白可用于鞘翅目昆虫的防治,Vip4蛋白的功能尚不清楚,而Vip3蛋白研究最为广泛,可用于鳞翅目昆虫等的防治。在鳞翅目昆虫中,Vip3Aa在中肠被蛋白酶水解去除N端蛋白形成毒性蛋白,毒性蛋白与昆虫的刷状缘膜囊泡(Brush border membrane vesicle, BBMV)结合,导致BBMV形成空洞,最终引发昆虫的死亡(Zhangetal., 2018),但其确切分子机制尚不清楚。
Vip3Aa蛋白可诱导真菌细胞和鳞翅目昆虫细胞的凋亡。有研究者对甜菜夜蛾Spodopterafrugiperda幼虫取食Vip3Aa蛋白的多个基因进行Q-PCR后发现,Vip3Aa可诱导甜菜夜蛾幼虫Caspase-1、Caspase-2、Caspase-3、Caspase-4、Caspase-6和JAK-STAT等凋亡相关基因的上调,并且通过TUNL染色观察到中肠出现凋亡细胞的存在,推测Vip3Aa作用可能与凋亡相关(Hernández-Martínezetal., 2017)。Hou等(2020)的研究中发现Vip3Aa蛋白可诱导甜菜夜蛾Sf9细胞的凋亡,其中溶酶体在其中扮演了重要作用。Park等(2021)发现Vip3Aa蛋白可通过促进线粒体活性氧的生成和与核酸的结合诱导白念珠菌Candidaalbicans细胞的凋亡。
前期研究发现Vip3Aa蛋白可破坏美洲大蠊Periplanetaamericana的中肠上皮结构从而导致其死亡,且发现美洲大蠊BBMV缺乏Vip3Aa蛋白受体,Vip3Aa蛋白并不会与美洲大蠊BBMV结合,因此也表明Vip3Aa蛋白杀美洲大蠊机制有别于杀鳞翅目昆虫机制(Liuetal., 2020)。转录组测序结果代表了基因组的实时表达情况,通过对不同状态差异基因(DEGs)的挖掘,可为探索相关机制的研究奠定基础,如王登杰(2015)采用转录组学比较了烟粉虱Bemisiatabaci是否感染球孢白僵菌Beauveriabassiana的差异基因,上述基因富集在76个主要通路,为深入研究烟粉虱对球孢白僵菌感染的免疫反应提供了基础,姚知含等(2015)的研究中采用转录组学研究了沙葱萤叶甲Galerucadaurica对蜕皮激素的响应,发现蜕皮激素可通过核黄素代谢、溶酶体和泛酸与乙酰辅酶A合成通路调控沙葱萤叶甲的生殖滞育。昆虫的肠道是保护宿主的第一道屏障(Terraetal., 2018),前期研究发现Vip3Aa蛋白的主要损伤部位在中肠,因此本研究比较了美洲大蠊取食Vip3Aa蛋白的转录组学变化,并通过实验验证,初步探讨Vip3Aa杀美洲大蠊的分子机制。
1 材料和方法
1.1 实验材料
美洲大蠊由广东省疾病预防控制中心阴伟雄高级技工馈赠。美洲大蠊饲养于本研究所昆虫室,饲养温度20~30℃,相对湿度65%~75%,饲料为鼠粮。
1.2 主要试剂和仪器
PrimeScript One Step RT-PCR Kit Ver.2试剂盒购于日本Takara公司;Trizol购于美国英潍捷基公司;DEPC购于美国Sigma-aldrich公司;RNAStore样本保存液购于天跟生化科技有限公司。TGrinder电动组织匀浆机、TGem Plus全波长分光光度计(天根生化科技有限公司);CFD-3120荧光定量PCR(美国伯乐公司);LKB-5型超薄切片机(瑞典LKB公司)。
1.3 给药与取样
取6头美洲大蠊成虫,随机分为对照组和给药组,每组3头。分组后,美洲大蠊均投放于适量溶液的培养皿,对照组为PBS溶液,给药组为0.031 mg/ml Vip3Aa蛋白PBS溶液,给药后24 h,冰浴麻醉美洲大蠊,用手术剪小心分离中肠,并将其保存于RNAStore样本保存液。
1.4 中肠总mRNA的提取、cDNA合成和测序
将中肠组织置入DEPC预处理的研钵,加入适量液氮,研磨粉碎,加入50~100 mg/mL Trizol充分裂解样品。12 000 rpm离心5 min取上清,加入1/5 Trizol体积氯仿,混合均匀后25℃放置15 min,12 000 rpm离心5 min取上清,加入1/2 Trizol体积异丙醇,混合均匀后25℃放置15 min,12 000 rpm离心 5 min取沉淀,加入Trizol等体积的75%乙醇,8 000 rpm离心5 min后获得RNA沉淀,并将其溶解于ddH20。全波长分光光度计测定A260/A280。所得mRNA送北京百迈客生物科技有限公司测序、分析。
1.5 转录组学分析流程
IIIumina高通量测序平台对cDNA文库进行测序。测序所得raw data通过过滤低质量、接头污染、N碱基>5%的数据获得Clean Data。HISAT2软件获取reads在参考基因组上的定位信息。StringTie软件对比对上的reads进行组装,挖掘新基因。BLAST软件对新基因信息进行比对,KOBAS 2.0预测氨基酸序列,HMMER软件对新基因进行注释(孙涛等, 2021)。FPKM方法计算基因表达量,FPKM=109C/NL。以Fold Change≥2且FDR<0.01为标准,筛选差异基因,所得差异基因进行Gene Ontology功能注释和KEGG通路富集分析(李媛媛和赵金红, 2021)。
1.6 Real Time-PCR验证转录组结果
分别选取GST8、ACHE、aminopeptidase、chymotrypsin和β-actin基因,依据基因序列,使用Primer Premier 5设计引物。以1.4所获得mRNA,进行逆转录,qRT-PCR验证转录组结果,以β-actin作为内参基因计算相对表达量,使用对照组表达值进行归一化处理。引物序列见表1。

表1 qRT-PCR 实验所用引物
1.7 TEM观察Vip3Aa对美洲大蠊中肠超微结构的影响
手术剪分离1.3所得中肠组织,样品大小为1 mm×3 mm×3 mm。2.5%戊二醛固定2 h。0.1 M PBS冲洗3次(15 min/次)。置入1%饿酸固定液约3 h。0.1 M PBS冲洗3次(15 min/次)。组织依次经过50%乙醇(15 min)、70%乙醇(15 min)、90%乙醇(15 min)、90%乙醇:90%丙酮(1∶1)(15 min)、90%丙酮(15 min)、100%丙酮(15 min)、100%丙酮(15 min)、100%丙酮(15 min)4℃脱水。常规渗透、包埋、聚合。超薄切片机(瑞典LKB-1)超薄切片,厚度50~60 nm,3%醋酸铀-枸橼酸铅双染色。HT7700透射电镜(日本日立公司)80 KV下观察。
1.8 Hoechst染色观察Vip3Aa对美洲大蠊中肠细胞凋亡的影响
手术剪分离1.3所得中肠组织,常规冷冻切片,切片厚度5 μm。PBS浸泡去除OCT包埋剂,切片滴加0.5 mL Hoechst 33258,轻微震荡孵育5 min。使用移液器小心吸去Hoechst 33258,PBS溶液洗两遍,每次3 min。封片,荧光显微镜下观察、拍照。
2 结果和分析
2.1 测序数据和质量评估
6个样本的原始Reads,经过过滤共获得44.60 Gb Clean Data,单个样品Clean Data为7.17~8.15 Gb,G+C含量为42.78%~45.23%,Q30碱基比例为93.32%~94.29%(表2)。
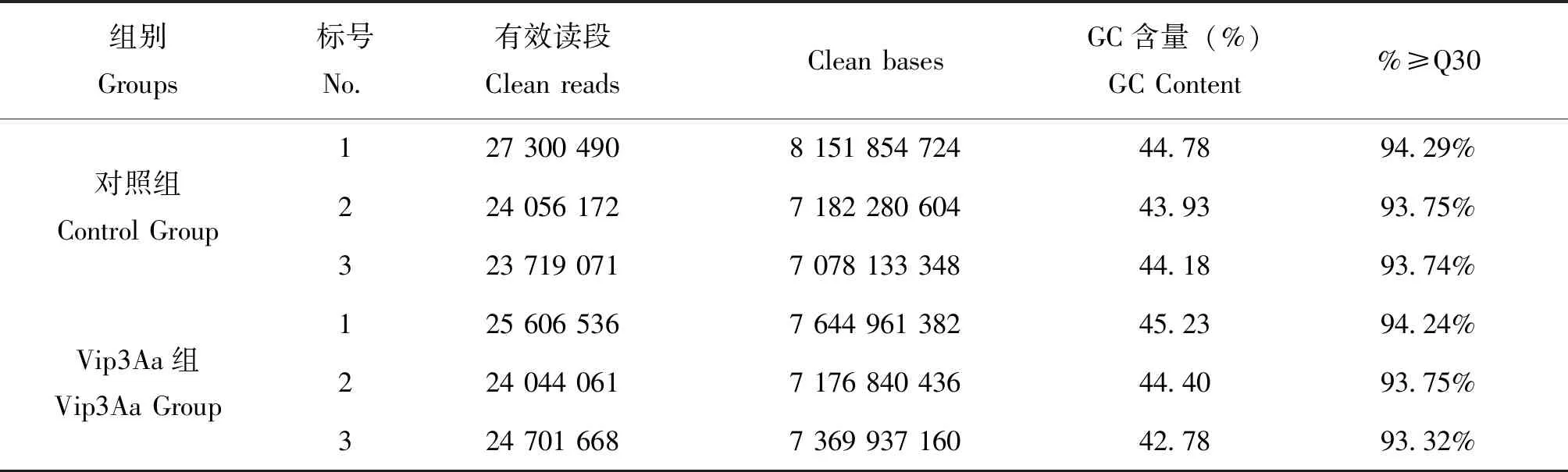
表2 本研究测序数据结果统计
2.2 新基因挖掘
分别通过同源蛋白簇分析数据库(Clusters of Orthologous Groups of proteins,COG)、基因本体数据库(Gene Ontology,GO)、京都基因与基因组百科全书数据库(Kyoto encyclopedia of genes and genomes,KEGG)、Pfam数据库、Swiss-Prot数据库、基因非监督直系同源基因组数据库(Evolutionary Genealogy of Genes: Non-supervised Orthologous Groups Database, eggNOG)和非冗余蛋白序列数据库(Non-RedundantProtein Sequence, Nr)数据库注释,共获得23 470条美洲大蠊基因,300<=length<1 000基因9 908个,length>=1 000基因12 519。发掘新基因5 757个,其中4 027个得到功能注释(表3)。
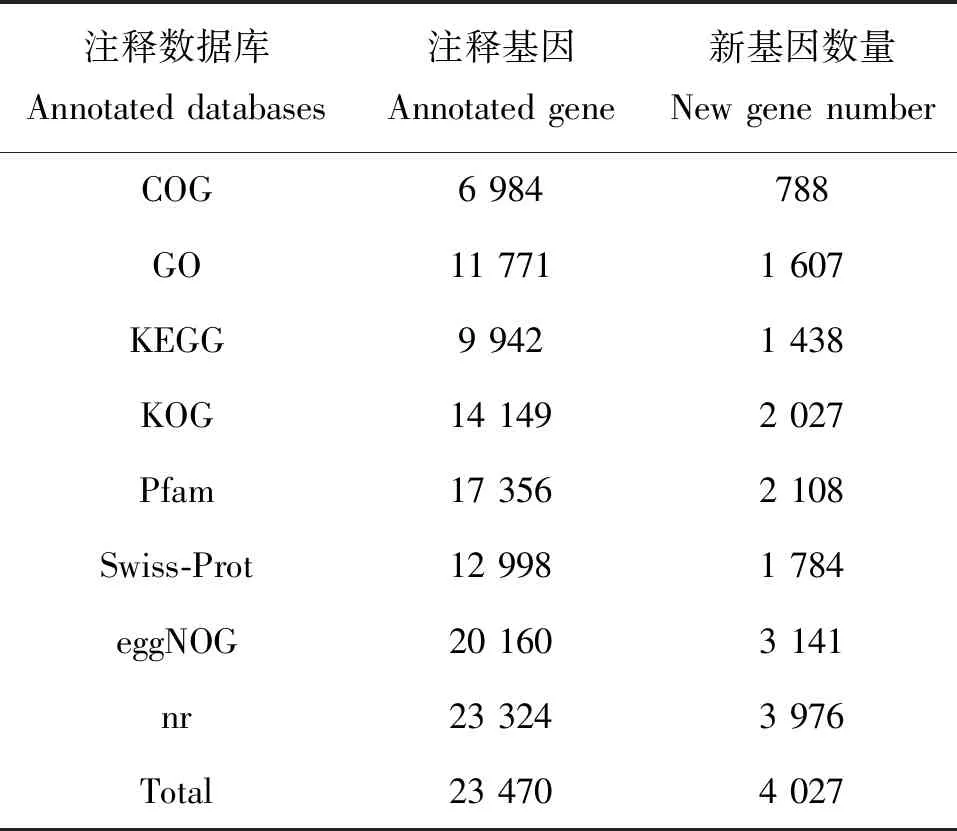
表3 新基因功能注释结果统计
2.3 美洲大蠊取食Vip3Aa蛋白中肠差异表达分析
Fold Change≥2、FDR<0.01为截断值,以取食PBS溶液为对照组,取食Vip3Aa蛋白后共筛选到2 302个差异基因,其中1 539个上调,763个下调(图1)。
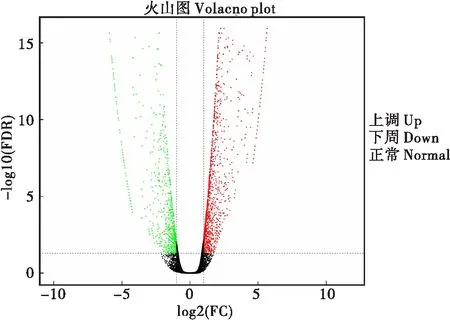
图1 差异基因火山图
2.4 差异表达基因GO功能注释和KEGG富集分析
2.4.1差异表达基因GO功能注释
对2 302个差异基因进行GO基因功能注释,由GO富集显示得到生物学功能条目2 218个(P<0.05),其中,生物过程(Biological process,BP)为1 313条,细胞组成(Cellular component,CC)为303条,分子功能(Molecular function,MF)为602条。富集程度最高的前5条生物过程为代谢过程(Metabolic process)、细胞过程(Cellular process)、单生物过程(Single-organism process)、生物调节(Biological regulation)、定位(Localization);富集程度最高的前5条细胞组成为膜(Membrane)、细胞(Cell)、细胞部分(Cell part)、膜部分(Membrane part)、细胞器(Organelle);富集程度最高的前5条分子功能为催化活性(Catalytic activity)、结合(Binding)、转运活性(Transporter activity)、结构分子活性(Structural molecule activity)、信号转导活性(Signal transducer activity)(见图2)。
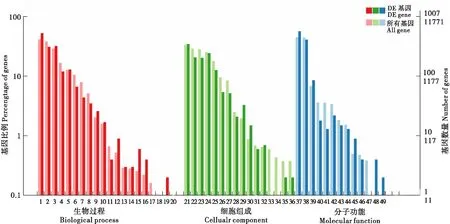
图2 差异表达基因GO注释分类
2.4.2差异表达基因KEGG通路富集分析
KEGG通路富集(P<0.05)结果显示Vip3Aa活性主要涉及调控溶酶体(Lysosme)、其他多糖降解(Other glycan degradation)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、糖胺聚糖降解(Glycosaminoglycan degradation)、昆虫激素合成(insect hormone biosythesis)、鞘糖脂生物合成(Glycospinggolipid biosynthesis)、药物代谢(Drug metabolism)、凋亡(Apoptosis)等信号通路(图3)。
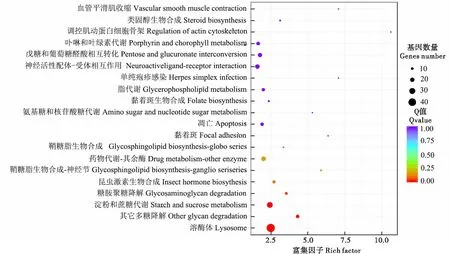
图3 差异表达基因KEGG通路富集分析
2.4 部分基因的qRT-PCR验证
分别选取GST8、ACHE、aminopeptidase和chymotrypsin基因进行qRT-PCR验证,以β-actin为内参基因。取食Vip3Aa后,GST8、ACHE、aminopeptidase和chymotrypsin基因均显著上调(t=3.15,P<0.01;t=4.95,P<0.01;t=2.21,P<0.05;t=2.48,P<0.05),与转录组测序结果基本一致(图4)。
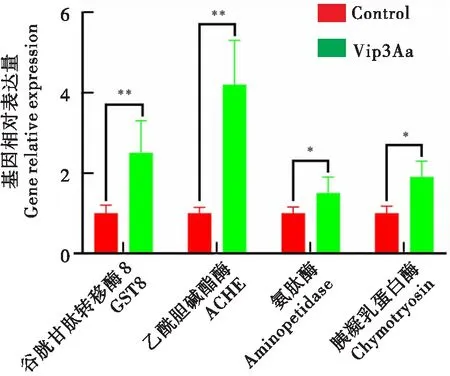
图4 qRT-PCR 检测GST8、ACHE、aminopeptidase和chymotrypsin基因
2.5 Vip3Aa对中肠溶酶体和凋亡的影响
2.5.1Vip3Aa对中肠凋亡和溶酶体相关基因影响
检索溶酶体和凋亡相关基因比较结果:溶酶体相关差异表达基因50个,其中有42个上调,8个下调。凋亡相关差异表达基因21个,其中有17个上调,4个下调(表4,表5)。
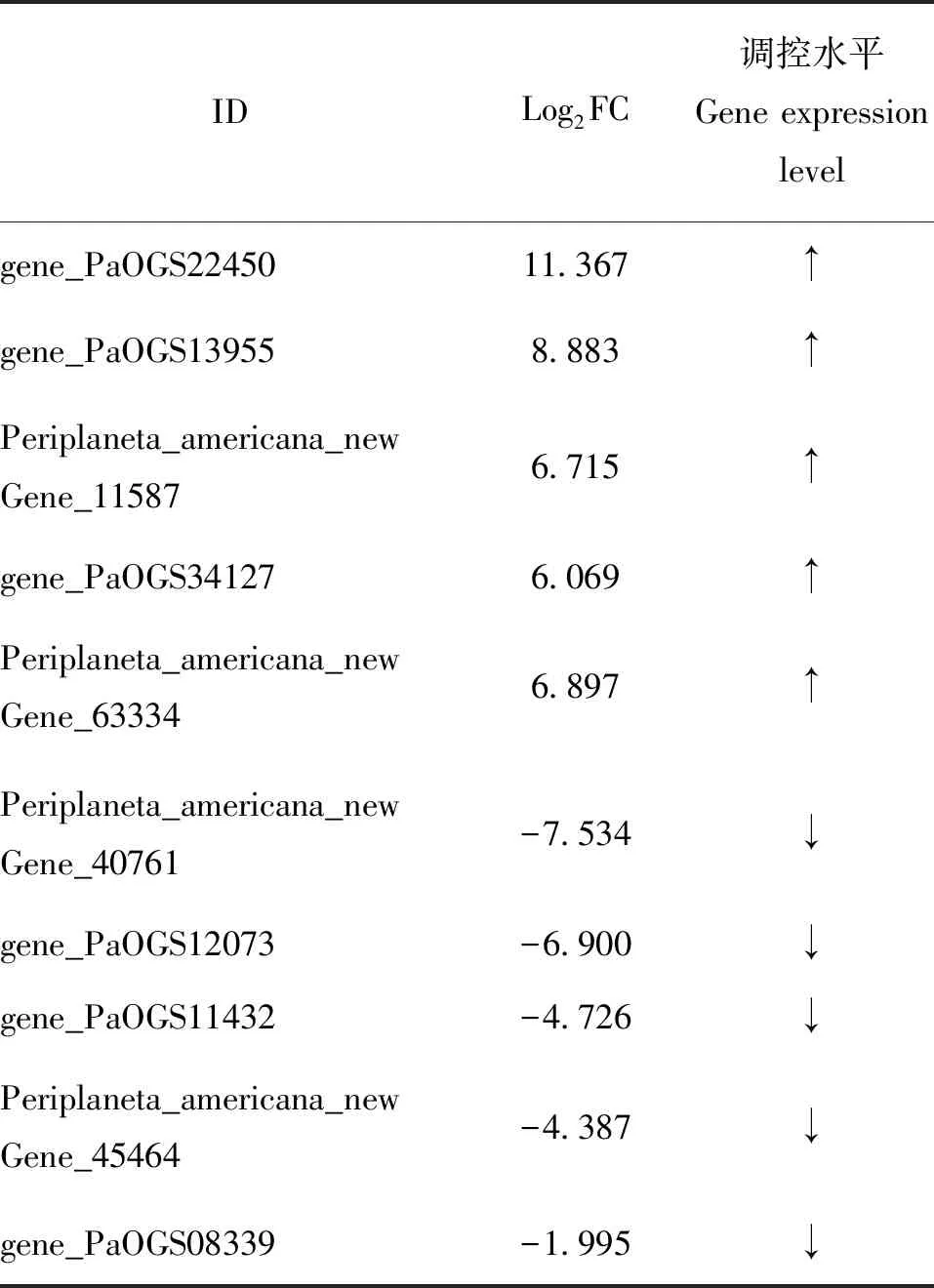
表4 部分溶酶体基因转录组测序差异倍数
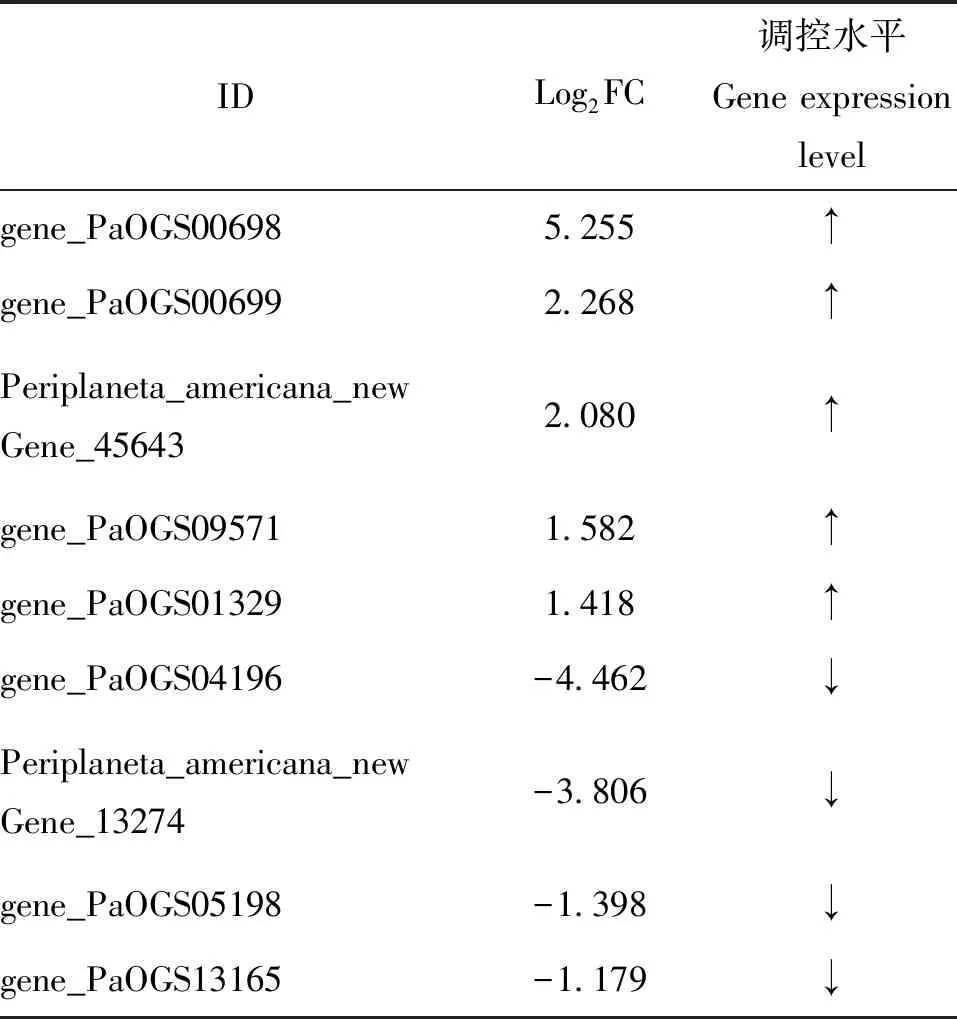
表5 部分凋亡转录组基因测序差异倍数
2.5.2透射电子显微镜(Transmission Electron Microscope, TEM)观察Vip3Aa对美洲大蠊中肠超微结构的影响
对照组无可见溶酶体,线粒体线粒体呈椭球形,结构完整,轮廓清晰(蓝色箭头)。Vip3Aa处理后,线粒体肿胀、空泡、破裂,出现大量次级溶酶体(红色箭头),提示Vip3Aa可以导致中肠上皮细胞结构的损伤,激活溶酶体(图5)。
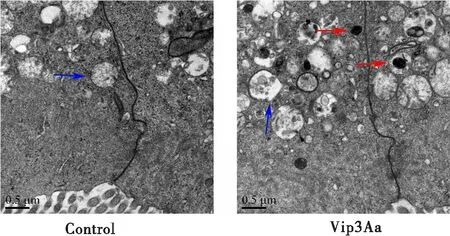
图5 Vip3Aa对美洲大蠊中肠超微结构的影响
2.5.3Hoechst 33342染色检测Vip3Aa对中肠上皮细胞凋亡的影响
正常中肠上皮细胞的细胞核呈现均匀蓝色荧光,Vip3Aa处理后,可见部分细胞的细胞核凝集、固缩、荧光强度增加(红色箭头标注),表现凋亡特征(图6)。
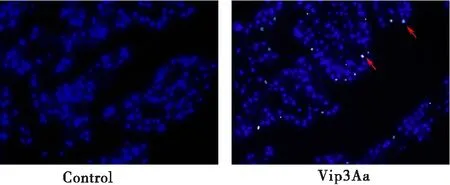
图6 Vip3Aa给药后对中肠上皮细胞凋亡的影响
3 结论和讨论
美洲大蠊是“四害”之一,也是最常见的家居害虫。美洲大蠊生活环境恶劣,可携带大量病原菌,其可通过爬行和取食等方式机械传播病菌(Salgado, 2021)。化学杀虫剂的长期使用,导致了美洲大蠊的耐药性、再猖獗,杀虫剂的残毒也对人类的身体安全造成一定损害,应限制化学杀虫剂的使用(Rahimianetal., 2019)。生物防治以其安全、高选择性、环境友好等优点,被认为是一种有潜力的防治方法,如黑胸大蠊Periplanetafuliginosa浓核病毒即被研发用于美洲大蠊的防治(Hanetal., 2013)。
本课题组前期研究发现苏云金杆菌产生的Vip3Aa蛋白具杀美洲大蠊作用,但其作用机制不明(Liuetal., 2020)。Vip3Aa蛋白主要损伤中肠,因此本文选取中肠进行了转录组分析。中肠是产生各类消化酶的主要部位,因此分别选取了4个消化酶基因进行qRT-PCR验证,证明所得转录组数据结果可靠。Vip3Aa蛋白处理后,共获得了2 302个差异DEGS,其中上调基因1 539个,下调基因763个。为揭示Vip3Aa蛋白杀美洲大蠊作用的分子生理机制,本研究对筛选到的差异基因进行了功能富集。Vip3Aa活性主要涉及调控溶酶体、其他多糖降解、淀粉和蔗糖代谢、糖胺聚糖降解、昆虫激素合成、鞘糖脂生物合成、药物代谢、凋亡等信号通路。溶酶体是一种膜性细胞器,通过多种途径介导细胞凋亡,溶酶体-线粒体途径中Cathepsins直接或间接导致线粒体通透性改变, 使线粒体促凋亡因子进入细胞质,最终诱导细胞死亡(Nagata, 2018)。
溶酶体诱导的凋亡是多种杀虫剂的作用机理,如Ningshen等(2017)将杀虫晶体蛋白(Crystal, Cry)蛋白注射入飞杨阿夜蛾Achaeajanata幼虫腹腔后,可见溶酶体激活引起组织溶解。印楝素可诱导溶酶体释放组织蛋白酶,引起中肠细胞凋亡,抑制橘小实蝇Bactroceradorsalis幼虫的生长(Zhaoetal., 2019)。本研究差异基因中包含溶酶体相关差异基因50个,凋亡相关差异基因21个,因此推测溶酶体可能参与Vip3Aa诱导的美洲大蠊中肠细胞凋亡。后续研究中分别采用透射电镜和Hoechst 33342染色观察了中肠组织变化。Vip3Aa处理后,可见大量次级溶酶体出现,部分线粒体肿胀破裂,细胞内出现凋亡形态改变,进一步证实,Vip3Aa蛋白可能通过上皮细胞溶酶体-线粒体损伤介导凋亡通路的激活发挥杀美洲大蠊作用。
综上所述,本研究通过转录组测序了比较Vip3Aa蛋白处理中肠的基因表达差异,并通过差异基因功能富集和病理学观察初步证实Vip3Aa蛋白可能通过上皮细胞溶酶体-线粒体损伤介导凋亡通路的激活发挥杀美洲大蠊作用,本研究有助于深入了解Vip3Aa蛋白的杀美洲大蠊作用,为将Vip3Aa蛋白用于美洲大蠊的生物防治提供理论依据。下一步的研究中,我们将在细胞水平和动物水平就Vip3Aa激活溶酶体的机制进行深入研究。

