大黄素对宫颈癌细胞体外转移活性和顺铂敏感性的影响及其机制研究*
王一娜,侯友翔,祖力皮亚木
(新疆医科大学附属肿瘤医院 妇科肿瘤放疗一病区,新疆 乌鲁木齐 830011)
宫颈癌是全世界女性第4大常见的恶性肿瘤,对社会造成较大的经济和医疗负担[1]。宫颈癌的治疗通常包括手术、化疗和放疗,但这些治疗策略并不足够[2]。各种化学药物,如贝伐单抗、盐酸拓扑替康和顺铂是宫颈癌化疗的一线药物,但临床应用时常出现严重的副作用和耐药性,导致患者肿瘤复发和进一步恶化[3]。因此,提高宫颈癌细胞对现有化疗药物的敏感性,对减少化疗药物的用量及其副作用的发生具有重要意义。
大黄素是一种从蓼科植物中分离出来的活性成分,具有抗菌、抗炎和抗氧化等作用。早期研究证明大黄素对许多肿瘤细胞具有抗增殖作用,如肺癌和胰腺癌等[4]。此外,大黄素对癌细胞的抗增殖作用与抑制蛋白质酪氨酸激酶相关蛋白磷酸化有关[5]。目前,有报道显示,大黄素对宫颈癌细胞具有抑制作用,其作用机制多与抑制细胞转移、促进凋亡有关[6]。然而,大黄素能否提高宫颈癌细胞对现有化疗药物(如顺铂)的敏感性仍不清楚。
研究发现,磷酸肌醇3激酶/蛋白激酶B(phosphoinositide-3-kinase/ protein kinase B,PI3K/Akt)信号通路影响细胞多种生物学功能,包括细胞增殖、凋亡和血管生成等[7]。临床研究表明,乳腺癌、前列腺癌、宫颈癌和肝癌组织中Akt和p-Akt的阳性表达率均较正常组织高[8]。此外,有研究发现大黄素能通过调控Akt通路,抑制肝癌细胞活性[9]。然而,大黄素对宫颈癌细胞的抑制作用是否与Akt通路相关,以及Akt通路是否影响宫颈癌细胞对大黄素的敏感性尚未见报道。因此,本研究开展了大黄素在宫颈癌细胞对顺铂敏感性方面的研究,以期为宫颈癌的治疗提供新思路。
1 材料与方法
1.1 主要材料、试剂及仪器
人宫颈癌细胞株HeLa细胞(广州泰勒生物科技有限公司),大黄素(广州云舟生物科技有限公司),Lipofectamine 3000(上海青旗生物科技有限公司),顺铂(美国MCE公司),AnnexinV-FITC细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技有限公司),Transwell chamber(美国安捷伦公司),RIPA细胞蛋白裂解液(上海爱必信生物科技有限公司),胎牛血清(武汉汉恒生物科技有限公司),PI3K、p-PI3K、Akt、p-Akt(美国Santa Cruz公司),GAPDH抗体(南京金斯瑞生物科技有限公司)。
倒置显微镜(上海蔡康光学仪器有限公司),多功能酶标仪(上海闪谱生物科技有限公司),流式细胞仪(美国BD公司),实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 细胞培养
人宫颈癌细胞株HeLa细胞置于RPMI 1640培养基(含10%胎牛血清)中,在37 ℃和5%二氧化碳培养箱中培养。参照文献[10-11]将细胞分为4组:对照组(磷酸盐缓冲液)、顺铂组(顺铂10 μmol/L)、大黄素组(大黄素50 μmol/L)、联合组(顺铂10 μmol/L +大黄素50 μmol/L)。培养细胞至对数生长期后按上述分组方法处理细胞48 h开展后续实验。
1.3 细胞克隆形成试验
当细胞生长至对数生长期时,胰酶消化收集细胞,使用培养基稀释细胞并将细胞按2 000个/孔的密度接种于6孔板,培养24 h后,按照1.2中分组处理细胞,置于BME琼脂培养基中培养。将培养物置于5%二氧化碳培养箱中37 ℃培养14 d,使用Image-Pro Plus软件在显微镜下计数细胞集落。
1.4 Transwell实验检测细胞侵袭能力
在室温下将50 μL基质胶添加到上室预先包被1 h,按不同组别处理细胞后,将200 μL细胞悬液接种到上室中,并将500 μL完全培养基添加到下室,孵育24 h,将下部小室中的细胞用4%多聚甲醛固定15 min,5%结晶紫染色,棉签除去上室中未迁移的细胞,显微镜下拍照记录并计数5个随机视野中的细胞数。
1.5 MTT法检测细胞增殖能力
将各组细胞按3 000个/孔的密度接种于96孔板中,培养24、36和48 h后加入20 μL 5% MTT溶液,37 ℃培养4 h,150 μL二甲基亚砜溶解紫色甲臜晶体,通过多功能酶标仪测量490 nm处的光密度(optical density,OD)值。
1.6 流式细胞术检测细胞凋亡
按不同组别处理细胞48 h后,用AnnexinV-FITC细胞凋亡检测试剂盒检测各组HeLa细胞凋亡情况。用不含EDTA的胰酶消化HeLa细胞,然后将200 μL细胞悬液与5 μL Annexin V、1 μL PI在室温下孵育15 min。使用BD LSR Ⅱ流式细胞仪检测染色细胞凋亡率。
1.7 划痕试验检测细胞迁移能力
将HeLa细胞按5×104个细胞/孔接种在24孔板中,直至细胞生长贴壁,然后用200 μL移液枪吸头划出一个粗细均匀的划痕。磷酸盐缓冲液洗去分离的细胞,加入新鲜无血清培养基,并按照不同组别处理细胞。24 h后使用显微镜在100倍下随机选择区域进行拍照,采用Image J软件计算迁移面积。
1.8 Western blotting检测PI3K/Akt信号通路蛋白的表达
采用RIPA裂解缓冲液从细胞中提取蛋白,BCA试剂盒定量,10% SDS-PAGE分离蛋白,转移到PVDF膜。室温下用5%脱脂牛奶在TBST中封闭细胞膜1 h,并在4 ℃条件下加入一抗过夜。TBST洗涤膜3次,加入二抗在室温下孵育1 h,依次进行孵育、冲洗、显影、定影,计算目的蛋白相对表达量。
1.9 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大黄素联合顺铂抑制宫颈癌细胞的增殖
对照组、顺铂组、大黄素组、联合组细胞集落形成数分别为(286.56±12.68)、(109.77±9.21)、(116.55±8.89)、(56.67±5.98)个,经方差分析,差异有统计学意义(F=22.896,P=0.002)。与对照组比较,大黄素组和顺铂组宫颈癌细胞集落形成数减少(P<0.05);与对照组、大黄素组、顺铂组比较,联合组的宫颈癌细胞集落形成数减少(P<0.05)。见图1。
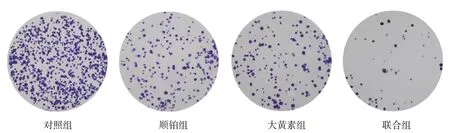
图1 各组细胞集落 (结晶紫染色×200)
对照组、顺铂组、大黄素组、联合组细胞24、36和72 h的OD值比较,经重复测量设计的方差分析,结果:①不同时间点OD值比较,差异有统计学意义(F=396.000,P=0.000);②各组细胞OD值比较,差异有统计学意义(F=158.500,P=0.000),联合组OD值低于对照组、大黄素组、顺铂组(P<0.05);③各组细胞OD值的变化趋势比较,差异有统计学意义(F=39.100,P=0.000)。大黄素能抑制宫颈癌细胞的增殖,并能提高顺铂对宫颈癌细胞的抑制作用。见表1和图2。
表1 各组宫颈癌细胞不同时间点OD值的变化 (±s)
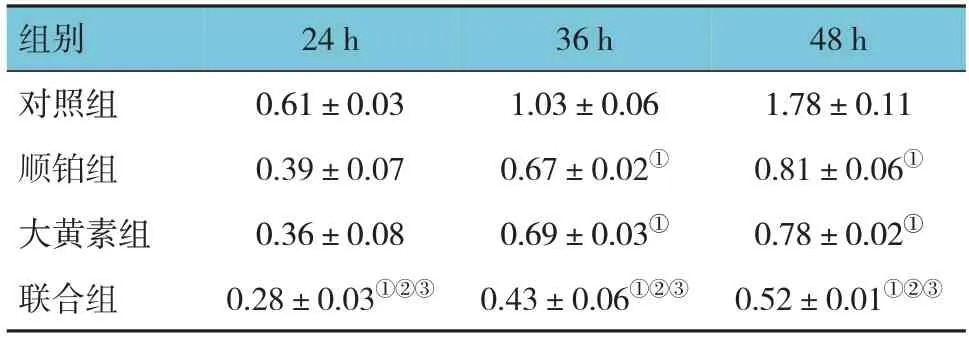
表1 各组宫颈癌细胞不同时间点OD值的变化 (±s)
注:①与对照组比较,P <0.05;②与大黄素组比较,P <0.05;③与顺铂组比较,P <0.05。
组别对照组顺铂组大黄素组联合组24 h 0.61±0.03 0.39±0.07 0.36±0.08 0.28±0.03①②③36 h 1.03±0.06 0.67±0.02①0.69±0.03①0.43±0.06①②③48 h 1.78±0.11 0.81±0.06①0.78±0.02①0.52±0.01①②③
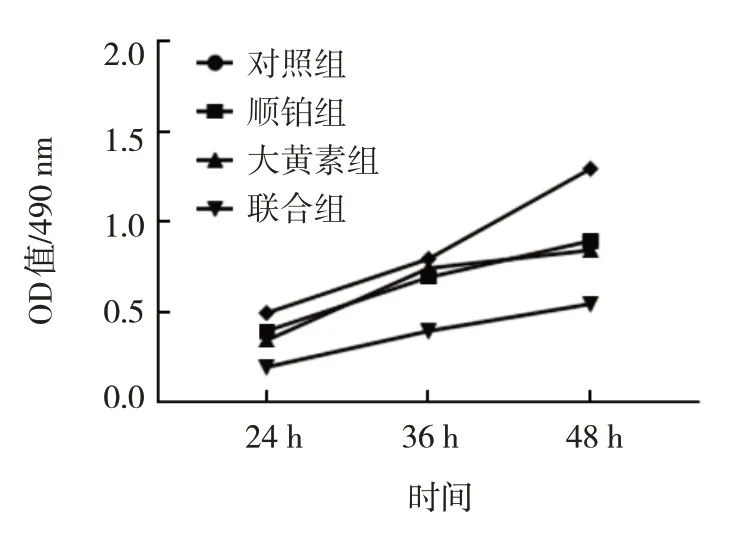
图2 各组宫颈癌细胞OD值的变化趋势
2.2 大黄素联合顺铂抑制宫颈癌细胞的转移
对照组、顺铂组、大黄素组、联合组细胞侵袭数和迁移率比较,经方差分析,差异均有统计学意义(F=32.783和19.236,P=0.001和0.003)。与对照组比较,大黄素组、顺铂组细胞侵袭数和迁移率均减少(P<0.05);与对照组、大黄素组、顺铂组比较,联合组细胞侵袭数和迁移率均减少(P<0.05)。大黄素能抑制宫颈癌细胞的转移,并提高顺铂对宫颈癌细胞的抑制作用。见表2和图3、4。
表2 各组宫颈癌细胞的转移能力比较 (±s)

表2 各组宫颈癌细胞的转移能力比较 (±s)
注:①与对照组比较,P <0.05;②与大黄素组比较,P <0.05;③与顺铂组比较,P <0.05。
细胞迁移率/%81.33±13.51 43.89±7.38①46.93±10.12①21.35±8.66①②③19.236 0.003组别对照组顺铂组大黄素组联合组F 值P 值细胞侵袭数/(个/HP)122.87±11.82 71.23±12.82①67.21±15.33①28.36±7.25①②③32.783 0.001
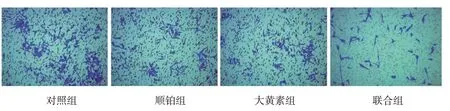
图3 各组宫颈癌细胞侵袭能力 (结晶紫染色×200)

图4 各组宫颈癌细胞划痕试验 (×100)
2.3 大黄素联合顺铂促进宫颈癌细胞凋亡
对照组、顺铂组、大黄素组、联合组的细胞凋亡率分别为(5.31±0.51)%、(11.19±1.12)%、(12.13±1.09)%、(23.85±2.35)%,经方差分析,差异有统计学意义(F=8.872,P=0.036)。与对照组比较,大黄素组和顺铂组宫颈癌细胞凋亡率升高(P<0.05);与对照组、大黄素组、顺铂组比较,联合组宫颈癌细胞凋亡率升高(P<0.05)。大黄素能促进宫颈癌细胞凋亡,并提高顺铂对宫颈癌细胞的促凋亡作用。见图5。
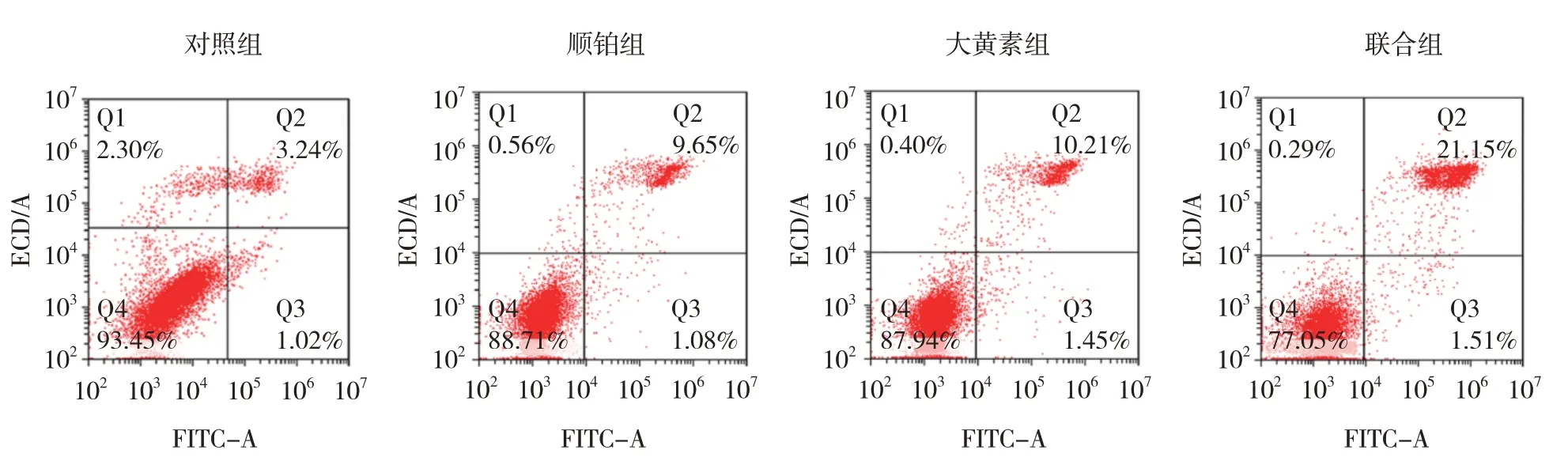
图5 各组宫颈癌细胞流式细胞图
2.4 大黄素联合顺铂抑制宫颈癌细胞PI3K/Akt信号通路激活
对照组、顺铂组、大黄素组、联合组PI3K/Akt磷酸化水平比较,经方差分析,差异有统计学意义(F=8.113和9.273,P=0.021和0.017)。与对照组比较,大黄素组和顺铂组PI3K/Akt信号通路被抑制,PI3K和Akt蛋白磷酸化水平均降低(P<0.05);与对照组、大黄素组、顺铂组比较,联合组PI3K和Akt蛋白磷酸化水平均降低(P<0.05)。大黄素能抑制宫颈癌细胞PI3K/Akt信号通路激活,大黄素联合顺铂后对PI3K/Akt信号通路的抑制作用增强。见表3和图6。
表3 各组细胞PI3K和Akt蛋白磷酸化水平比较 (±s)
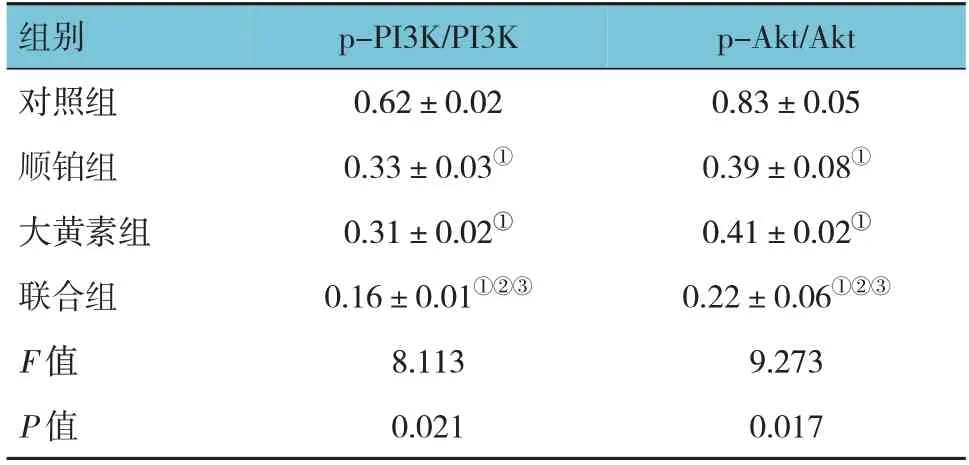
表3 各组细胞PI3K和Akt蛋白磷酸化水平比较 (±s)
注:①与对照组比较,P <0.05;②与大黄素组比较,P <0.05;③与顺铂组比较,P <0.05。
p-Akt/Akt 0.83±0.05 0.39±0.08①0.41±0.02①0.22±0.06①②③9.273 0.017组别对照组顺铂组大黄素组联合组F 值P 值p-PI3K/PI3K 0.62±0.02 0.33±0.03①0.31±0.02①0.16±0.01①②③8.113 0.021
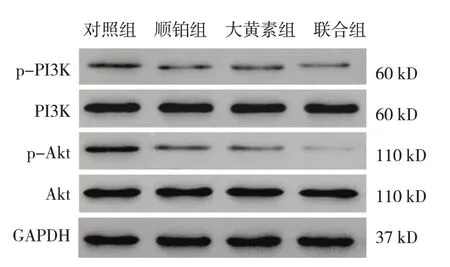
图6 各组宫颈癌细胞PI3K/Akt信号通路相关蛋白的表达
3 讨论
目前,宫颈癌的预防和治疗仍面临巨大挑战,宫颈癌患者预后不良的主要原因包括肿瘤细胞侵袭和转移[12]。化学药物通过抑制肿瘤细胞的增殖,诱导肿瘤细胞的凋亡,治疗多种肿瘤。作为铂类化疗药物之一,顺铂化疗方案被广泛用于晚期宫颈癌的治疗,其可以通过诱导DNA损伤、细胞周期停滞和细胞凋亡来发挥抗肿瘤作用[13]。然而,由于患者对化疗药物的敏感性低,甚至产生耐药,仍有较高的发病率[14]。因此,提高肿瘤细胞对化疗药物的敏感性,并寻找可能影响宫颈癌疗效的靶点对宫颈癌的诊疗至关重要。本研究结果表明,大黄素可以调节宫颈癌细胞的增殖、侵袭和迁移能力,促进宫颈癌细胞凋亡,并能提高宫颈癌细胞对顺铂的敏感性。
蒽醌类为具有抗肿瘤潜力的化合物。大黄素是一种蒽醌,存在于许多植物的根部和树皮中。其是各种中草药的活性成分,包括大黄、何首乌、芦荟和决明子[15]。据报道,大黄素具有抗肿瘤、促进细胞凋亡和抗增殖的作用。既往研究发现,大黄素能够破坏分裂纺锤体,在被检细胞的超微结构中,高尔基体中存在大量分散的池泡,证明其组织紊乱。此外,大黄素还能诱导Phalloidin标记的肌动蛋白丝的降解,以及在细胞质中形成聚集物[16-17]。本研究结果表明,大黄素处理后,宫颈癌细胞增殖、侵袭和迁移能力降低,细胞凋亡率增加,并且宫颈癌细胞对顺铂更加敏感。调节PI3K/Akt信号通路对细胞的增殖、生存、死亡和代谢非常重要,该通路的失衡与癌症的发生、发展密切相关[18]。因此,探索PI3K/Akt信号通路的靶向调节剂具有很大的潜力。大量PI3K/Akt信号通路调节剂候选药物正在开发中,有些已被应用于治疗癌症患者。但是PI3K/Akt信号通路仍然对治疗有抵抗力[19]。最新研究表明,大黄素可调节PI3K/Akt信号通路,使肝癌细胞对索拉非尼敏感性增加。另外研究发现,大黄素可通过调节PI3K/Akt信号通路,改善免疫性血小板减少症的间质干细胞凋亡[20]。本研究结果表明,大黄素可以抑制宫颈癌细胞系PI3K/Akt信号通路的激活,从而干预宫颈癌细胞的发展。
综上所述,大黄素可以调节宫颈癌细胞的增殖、侵袭和迁移能力,促进宫颈癌细胞凋亡,并能提高宫颈癌细胞对顺铂的敏感性,其作用可能与PI3K/Akt信号通路有关。

