干扰NLRP3及NLRP12对IL-6诱导全身型幼年特发性关节炎滑膜成纤维细胞增殖影响及机制研究
谢颖 李丰 唐盈 程苏云 张松 韦茹 徐彩虹 曾华松
全身型幼年特发性关节炎(sJIA)为慢性关节炎及全身表现,如周期性发热、皮疹、肝脾、淋巴结肿大,及持续升高的炎症指标,常常伴有实质性的关节破坏,最终致残[1]。sJIA 的发病机制仍未明确,血清和滑膜高水平的IL-6 与sJIA 患者多个临床表现及实验室指标有关,拮抗IL-6 受体可显著抑制sJIA 进程[2]。IL-6 可诱导滑膜细胞变类风湿关节炎成纤维滑膜(RASF)细胞,形成滑膜炎,最终导致骨质破坏。
目前认为NLR 受体可促进炎症反应导致自身免疫性疾病发生,NLRP3突变后,会导致IL-1β持续分泌,将会导致自身炎症性疾病,如sJIA 的发生。我们前期[3]qPCR 发现活动期sJIA 患儿外周血NLRP3,NLRP12 mRNA 存在高表达现象,并且与凋亡相关斑点样蛋白(ASC)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)mRNA 表达及JIA 的疾病活动度呈现正相关,那么IL-6持续升高对NLRP3、NLRP12有怎样影响?我们将在下面研究进一步探讨。
1 临床资料
1.1 一般资料研究方案获得广州市妇女儿童医疗中心伦理委员会批准(批字(2021)第010A01-1)。
1.2 实验步骤和方法(1)5、10 和50 μmol/L 的不同浓度IL-6 刺激RASF 及细胞培养;(2)si-NLRP12 及NLRP3 抑制剂转染及MMT 实验;(3)IL-6刺激及MMT 细胞增殖实验;(4)RNA 提取、逆转录及QPCR;(5)ELISA 测定IL-1,IL-6,IL-18,TNF-α浓度;
1.3 统计学处理采用SPSS13.0 进行统计分析,NLRP3,NLRP12,ASC,NF-κB mRNA 相对表达量用2-δδCT 表示,组间比较用非参数检验(Kruskal-Wallis 检验),IL-1、IL-18,TNF-ɑ 浓度比较采用数据处理应用统计学软件SPSS13.0。实验数据均以(±s)表示,用单因素方差分析比较组间及组内差别。
2 结 果
2.1 IL-6诱导RASF 增殖及对NLRP3、NLRP12影响 见表1-4。

表1 CCK-8 检测各个时间段不同浓度IL-6 刺激RASFs增殖的OD 值
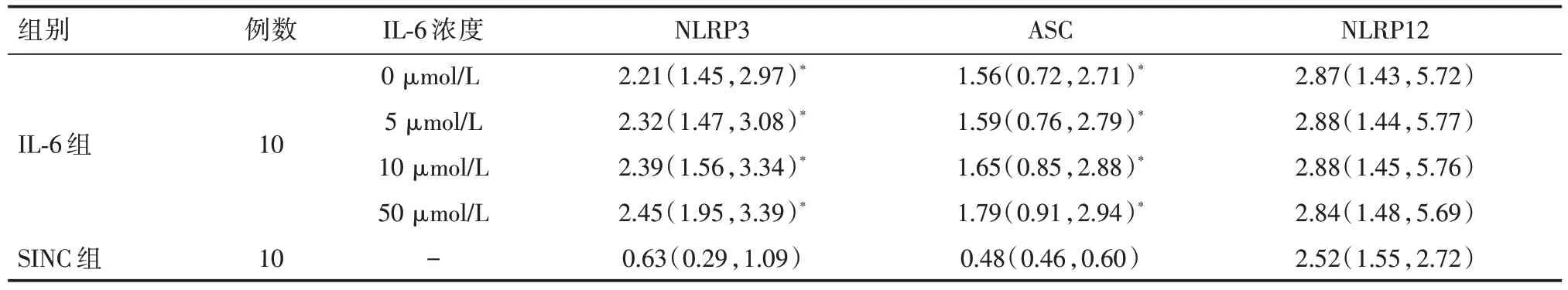
表2 IL-6 对NLRP3、ASC、NLRP12 影响(2-ΔΔCT)[M(P25,P75)]

表3 转染后siRNA-1 和siRNA-2 组NLRP3 及NLRP12 mRNA(2-ΔΔCT)
2.2 抑 制NLRP3 及NLRP12 对IL-6 诱 导RASF增殖的影响 见表3。
2.3 抑 制NLRP3 及NLRP12 对IL-6 诱 导RASF细胞炎症通路及炎症因子影响见表5。
3 讨 论
sJIA 目前认为T 细胞与巨噬细胞被大量激活将产生过多的细胞因子,介导关节组织损伤,如IL-6,TNF-α 等,IL-6 可诱导滑膜成纤维细胞及关节软骨细胞合成前列腺素E2 及金属蛋白酶合成。我们用不同浓度(5、10 和50 μmol/L)的IL-6 刺激RASFs 后,RASF 数量随IL-6 浓度和刺激时间较对照剂组明显升高,提示IL-6 可促进RASF 细胞增殖(P<0.05),同时TNF-a 明显升高,提示IL-6 为RASF细胞活化关键分子。同时,本实验也发现IL-6 可诱导RASF 中炎症小体NLRP3 的产生。NLRP3 是促进前炎症因子产生的重要胞内蛋白复合物,近年来NLRP3 在类风湿关节炎(Rheumatoid Arthritis,RA)中的研究成为了新的热点,研究表明NLRP3 炎症小体与RA 病情严重程度及动脉硬化进展有关[4]。NLRP3 基因多态性可能与RA 心血管事件的发生息息相关[5]。Mathews RJ 等[6]发现NLRP3 在RA 外周血单个核细胞中表达升高有统计学意义。我中心SJIA 之前有关治疗方案[7]的研究则通过使用IL-1β 受体拮抗剂治疗难治性的JIA,侧面说明了NLRP3 炎症小体在RA 发病中的地位。我们前期研究发现NLRP3 在JIA 活动组中高表达。RASF 异常增殖是RA 其中主要机制,那么阻断NLRP3 对IL-6 诱导的RASF 增殖有怎样影响呢?本研究通过使用siRNA 干扰NLRP3 表达,可以减少IL-6 诱导的RASF 增殖。研究表明IL-1 及IL-18 为NLRP3 活化后下游炎症因子,可促进sJIA的发生发展,本实验中在IL-6 刺激下RASF 细胞IL-1,IL-18 升高,提示IL-6 可能参与NLRP3 激活,敲降NLRP3mRNA 表达,可明显降低IL-6 诱导的RASF 中IL-1 及IL-18mRNA 表达,提示IL-6 可能通过NLRP3 促进IL-1 及IL-8 表达。

表4 转染NLRP3 及NLRP12 siRNA 在IL-6 不同浓度刺激后RASF 细胞NLRP3、NLRP12 的表达(2-δδCT)

表5 转染NLRP3 及NLRP12 siRNA 在IL-6(50 ug/ml)刺激后RASF 细胞培养液中IL-1、IL-18、TNF-ɑ 浓度(IU/ml)变化
NLRP12 为新近发现的炎症小体成员,我们前期研究发现,在JIA 外周血单核细胞中NLRP12 升高,但具体作用不明了。最近的一些研究将NLRP12 与炎症反应的负向调控也联系起来,本研究表明,IL-6 刺激RASF,qPCR 结果显示NLRP12 则无明显变化,而敲降NLRP12 mRNA,则促进IL-6诱导的RASF 细胞增殖,提示NLRP12 在RASF 细胞增殖起负性调节作用。
目前多认为核因子-κB 受体激活因子(receptor activator of NF-κB,RANK)/RANKL/骨保护(osteoprotegrin,OPG)系统是调节破骨细胞分化和功能最重要的传导通路,促炎细胞因子如TNF-α、IL-1、IL-6 和IL-17 等在RA 的骨微环境中影响着骨的重建,对破骨细胞的分化起重要作用[8],我们发现干扰NLRP3 及NLRP12 可对IL-6 诱导NF-κB 升高有不同程度的影响。
那么阻断IL-6 是否能影响NLRP3、NLRP12 表达呢?本研究发现使用IL-6受体阻断剂组IL-1、IL-18 浓度较对照组明显下降(P<0.05);IL-6 受体拮抗剂组中NLRP3、ASC mRNA 表达水平低于疾病对照组(P<0.05)而NLRP12 则无明显变化(P>0.05);提示拮抗IL-6 刺激,可下调NLRP3 表达,而对NLRP12 无明显影响;
综上所述,本研究为IL-6 诱导RASF 细胞增殖机制的初步研究,NLRP3 的表达升高,NLRP12 减低可能是IL-6 诱导RASF 细胞增殖中重要的分子事件NLRP3及NLRP12可能分别通过正负调控NFκB 的表达来抑制IL-6 诱导的RASF 细胞增殖,但具体的过程和机制还有待深入探讨。

