膜技术在单克隆抗体分离纯化中的应用研究进展
张 昊, 张君怡, 武浩然, 杨 欣, 樊 荣,陈国强, 陈向荣, 罗建泉*, 万印华*
(1. 生化工程国家重点实验室, 中国科学院过程工程研究所, 中国科学院大学, 北京 100190;2. 化学与生物工程学院, 北京科技大学, 北京100083)
生物大分子药物,作为代表性的生物药物,是一类利用现代生物技术生产的用于疾病诊断、治疗和预防的生物大分子,包括单克隆抗体(简称单抗)、DNA重组技术生产的蛋白质、多肽、酶和细胞因子等.该类药物具有靶向性强、特异性高、毒副作用低和灵敏度高等特点,是当前生物医药领域的研究前沿,发展迅速且应用前景广泛.其中,单抗在生物药市场中占据主导地位,自1986年美国食品药物管理局批准了第一个用于防治急性移植排斥反应的单抗OKT3以来 ,目前已有超过100个抗体药物被批准[1].2018年全球单抗销售收入达到1 152亿美元,占同期全球生物药市场比重高达55.3%[2].根据2023年单克隆抗体全球市场报告预测,其销售收入在2026年有望超过1 922亿美元[3].
单抗由经过特定抗原处理过的B淋巴细胞与骨髓瘤细胞融合后得到的杂交瘤细胞产生.杂交瘤细胞同时具有无限增殖及分泌抗体的能力,利用小鼠腹腔腹水培养或体外细胞培养将杂交瘤细胞增殖后,分泌产生的抗体需要通过一系列纯化过程才能制成产品.随着上游培养方式的改进,单抗滴度越来越高,这对下游纯化工艺提出了更高的要求,使得下游纯化成本进一步增加,目前占总生产成本的50%~80%[4].因此,亟需开发低成本、快速高效、高质量的连续化分离纯化技术与装备.
单抗分离纯化过程主要分为澄清、捕获、纯化与精制、病毒去除和预制剂5个部分.传统纯化过程首先会通过离心分离、深层过滤或错流过滤(TFF)技术去除单抗培养液中的不溶性杂质.之后利用固定了蛋白A的树脂或者硅胶球颗粒的柱层析分离技术进行蛋白捕获,实现目标蛋白的富集和浓缩,同时降低杂质成分,提高产品浓度和纯度.然后,利用离子交换、疏水或凝胶柱层析技术进一步去除料液中的宿主细胞蛋白(HCPs)和宿主细胞DNA、过程杂质(泄漏的蛋白A配体、内毒素和病毒污染物)以及产物变体(聚集体和电荷变体)等.随后采用病毒过滤膜再次清除内源和外源病毒.最后通过超滤和渗滤工艺进行蛋白浓缩和缓冲液置换[5].然而,在蛋白捕获、纯化与精制过程中柱层析分离技术存在操作压力高、操作时间长、处理量小和放大困难的问题.近年来,研究者们尝试将膜分离技术与层析技术相结合,通过在膜孔中接枝不同类型的配体基团,制备出具有亲和作用、离子交换、疏水吸附等功能的膜层析代替柱层析.膜层析技术因其分离效率高、系统压降低、操作流速高、成本低、易于扩大化生产等优势在抗体捕获、纯化与精制方面也展现出良好的应用前景[4].因此膜分离技术在单抗纯化过程中应用广泛且极具前景.
本文综述膜技术在单抗下游分离纯化工艺中不同工段包括澄清、捕获、纯化与精制、预制剂单元中的应用及基本原理,主要包括深层过滤膜、膜层析介质及装备、病毒过滤膜和用于蛋白浓缩和缓冲液置换的超滤/渗滤膜过程(图1).介绍分离膜在各个操作单元中的应用现状和面临的挑战.最后对膜分离技术在生物药纯化方面的发展趋势进行了展望.
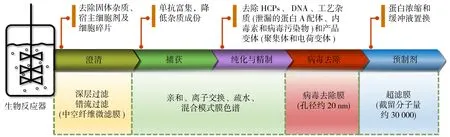
图1 膜分离技术单抗纯化工艺中的应用Fig.1 Application of membrane separation technology for purification of monoclonal antibody
1 澄清
澄清过程主要用于清除系统残留的固体和细胞碎片,降低与过程和产品相关的杂质水平,从而减轻后续层析和过滤负荷.深层过滤和错流过滤在单抗澄清工艺中应用广泛.
1.1 深层过滤
大多数商品化深层过滤介质是由纤维素基质、助滤剂和黏结剂组成,并且具有大量的半通孔及贯通孔的异质结构.相比于表面过滤,深层过滤发生在整个膜的纵深.其中纤维素的直径和装填密度决定了深层过滤膜的孔径.具有高比表面积的助滤剂如硅藻土、活性炭等可以通过吸附作用去除较小的细胞碎片、蛋白质和DNA.黏合剂主要用于维持滤膜的结构稳定性.因此,基于多种物质共同构成的深层过滤膜其杂质去除机制是多样化的,可能同时包括尺寸筛分、静电作用、疏水吸附等作用机理[6].Millipore公司的ClarisolveTM深层过滤器对细胞密度为15×106~20×106的仓鼠卵巢(CHO)细胞培养液的处理量可达100 L/m2,如采用酸沉淀法或壳聚糖等高分子絮凝剂絮凝预处理可使深层过滤器的处理量提高3倍以上[7].除了培养液的澄清,深层过滤也常用作纯化过程的预处理步骤,以去除HCPs、DNA、蛋白变体等杂质,提高后续纯化效果.通过膜改性或者添加荷电聚合物也可以强化深层过滤膜的澄清效果.Metzger等[8]证明3M公司的EmphazeTM阴离子交换深层过滤膜可以实现3 log的DNA去除和7 log的内毒素去除,同时HCPs含量也有小幅下降,因此显著降低了后续阳离子交换层析柱中的污染.然而,多数深层过滤器是死端过滤模式,无法实现细胞截留回用,因此难以与灌流式生物反应器耦联进行连续生产.
1.2 错流过滤
基于中空纤维微滤膜的TFF工艺具有占地面积小、可靠性高、澄清效果好的优势,澄清后的产品可以直接与蛋白A层析柱相结合[9].该工艺可以与灌流式生物反应器结合进行连续生产,在澄清过程中将截留的细胞返回到反应器中,同时回收透过液中的单抗产物进入后续捕获和精制工艺.然而,澄清过程中膜污染严重、产物截留率高等问题限制了其商业化进程.为了解决上述问题,大量的研究工作通过选择具有合适膜孔径、膜材料、表面理化性质的分离膜,优化膜操作参数如通量、错流速度、跨膜压力、进料体积等减小膜污染和产物截留率.Wang等[10]用孔径从数百kDa到0.65 μm的中空纤维微滤膜澄清单抗培养液时发现尺寸为20~200 nm与膜孔径相近的颗粒是导致膜孔堵塞和产物截留率高的主要原因.使用孔径大于2 μm的中空纤维膜进行澄清时可保证在整个澄清过程中产物几乎完全透过,同时实现细胞的完全截留.Pinto等[11]也得到了相同的实验结果,发现相比于孔径为0.2 μm和0.5 μm的微滤膜,1 μm和4 μm的大孔滤膜可以有效解决产物截留率高的问题,然而孔径越大透过液中杂质越多,为了避免对后续树脂层析捕获过程的影响,需要使用深层过滤装置对澄清后的料液进行预处理.除了选择合适的分离膜及优化操作参数,研究者们也改进膜组件的运行模式,将错流过滤改为交替错流过滤(ATF),即通过交替改变进料液的流动方向以有效缓解膜污染,提高产品收率.另外,用低剪切离心泵代替蠕动泵也可以减少细胞破损,从而降低膜污染和产品损失.
2 捕获、纯化与精制
澄清后的培养液中抗体蛋白浓度较低,约0.5~5 mg/mL,首先会通过蛋白A层析柱特异性捕获目标蛋白,实现目标蛋白的富集和浓缩,降低杂质成分,提高产品浓度和纯度.捕获在层析柱上的目标蛋白经过低pH下洗脱和灭活过程后进入一系列层析过程进行纯化和精制,以去除HCPs、DNA、工艺杂质(泄漏的蛋白A配体、内毒素和病毒污染物)和产品变体(聚集体和电荷变体).在过去的二十年中,膜层析技术在单抗纯化过程中表现出极高的应用潜力.层析膜是将功能配基接枝固定在分离膜孔内制备得到的,可通过流体对流传质完成单抗吸附和脱附,与基于扩散传质的树脂填料柱层析相比,膜层析在流通模式下的对流传质阻力小、压降低,从而大幅提高了操作通量和纯化效率,同时层析膜表面配体与生物大分子的接触几率高,提高了配体的利用率.另外使用膜层析可以减少缓冲液的用量,降低操作成本(图2).但是,相比于大孔树脂微球,层析膜仍然存在比表面积小、结合容量低的问题[12].膜层析一般通过亲和、离子交换、疏水吸附作用对目标产物进行捕获、纯化和精制,根据配体与目标分子的相互作用方式,可主要分为亲和层析膜、离子交换层析膜、疏水层析膜和混合模式层析膜.目前商品化层析膜主要生产企业包括Millipore、Pall和Sartorius等;纤维素、再生纤维素、尼龙、聚乙烯分离膜具有理化性质稳定、机械强度高、易于功能化等特点,常用于层析膜的基膜;与分离膜结合的亲和配体主要有蛋白A、过渡金属离子和色素分子等;离子交换配体有氨基、磺酸基等离子交换基团;疏水配体有甲基、戊烷和苯基等.

图2 液体传递模式示意图[13]Fig.2 Schematic diagram of different mass transfer modes[13]
2.1 膜层析用于单抗捕获
膜层析用于单抗捕获的操作模式为结合-洗脱模式.使用蛋白A亲和配体用于抗体捕获已经成为生物制药领域的标准步骤,蛋白A有5个同源结构域,可以与单抗中的Fc片段特异性结合,具有结合力强、选择性高等优点,是目前最常用、最有效的亲和配体[14].Boi等[15]使用Sartorius生产的一种以醋酸纤维素多孔膜为基底的新型蛋白A亲和层析膜用于单抗捕获,在目标蛋白流穿量低于10%时其最大动态结合容量(DBC10%)为8.7 mg/mL,回收率高于95%.Chantal等[16]使用Sartobind®Protein A 2 mL亲和层析膜对澄清后的单抗培养液进行捕获,实验测得DBC10%为5.9 mg/mL,在pH 3.5和NaCl浓度为0.15 mol/L时进行洗脱时,单抗回收率大于95%,聚集体含量仅为0.26%.蛋白A亲和配体虽然具有优异的单抗捕获能力,但其价格十分昂贵,一般蛋白A树脂售价在每升8 000~15 000美元.为了降低纯化成本,一些非蛋白A的亲和层析膜、离子交换层析膜和疏水层析膜也被大量尝试用于单抗捕获.Bayramoglu等[17]将仿蛋白A结构的染料配体活性绿固定在分离膜上用于分离血清中的免疫球蛋白(IgG),由于对白蛋白的非特异性吸附,洗脱液中IgG的纯度仅为81%,回收率为67%.Bresolin等[18]将亚氨基二乙酸作为阳离子交换配体固定在聚乙烯醇中空纤维膜上用于单抗纯化,所制备的阳离子交换吸附膜层析材料最大吸附容量为70 mg/mL,DBC为3.1 mg/g,洗脱液中单抗纯度可达94.3%.向该层析膜进一步螯合Zn2+后所制备的金属亲和层析膜的DBC提升至9.14 mg/g.
然而大部分商品化蛋白A树脂的DBC10%都高于35 mg/mL,远高于目前商品化膜层析介质(1.58~11.67 mg/mL),因此研究者通过向膜基底中引入多孔水凝胶,接枝高密度聚合物刷,制备高比表面积的静电纺丝纳米纤维膜等方式提高配体接枝密度和负载量,从而提高其DBC[19-21].如Grunberg等[21]利用可自交联的多糖溶液制备出了具有对流孔和扩散孔双连续相的蛋白A层析膜,该膜结构中大尺寸的对流孔可以促进目标蛋白快速传至具有比表面积大、结合容量高且扩散距离短(2~3 μm)的凝胶相扩散孔中,大幅提高层析膜的分离效率和结合容量.所制备的层析膜单抗DBC10%高达42.9 mg/mL,产率为203 g/(L·h).另外,一些混合模式层析膜也展现出很好的蛋白捕获能力,如NatriFlo HD混合模式层析膜同时具有磺酸离子交换配体和t-丁基疏水配体,其对单抗的DBC10%大于90 mg/mL[23].
2.2 膜层析用于单抗纯化与精制
阴离子交换层析膜、阳离子交换层析膜和疏水层析膜一般用于产品纯化与精制过程,进一步在流通模式下去除如HCPs、DNA、产品变体(酸性或碱性变体、聚集体等)、泄漏的蛋白A、渗滤液和内毒素等低浓度杂质.Fan等[24]用多巴胺对聚醚砜膜进行亲水改性,并以聚多巴胺层为中间功能层进一步偶联聚乙烯亚胺、十二硫醇和组氨酸分别构建阴离子交换、疏水和亲和层析膜用于人血清白蛋白(HSA)和IgG分离,三种层析膜可分别获得纯度为96.7%的HSA,纯度为94.6%的IgG和纯度接近100%的IgG,同时多巴胺改性可以有效提高层析膜的亲水性从而降低其非特异性吸附.Nadar等[25]构建了阴离子交换层析膜-阳离子交换层析膜级联工艺去除蛋白A洗脱液中的HCPs和酸性变体,并利用高通量筛选技术在小尺寸膜层析装置中对纯化精制过程中缓冲液pH、盐浓度、膜载量、流速和梯度长度等条件进行优化,最终将单抗中的HCPs含量降低至检测限以下,酸性变体含量由89.5%降至19.2%,同时单抗回收率为71%.Trnovec等[26]用商品化的阴离子交换膜NatriFlo®HD-Q、Sartobind®Q、和Mustang®Q在流通模式下去除单抗中的HCPs和DNA等杂质,实验得出合适的缓冲液条件下层析膜对HCPs去除率都高于80%,纯化后HCPs浓度低于50 mg/L,同时HPCs去除率随着所用缓冲液pH的增加而增加,但随着离子强度的增加而降低.需要注意的是纯化和精制过程中的料液一般电导率通常高于10 mS/cm,因此需要开发耐盐层析膜,降低离子强度对层析膜杂质去除性能的影响.Fan等[27]开发出了基于多巴胺改性的聚偏氟乙烯耐盐型阴离子交换层析膜,其在200 mmol/L NaCl时对IgG的回收率接近100%且纯度高于99%.目前也有包括SartobindSTIC、EmphazeST等多种商品化耐盐阴离子交换层析膜产品.Boi等[28]对比了具有相同离子交换配基的层析膜和填充床层析柱用于牛血清蛋白纯化的效果,实验得出层析膜平衡吸附容量为43.04 mg/mL,仅为填充床层析柱的60%,但最高产率是填充床层析柱的3.3倍,且高流速下利用率更高.
2.3 新型膜层析装置
除了膜层析介质外,膜层析装置的流道和分布器设计对分离选择性能也十分重要.多数膜设备都采用径向流动形式,使得所制备的膜层析装置存在流道复杂、空隙体积大的问题,易造成流体分布不均、配体利用率低,导致层析膜洗脱峰分布较宽、分离性能不高[图3(a)].为了解决上述问题,Ghosh等[29-30]提出一种横向供料膜层析装置[图3(b)],其在流量分布、配体利用率、峰值分辨率等方面均优于叠片装置,该装置已成功用于单抗聚集体和变体的高分辨率分析和分离.Chen等[31]提出一种新型环流式中空纤维膜层析装置[图3(c)和3(d)], 该结构中流体流动路径长度一致,溶质在装置停留时间分布窄、死体积小、流体回流少,可以实现快速高分辨的蛋白分离.

图3 装置中流体流动路径[12]Fig.3 Flow path diagram of deviec
3 病毒过滤
在CHO细胞培养过程中会有内源性表达逆转录病毒,同时在生产过程中也会发生外来病毒如小鼠细小病毒的污染[32].因此,病毒去除步骤在单抗下游纯化过程中十分重要.病毒过滤膜可通过尺寸筛分作用高效去除包膜病毒和无包膜病毒,保证生物制药药物的病毒安全性.该过滤过程需要保证水力学直径为9~12 nm的单抗分子透过率高于95%,同时对直径为18~26 nm细小病毒的截留率高于99.99%,因此常用的病毒过滤膜孔径在20 nm左右[33].目前商品化病毒过滤膜生产被国外公司垄断,生产企业主要包括Asahi Kasei Bioprocess、Millipore、Pall和Sartorius,膜材料包括高亲水性再生纤维素膜和亲水改性后的聚醚砜和聚偏氟乙烯膜.病毒过滤膜具有海绵状孔隙结构,同时孔径呈梯度变化[34].大多数商品化的病毒过滤膜都采用逆向死端过滤的操作方式(即多孔支撑层面向进料液而分离层背离进料液),相比于正向过滤,该操作方式可将分离膜的多孔支撑结构充当深层预过滤器,从而降低蛋白质聚集体对膜分离层的堵塞,大幅提升膜的抗污染能力[35].另一方面,逆向过滤方式可以强化多孔支撑层内部单抗的浓差极化作用,从而增加单抗的透过率[36].另外,与错流过滤相比,死端过滤还具有操作简单、运行成本低的优势[37].
病毒过滤膜面临的主要挑战是单抗聚集体在过滤过程中通常会发生堵孔并形成滤饼层,导致膜污染十分严重,从而降低膜过滤效率和总过滤体积,降低工艺的经济性[38].Namila等[39]用3种病毒过滤膜过滤每毫升含有107个小鼠细小病毒料液时发现当处理量达到250 L/m2时膜通量基本没有下降,而经过澄清纯化步骤后的料液中病毒滴度非常低,一般在104mL-1,所以在病毒过滤过程中由病毒本身导致的膜污染可以忽略不计.Barnard等[40]发现仅占溶液中蛋白质总质量1×10-4%的20~40 nm大小范围内的微量蛋白质聚集体足以在病毒过滤过程中引起显著的通量衰减.研究者们尝试通过改变膜表面化学性质、调控膜结构和优化过滤过程中的操作参数等方式来降低膜污染.增加膜的亲水性可以降低蛋白与膜的相互作用,从而降低膜污染.Kosiol等[32]通过对比10种不同的病毒过滤膜性能发现径向孔径梯度变化较为缓和的膜抗污染能力更强.这是因为孔径梯度变化较为缓和的膜可用作深层预过滤区域的面积更大,从而提高预过滤能力,有效缓解对分离层的污染.Peles等[41]研究了在病毒过滤过程中操作压力在10~60 psi范围下单抗对膜污染的影响,实验发现当膜通过量较低时(< 8 L/m2),此时孔堵污染占主导作用,而跨膜传质阻力随着操作压力的升高而降低,作者提出高操作压力下传质推动力高,可促使蛋白低聚体透过膜孔,从而降低膜的孔堵污染.随着透过液持续增加,滤饼污染占主导地位,高压操作会使滤饼层压实,加剧膜污染程度,此时跨膜传质阻力随着操作压力的升高而升高.
4 预制剂
预制剂是单抗下游工艺的最后一步,在这个步骤中纯化后的抗体一般需要被浓缩至150 g/L以上,并将其置换到合适的缓冲液中以保证抗体药物产品的稳定性[6].超滤膜浓缩和渗滤工艺被广泛用于蛋白浓缩和缓冲液置换,已基本取代了利用尺寸排阻层析进行溶剂交换的方法.在浓缩和渗滤工艺中所选用的超滤膜孔径要小于抗体尺寸,截留分子量一般在30 000左右,通常采用错流过滤的操作方式.图4所示为超滤/渗滤工艺系统,首先除病毒后的原料经过供料泵送入料液罐中进行预浓缩至蛋白浓度约为25 g/L,之后用数倍预浓缩液体积的渗滤缓冲液进行置换,最后将蛋白再次浓缩至目标浓度.
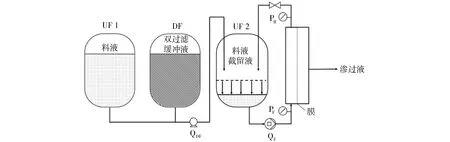
图4 用于蛋白浓缩和缓冲液置换的超滤/渗滤系统示意图Fig.4 Schematic representation of ultrafiltration/diafiltration system for protein concentration and buffer exchange
由于浓缩过程抗体浓度大幅增加,蛋白质间的相互作用增大,引起蛋白团聚,使得料液黏度和渗透压升高,这一方面会导致超滤浓缩过程中通量大幅下降,另一方面由于道南效应和尺寸筛分效应共同作用下会导致pH和辅料浓度偏移等问题,从而降低制剂的稳定性和药效[42].同时,分离膜在较高浓度下运行存在膜污染严重、通量下降、膜清洗通量恢复率低等问题.一些研究发现,向高浓度蛋白溶液中加入辅料如精氨酸、组氨酸或咪唑可以降低料液黏度、减少蛋白团聚,同时降低其与膜表面的非特异性相互作用,提高过滤通量,并进一步提高蛋白浓缩倍数[43].提高过滤温度也可以提高过滤通量,但会影响产品的稳定性.
近年来,Pall、Millipore、Repligen等公司也推出了多种一次性超滤错流过滤装置,这些装置已提前经过消毒杀菌处理,可以直接接入浓缩和渗滤工艺中,而无需制定和验证清洗和杀菌工艺.为了降低生产成本,减少处理过程中停留时间、储罐体积和数量,提高工艺稳定性,澄清纯化连续化生产工艺备受青睐.目前,多种单程错流过滤超滤膜组件已被商业化生产并用于单抗连续浓缩工艺中.单程错流过滤系统通常由多个膜包串联组成长的过滤流道,以实现单次过滤就达到所需浓缩倍数.同时,通过设计优化流道宽度、长度和膜包排列方式可以降低压降,提高过滤通量[44].Christopher等[45]也提出用低成本聚砜中空纤维膜制备一次性单程错流过滤装置,该装置在单次过滤后可将IgG浓缩10倍以上,浓度高于200 g/L,连续使用120 h后压降小于1 kPa.该装置在处理1.4 kg IgG的成本低于每克0.004美元,证明了其具有经济可行性.
5 结语与展望
随着生物药在疾病检测、治疗和预防领域的快速发展,以及连续化生产工艺的逐渐普及,基于膜分离技术的分离纯化单元起着越来越重要的作用.然而,膜分离技术在不同操作单元仍然面临各种问题亟需解决,如微滤澄清、病毒去除和蛋白浓缩过程中膜污染严重、层析膜结合容量低、缓冲液置换过程中pH和辅料浓度偏移等.新膜材料如兼具有机和无机材料性能的杂化膜、生物相容性好的生物基膜材料的开发,孔径分布及梯度孔结构可控调控,长久稳定的膜改性涂层研制,膜组件流体分布及传质优化,以及利用机器学习精准预测分离膜性能有望解决上述问题,进一步促进生物药下游纯化效率,增强工艺的稳定性和可控性,提高生物产品纯度和质量,同时降低纯化成本.另外,大多数用于抗体纯化工艺中的商品化分离膜及膜组件仍被国外垄断,“卡脖子”形势严峻,国产替代刻不容缓.

