LncRNA MRPL39通过海绵吸附miR-130靶向PTEN调控人肺癌细胞的迁移和侵袭
范庆浩,鲍献荣,赵 涵
(金华市人民医院 心胸外科,浙江 金华 321000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要类型,目前尚缺乏持续有效的治疗方案,从分子生物学层面挖掘新型治疗靶标,将有重要的临床意义[1]。长链非编码RNA(LncRNA)对肿瘤的发生发展有重要的调控作用[2-3]。研究[4]表明,LncRNA MRPL39可靶向miR-130抑制胃癌细胞的增殖。前期通过检索GEO数据库中NSCLC肺癌组织与正常肺组织的miRNA测序芯片数据(ID:200135918),发现miR-130在NSCLC中表达下降。Ye等[5]研究也显示,低表达miR-130与NSCLC患者不良预后密切相关。但miR-130在NSCLC中的上游调控机制尚未阐明。故本研究检测MRPL39和miR-130在NSCLC组织标本中的表达水平,并在细胞水平和动物水平验证MRPL39对miR-130及NSCLC的影响,拟探究MRPL39在NSCLC中是否可能靶向miR-130促进疾病的发生发展。
1 资料与方法
1.1 临床资料 纳入2021年6月—2021年12月于我院心胸外科首次确诊、需手术切除的NSCLC患者30例,术中留取癌组织和癌旁组织;患者术前未接受过其他抗肿瘤治疗。其中男13例,女17例;年龄41~72岁,平均(56.37±12.41)岁;病理类型:鳞癌18例,腺癌10例,其他2例;NSCLC分级:Ⅰ级3例,Ⅱ级8例,Ⅲ级13例,Ⅳ级6例。受试患者均知情同意,本研究经医院伦理委员会审批。
1.2 细胞与动物来源 人肺腺癌细胞系A549购自美国ATCC细胞中心;20只BALB/c裸鼠购自南京大学模式动物研究所,4~5周龄,体质量18~22 g,动物许可证号:SCXK(苏)2021-0010,于特定无病原体条件下饲养。
1.3 细胞培养与转染 以DMEM培养基(含10%胎牛血清)、37 ℃、5%CO2条件培养细胞,隔天更换培养基,待细胞生长至80%时进行传代培养,取对数生长期细胞分为空白组、sh-NC组、sh-MRPL39组、sh-MRPL39+anti-miR-NC组和sh-MRPL39+anti-miR-130组,根据脂质体2000(美国Invitrogen公司)说明书进行转染,空白组不做转染处理,sh-NC组、sh-MRPL39组、sh-MRPL39+anti-miR-NC组和sh-MRPL39+anti-miR-130组分别将杂序shRNA、sh-MRPL39、sh-MRPL39+无意义小分子阴性对照片段和sh-MRPL39+miR-130抑制剂(由上海吉凯公司合成)转入细胞,转染48 h后收集细胞用于后续实验。
1.4 qPCR法检测组织及细胞中MRPL39和miR-130表达 采用Trizol法提取组织及细胞中总RNA,测定A260/A280值,取合格样本进行cDNA合成和PCR扩增,逆转录试剂盒和SYBR Green qPCR Master Mix购自日本TaKaRa公司,PCR扩增条件:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 45 s,72 ℃ 60 s,共38个循环。以U6为内参,2-ΔΔCt法半定量计算MRPL39和miR-130表达。
1.5 CCK-8法检测细胞增殖 收集转染细胞调整密度为1×104个/mL接种96孔板,正常培养24 h后加入CCK-8试剂(上海碧云天公司)20 μL /孔,避光培养4 h,于450 nm处检测各孔吸光度值(A),计算细胞存活率(A样本孔/A空白孔×100%)。
1.6 Transwell小室实验检测细胞迁移和侵袭 收集转染细胞调整密度为2×105个/mL接种小室上室,其中侵袭实验中小室上室用基质胶包被,迁移实验不作此操作;下室添加含有20%胎牛血清培养基建立迁移/侵袭模型,培养48 h,拭去上室内残留细胞和或基质胶,固定后用0.1%结晶紫染色,光镜下计数迁移细胞数和侵袭细胞数(5个随机视野)。
1.7 双荧光素酶报告基因验证MRPL39与miR-130靶向关系 通过在线生物学软件starBase预测MRPL39与miR-130的潜在结合位点信息,委托上海吉凯公司合成野生型MRPL39载体(WT-MRPL39)和突变型MRPL39载体(MUT-MRPL39),分别将上述载体、mimic-NC、miR-130 mimic转染细胞,最后收集细胞检测荧光素酶活性。
1.8 蛋白印迹法检测细胞和组织中上皮间质转化(EMT)标志物和第10号染色体丢失的磷酸酶基因(PTEN)表达 添加细胞裂解液提取组织和细胞中总蛋白,水浴变性后,各组取50 μg蛋白进行电泳,设置90 V、50 min跑浓缩胶,110 V、30 min跑分离胶,转膜后加入5%脱脂牛奶室温下封闭2 h,再分别加入E钙黏素(E-cadherin)、N钙黏素(N-cadherin)、波形蛋白(Vimentin)、PTEN和β-actin抗体(美国Cell Signaling Technology公司),稀释比为1∶1 000,4 ℃孵育过夜,再加入1∶5 000稀释的辣根过氧化物酶标记蛋白二抗(上海碧云天公司)37 ℃下孵育1 h,最后添加化学发光剂发光显影。利用Image J软件测定条带灰度值,以β-actin标准化计算目的蛋白的相对蛋白表达量。
1.9 构建裸鼠成瘤模型 将20只BALB/c裸鼠随机分为sh-NC组和sh-MRPL39组,分别取稳定转染细胞于裸鼠后腿皮下种植,每天观察裸鼠及肿瘤生长情况,待肉眼可见瘤体后,30 d时终止观察,断头处死裸鼠,分离瘤体,测量其长、短径及体质量,计算体积(短径2×长径/2)。

2 结果
2.1 MRPL39和miR-130在组织样本及细胞中的表达 与癌旁组织比较,肺癌组织中MRPL39水平升高,miR-130水平降低;差异均有统计学意义(P<0.05),见表1。sh-MRPL39组细胞中MRPL39水平(0.34±0.09)低于空白组(1.00±0.14)和sh-NC组(1.06±0.18),差异有统计学意义(F=39.834,P<0.001);空白组和sh-NC组间差异无统计学意义(P>0.05)。
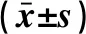
表1 MRPL39和miR-130在肺癌组织及癌旁组织中的表达水平
2.2 低表达MRPL39对细胞增殖、迁移及侵袭的影响 与sh-NC组比较,sh-MRPL39组细胞的存活率降低,迁移细胞数和侵袭细胞数减少,差异均有统计学意义(P<0.05);但空白组和sh-NC组间差异无统计学意义(P>0.05)。见表2。

表2 低表达MRPL39对细胞增殖、迁移及侵袭的影响
2.3 低表达MRPL39对细胞中EMT标志物表达的影响 与sh-NC组和空白组比较,sh-MRPL39组细胞中E-cadherin表达升高,N-cadherin和Vimentin表达降低,差异均有统计学意义(F=29.084、7.270、22.520,均P<0.01);但空白组和sh-NC组间比较,差异无统计学意义(P>0.05)。见图1。

图1 细胞中EMT标志物的表达
2.4 低表达MRPL39对裸鼠移植瘤的影响 与sh-NC组比较,sh-MRPL39组移植瘤中MRPL39的表达、体积和体质量均明显降低,差异有统计学意义(P<0.05)。见表3。
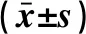
表3 低表达MRPL39对裸鼠移植瘤MRPL39表达、体积和重量的影响
2.5 MRPL39与miR-130的靶向关系 如图2显示,MRPL39与miR-130存在互补序列;与其他3组比较,miR-130 mimic+WT-MRPL39组细胞荧光素酶相对活性(0.52±0.11)降低,差异有统计学意义(F=12.757,P<0.001)。sh-MRPL39组、sh-MRPL39+anti-miR-NC组细胞中miR-130的表达水平(1.63±0.18、1.58±0.15)均高于sh-NC组(1.00±0.14)和sh-MRPL39+anti-miR-130组(1.24±0.21),差异均有统计学意义(F=14.911,P<0.001)。

图2 MRPL39与miR-130的靶向结合位点
2.6 MRPL39靶向miR-130对细胞增殖、迁移和侵袭的影响 如表4所示,sh-MRPL39组和sh-MRPL39+anti-miR-NC组的细胞存活率、迁移细胞数、侵袭细胞数,差异均无统计学意义(P>0.05);而sh-MRPL39+anti-miR-130组均高于sh-MRPL39+anti-miR-NC组,差异有统计学意义(P<0.05)。

表4 MRPL39靶向miR-130对细胞增殖、迁移和侵袭的影响
2.7 MRPL39靶向miR-130对细胞中EMT标志物和PTEN表达的影响 如表5所示:与sh-MRPL39+anti-miR-NC组比较, sh-MRPL39组的E-cadherin、N-cadherin、Vimentin、PTEN的表达水平差异均无统计学意义(P>0.05);sh-MRPL39+anti-miR-130组E-cadherin表达降低,N-cadherin、Vimentin和PTEN表达升高,差异均有统计学意义(P<0.05)。

表5 MRPL39靶向miR-130对细胞中EMT标志物和PTEN表达的影响
3 讨论
手术切除是NSCLC的主要治疗手段,对于无法行手术治疗者,放化疗等治疗虽可局部缓解病情,但整体效果不佳[6]。LncRNAs可参与多种生物学功能,如染色体重构、干细胞重编程、免疫调节等,在多种癌症中存在失调表达[7-8]。MRPL39定位于人21号染色体,大小为1 725 bp,最早被Li等[9]发现存在于胃癌组织中,其表达较癌旁正常胃组织低。进一步机制研究发现,MRPL39在胃癌细胞中可直接作用于miR-130,可能是一种新型胃癌生物学标志物[5]。但MRPL39的生物学效应尚未完全显现,其是否参与了NSCLC的生物学过程仍不清楚。
本研究结果显示,相较于癌旁组织,NSCLC患者肺癌组织样本中MRPL39表达明显上调,提示MRPL39在NSCLC中可能发挥促癌作用。进一步研究以明确MRPL39对肺癌细胞功能的影响,发现敲低MRPL39可抑制A549细胞的增殖、迁移和侵袭能力。EMT是促进肿瘤细胞癌变的重要病理机制,在此过程中,上皮细胞转化为具有间质表型的细胞,导致恶性肿瘤细胞出现恶性生物学行为[10]。E-cadherin、N-cadherin和Vimentin均是EMT中的标志蛋白,其中E-cadherin可参与细胞间黏附,维持细胞间连接,阻止细胞活动侵袭与转移扩散;N-cadherin和Vimentin是间质细胞标志物,其表达增加表明细胞呈现EMT,迁移与侵袭能力增强[11]。本研究中,敲低MRPL39表达后,细胞中E-cadherin表达增加,N-cadherin和Vimentin表达降低,进一步表明敲低MRPL39可抑制细胞EMT,实现对NSCLC的抑制作用。同时,裸鼠成瘤模型结果也表明,敲低MRPL39可抑制瘤体生长。
本研究利用双荧光素酶报告基因实验验证,MRPL39与miR-130存在靶向关系,敲低MRPL39表达可促进细胞中miR-130表达。miR-130在肝癌[12]、乳腺癌[13]等多种癌症中存在异常表达,并与肿瘤细胞的增殖和凋亡有关。本研究发现,miR-130在NSCLC组织中表达异常降低,干扰miR-130表达可部分逆转沉默MRPL39对细胞增殖、迁移和侵袭的影响,及上皮间质转化转移和PTEN表达的抑制作用。研究[9]表明,miR-130与PTEN在NSCLC中存在靶向调控作用,miR-130可解除PTEN对肺癌细胞生长的刺激作用。提示MRPL39可能通过海绵吸附miR-130靶向调控PTEN,影响A549细胞增殖、迁移与侵袭过程。
综上所述,LncRNA MRPL39在NSCLC组织中高表达,LncRNA MRPL39/miR-130/PTEN轴可能参与调控A549细胞的增殖、迁移和侵袭。本研究有望为LncRNA的靶向治疗提供新靶点,抑制MRPL39表达可能对NSCLC有治疗效果,但未来还需要更多的研究数据作支撑。

