高蛋白饮食体重管理模式对超重/肥胖病人代谢指标的影响
卫 星,孙 萍
《中国居民营养与慢性病状况报告(2020年)》显示,2018年我国18岁及以上居民平均超重率为34.3%,肥胖率为16.4%,且超重和肥胖也成为我国2019年第6大致死、致残的危险因素[1]。肥胖是引起高血压、糖尿病、心脑血管病、肿瘤等慢性非传染性疾病的危险因素和病理基础[2],肥胖已成为影响居民心理健康及社会交往的重要因素,并增加了社会经济负担。多项研究表明,高蛋白膳食对改善超重/肥胖病人的血糖、血脂等代谢指标及体重、人体成分指标作用显著[3-4]。本研究观察高蛋白饮食干预对超重/肥胖病人的体重及代谢指标的影响,为超重/肥胖病人的饮食干预方案提供临床依据。
1 资料与方法
1.1 研究对象
选取2021年1月—2022年8月在山西医科大学第一医院营养减重门诊就诊的超重/肥胖病人,进行为期2个月的体重管理。纳入标准:体质指数(body mass index,BMI)≥24 kg/m2;年龄16~65岁;资料完整且依从性较好;了解干预过程中可能出现的不良反应。排除标准:围孕期妇女;患有恶性肿瘤或严重的肝、肾、心脑血管疾病;过去半年内接受过其他形式的减重治疗;继发性肥胖,如多囊卵巢综合征、甲状腺功能减退;服用致超重或肥胖的药物,如抗抑郁药、糖皮质激素等。
1.2 资料收集
1.2.1 一般资料
收集病人年龄、性别、合并症[如糖尿病及糖尿病前期、高血压、脂肪肝、抑郁症、阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)]等。干预前采用24 h膳食回顾调查表进行问卷调查,收集病人24 h饮食摄入情况,评估饮食习惯。
1.2.2 观察指标
收集基线、干预1个月后、干预2个月后空腹血糖(fasting blood glucose,FBG)、餐后2 h血糖(2 hours postload blood glucose,2 hPBG)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、血肌酐(serum creatinine,Scr)、尿素氮(urea nitrogen,Urea)、尿酸(uric acid,UA)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)等生化指标。使用北京东华原人体成分分析仪DBA-550,采用生物电阻抗分析法测定人体成分,收集体重、BMI、体脂肪量(body fat mass,BFM)、体脂肪率(body fat ratio,BFR)、腰臀比(waist-to-hip ratio,WHR)、内脏脂肪面积(visceral fat area,VFA)、身体总评分等指标。
1.3 干预措施
1.3.1 饮食干预
计算每日摄入总能量:[标准体重(kg)×(25~30)]-500 kCal;制定每日三大产能营养素的比例:其中蛋白质供能占总能量的30%,脂肪占30%,糖类占40%;计算每日三大产能营养素的总量及三餐分配:根据三大营养素的能量换算关系,计算出每日糖类、脂肪、蛋白质的总需要量(g),并根据三餐分配比例分别计算三大营养素的需要量(g);根据食物交换成分表制定个性化、限能量的高蛋白食谱。
1.3.2 运动干预
建议每周至少150 min中等强度运动,每日运动30 min以上,每周至少5 d。要求病人每日有氧运动40 min,无氧运动(是指在健身教练指导下进行减脂增肌等抗阻训练)1 h。
1.3.3 监督及随访
每日记录体重、饮食和运动情况,干预过程中出现任何不良反应及不耐受情况及时通过微信或电话向营养师反馈,营养师进行记录并根据实际情况对饮食等进行适时调整和指导。采用门诊、电话或互联网平台随访。
1.4 诊断标准
参考2013年《中华人民共和国卫生行业标准:成人体重判定(WS/T 428—2013)》及2011年《中国成人肥胖症防治专家共识》提出的BMI界值,以BMI为依据对超重或肥胖进行判定,超重为BMI 24.0~28.0 kg/m2,肥胖为BMI>28.0 kg/m2。
1.5 伦理资料
本研究遵守《随机对照临床试验研究报告指南》(CONSORT 指南)。每例病人入组前,均由干预实施者将向病人详细解释研究过程,说明利弊及补救措施,病人签署知情同意书后纳入研究。
1.6 统计学处理

2 结 果
2.1 超重/肥胖病人临床资料(见表1)
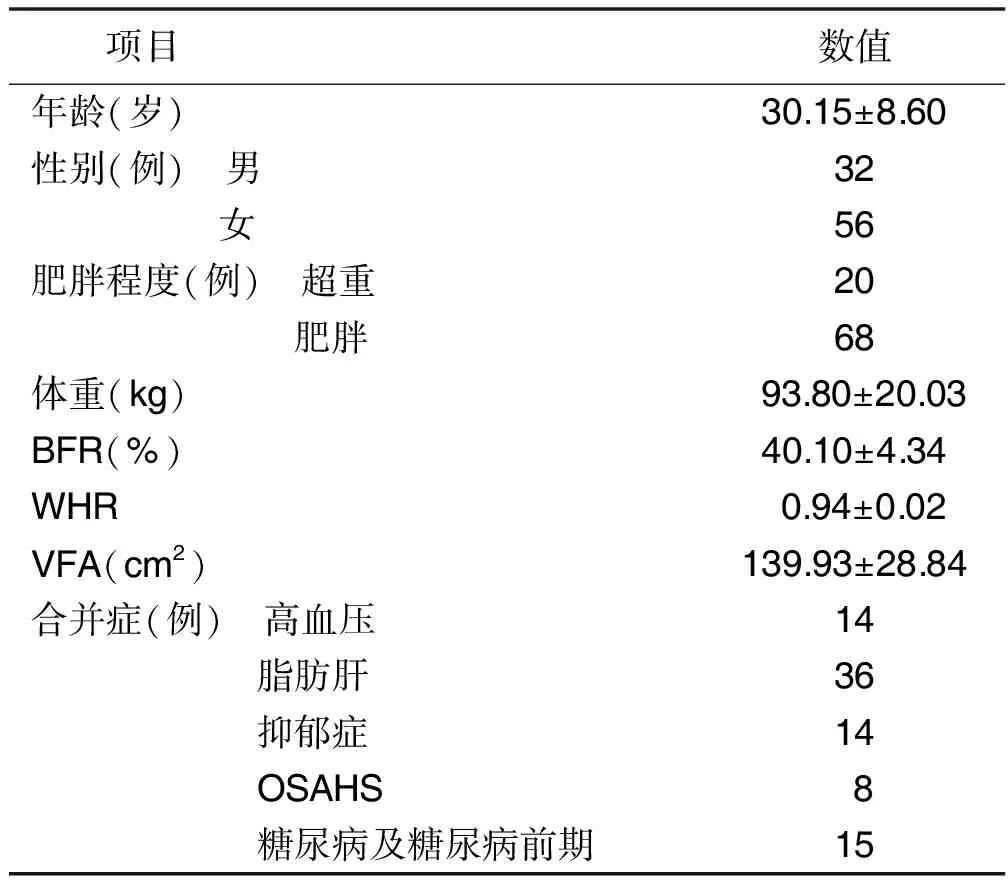
表1 超重/肥胖病人临床资料(n=88)
2.2 干预前后血糖、血脂指标比较
不同时间FBG、2 hPBG、TG、TC、HDL-C、LDL-C比较,差异均有统计学意义(P<0.01)。与干预前比较,干预1个月后、2个月后,FBG、2 hPBG、TG、TC、LDL-C降低,HDL-C升高(P<0.05)。详见表2。

表2 干预前后血糖、血脂指标比较(±s) 单位:mmol/L
2.3 干预前后肝肾功能比较
不同时间UA、Urea、Scr、ALT及AST比较,差异均有统计学意义(P<0.05)。与干预前比较,干预1个月、2个月后,AST、UA降低,Urea、Scr、ALT升高(P<0.05)。详见表3。

表3 干预前后肝肾功能比较(±s)
2.4 干预前后体重及人体成分指标比较
不同时间体重及人体成分指标比较,差异均有统计学意义(P<0.001)。与干预前比较,干预1个月后、2个月后,体重及人体成分指标均下降,身体总评分升高(P<0.05)。其中VFA下降幅度最大,其次为体重、BFM以及BMI。详见表4。

表4 干预前后体重及人体成分指标比较(±s,n=88)
2.5 干预期间不良反应发生情况
干预过程中,随访并记录病人不良反应发生情况,及时指导甚至调整食谱,必要时停止干预。干预过程中出现部分不良反应及不适,包括饥饿感、便秘、头晕、腹泻、乏力、注意力减退,调整食谱后明显改善。详见图1。
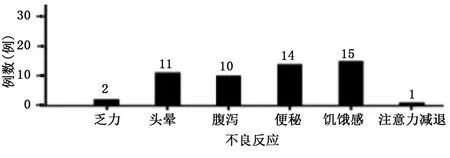
图1 干预期内不良反应发生情况(n=88)
3 讨 论
近年来,我国超重及肥胖问题日益严峻,相关研究显示,青春期肥胖会影响生长及发育[5],引起内分泌及性激素代谢紊乱,同时增加胰岛素抵抗及患2型糖尿病、代谢综合征的风险。相关研究显示,超重或肥胖青春期病人多囊卵巢综合征患病率高于成年病人[6],多囊卵巢综合征患病率可能与青春期女孩肥胖有关[7]。有研究表明,青春期肥胖可增加成年后患心血管疾病、高血压及OSAHS等风险[8]。一项针对丹麦儿童的大型随访研究显示,儿童期BMI升高与成年期发生致死性或非致死性冠心病事件的风险增加有关[9]。肥胖的儿童及青少年可能出现心理问题[10],若得不到及时干预,可能导致严重的身心疾病。严重肥胖是围产期孕产妇死亡的危险因素,一项对纽约市妊娠期女性的分析显示,与正常体重的女性相比,BMI>35 kg/m2的女性围产期死亡率更高[11]。一项回顾性研究显示,妊娠期过度的体重增加与妊娠糖尿病风险增加有关[12]。因此,制定适合肥胖儿童及青少年、围生期及产后妇女的干预及诊疗方案至关重要,今后仍需大量研究进一步探讨特殊人群的减重方案并应用于临床。
本研究结果显示,肥胖人群中糖脂代谢紊乱常见,对肥胖症病人进行减重指导同时重点关注糖脂代谢指标变化,及时干预可改善肥胖及其合并症的预后。肥胖是一种慢性疾病,需要终身管理,因此医师应对肥胖病人进行中心化管理和个体化治疗,以达到改善代谢紊乱和预防肥胖并发症的目的[13]。
本研究中,与基线比较,经过2个月的高蛋白饮食干预,病人体重、BMI、BFM及VFA均下降,表明高蛋白饮食联合运动、心理干预的体重管理模式可保持超重/肥胖病人稳定减重,且减重效果及代谢改善情况均理想。本研究中体重及体成分下降的程度高于相关研究结果[14],考虑为纳入中度肥胖病人占比较高所致。
有研究表明,高蛋白饮食体重管理模式,显著改善了FBG[15]。本研究结果显示,与基线比较,经过2个月的高蛋白饮食干预,FBG、2 hPBG均下降,但整体改善幅度不大,考虑原因可能是基线时糖代谢正常者占比较高,与相关研究结果[16]一致。同时本研究结果显示,与基线比较,高蛋白饮食体重管理模式实施后病人血脂水平显著改善。血脂代谢紊乱是冠心病等慢性疾病的危险因素,高蛋白饮食对脂质代谢的积极作用有利于预防慢性基础病或代谢性疾病的发生,改善疾病的预后,因此高蛋白饮食体重管理模式为长期膳食模式提供了参考。与相关研究结果[17]一致,通过高蛋白饮食体重管理模式减重对肝功能是有益的。本研究中病人肝功能下降程度不明显。相关研究显示,肾功能不全时高蛋白饮食可能加速肾功能不全的进展,从而导致肾功能急剧恶化[18-19]。本研究中,短期高蛋白饮食及运动干预对肾功能的不良影响较小,长期高蛋白饮食干预及运动对肾功能的影响仍存在争议,今后仍需更多研究观察长期使用高蛋白饮食及运动对肾功能的影响。有研究显示,高蛋白饮食的不良反应包括腹胀、腹泻及腹部不适等[20]。本研究的干预过程中,出现乏力、头晕、便秘、饥饿感等不良反应,其中便秘病人添加益生菌后有所改善,头晕及乏力病人检查心电图后未见明显异常,出现饥饿感时及时补充适量糖果病人症状亦明显改善。相关研究表明,高蛋白饮食主要利用蛋白质的饱腹作用,减少能量摄入及体脂量,改善代谢状况[21]。本研究中出现饥饿感不良反应,考虑可能由糖类摄入过少、机体短时间内无法耐受所致。
本研究存在的局限性:样本量有限,结果代表性可能较差,结论不充分;采用前后自身对照试验,不符合随机、平行对照的要求,可靠性不足;干预过程中混杂因素较多;干预时间较短,未进一步随访干预结束后病人体重的维持情况。
综上所述,短期高蛋白饮食的体重管理模式可使超重/肥胖病人的体重及体成分改善,减重效果显著,同时改善糖脂及尿酸代谢情况,肝肾功能未显示异常。使用高蛋白饮食体重管理模式干预减重过程中可出现部分不良反应,及时调整饮食方案后逐渐恢复正常。

