基于网络药理学与分子对接技术探讨三参通脉合剂治疗冠心病的作用机制
张荩元,刘 巍,刘红旭,田 伟,连妍洁,佟 彤
冠状动脉性心脏病简称冠心病,指冠状动脉发生粥样硬化,引起管腔狭窄或闭塞,心肌缺血缺氧甚至坏死导致的心脏病,也称为缺血性心脏病[1]。《中国心血管健康与疾病报告2021》指出,我国心血管病患病率持续上升,推算我国心血管病现患人数3.3亿例,其中冠心病1 139万例[2]。冠心病是全球范围内导致死亡和过早死亡的主要原因[3],可见冠心病严重危害人类健康,是重大的公共卫生问题。中医治疗冠心病在提高临床疗效、改善疾病预后等方面有一定优势,为治疗冠心病增添了新活力。
首都医科大学附属北京中医医院名老中医许心如结合30年临床经验,针对气阴两虚、瘀血内阻型冠心病组方二参通脉汤,后发展为三参通脉合剂口服液、三参通脉合剂,药物组成包括太子参、玄参、丹参、延胡索、赤芍、白芍、细辛、柴胡、枳实、娑罗子等。有研究显示,三参通脉合剂口服液治疗轻中度冠心病临床疗效优于消心痛[4],可降低冠心病病人内皮素(ET)水平,促进降钙素基因相关肽(CGRP)释放,改善冠状动脉血流[5],降低冠心病病人偏高的T细胞亚群比值(CD4+/CD8+),抑制免疫功能亢进,改善心肌缺血[6]。三参通脉合剂可降低血浆纤维蛋白原(FIB)水平,提高纤溶酶(PL)水平,改善血液高凝状态[7],其与常规西药联用可进一步提高冠状动脉成形术或(及)支架置入术后心绞痛再发作病人的临床疗效[8]。有实验显示,三参通脉合剂口服液可增加冠状动脉流量,降低冠状动脉阻力、外周阻力及心肌耗氧量,缩小心肌缺血家犬心肌梗死范围,改善ST段异常[9]。目前针对三参通脉合剂治疗冠心病的药理学机制研究较少。中药复方是中医药物治疗疾病的主要载体,数千年的临床实践明确了中药复方的有效性,因其具有多成分、多靶点、多途径、系统调控等作用特点,较难进行系统的机制研究。网络药理学基于系统和整体水平,构建“疾病-表型-基因-药物”多层次网络以探讨药物与机体的相互作用,是适用于中药复方机制探讨的研究方法[10]。逆向分子对接可将小分子化合物与三维结构的相关靶点进行空间和能量匹配,从而评价预测药物小分子与潜在作用靶点的结合活性,补充了网络药理学的预测结果,从分子水平阐释了中药治疗疾病的作用机制[11]。本研究基于分子水平,通过网络药理学及分子对接技术,从化学成分、作用靶点、分子功能和信号通路等多方面系统探讨三参通脉合剂治疗冠心病的作用机制。研究流程图见图1。

图1 三参通脉合剂治疗冠心病作用机制的研究流程图
1 资料与方法
1.1 三参通脉合剂潜在活性化合物及作用靶点筛选
应用高通量中医药实验和参考指导数据库HERB[12](http://herb.ac.cn)检索三参通脉合剂核心药物太子参、玄参、丹参、延胡索、赤芍、白芍、细辛、柴胡、枳实、娑罗子所含化学成分,根据化学成分的药物动力学(absorption and distribution and metabolism and excretion,ADME)参数进行筛选。具体筛选过程及条件:首先根据HERB数据库中口服生物利用度(oral bioavailability,OB)初步筛选得到OB≥30%的成分;其次利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)初筛得到化学成分的Canonical SMILES结构,将其导入SwissADME平台[13](http://www.swissadme.ch/)进一步筛选。设置筛选标准[14]:药代动力学(pharmacokinetics)为胃肠道吸收[15](gatrointestinal absorption),为“high”;类药性(druglikeness)为5个相关参数(lipinski、ghose、veber、egan、muegge),≥2个参数为“high”,筛选后得到三参通脉合剂潜在活性化合物。
将筛选最终所得化合物的Canonical SMILES结构导入SwissTargetPrediction平台[16](http://www.swisstargetprediction.ch/),物种选择“Homo sapiens”,筛选可能性(probability)>10%的蛋白作用靶点,将Gene Symbol导入Excel中。
1.2 冠心病潜在作用靶点预测及筛选
以“coronary atherosclerotic heart disease”“coronary heart disease”“CHD”“ischemic heart disease”为检索词,检索GeneCards数据库[17](https://www.genecards.org/)、OMIM(Online Mendelian Inheritance in Man)数据库[18](http://www.omim.org/)、DisGeNET数据库[19](http://www.disgenet.org/)、DrugBank数据库[20](http://www.drugbank.ca/)、TTD(Therapeutic Target Database)数据库[21](http://bidd.nus.edu.sg/group/cjttd/)获得冠心病的作用靶点。根据靶点与疾病相关性评分的中位数筛选各数据库检索结果,将5个数据库筛选结果合并,删除重复靶点,获得冠心病的潜在致病靶点。采用UniProt数据库[22](https://www.uniprot.org/)将所得疾病靶点规范为Gene Symbol。
1.3 三参通脉合剂治疗冠心病的潜在靶点预测
将筛选得到的三参通脉合剂作用靶点与冠心病靶点导入Venny 2.1在线软件(https://bioinfogp.cnb.csic.es/tools/venny/),取交集得到药物与疾病的共同靶点,绘制韦恩图。
1.4 构建“中药-成分-靶点”网络图
利用软件Cytoscape 3.9.1[23],根据韦恩图中的共同靶点构建三参通脉合剂治疗冠心病的“中药-成分-靶点”网络图。图中节点(node)表示三参通脉合剂中各味中药、潜在活性化合物及作用靶点,边(edge)表示中药与成分、成分与靶点之间的关系。
1.5 构建靶点蛋白-蛋白互作(protein-protein interaction,PPI)网络
为阐明靶点蛋白之间的相互作用,将得到的共同靶点导入STRING 11.5数据库[24](https://cn.string-db.org/),物种选择“homo sapiens”,设置靶点关联置信度为中等置信度0.4,其余参数设置为默认值,构建靶点的PPI网络。
将PPI网络导入软件Cytoscape 3.9.1进行可视化处理,利用CytoNCA插件进行拓扑分析,以参数度值(Degree)、介度中心性(betweenness centrality,BC)、紧密中心性(closeness centrality,CC)、局部边连通性(local average connectivity-based method,LAC)进行筛选,筛选条件为每个参数均大于中位数值,筛选核心靶点。
1.6 基因本体(GO)功能富集和京都基因与基因组百科全书(KEGG)通路富集分析
为寻找三参通脉合剂活性化合物治疗冠心病的预测靶点显著富集的主要功能注释及信号通路,将获得的药物-疾病共同靶点导入Metascape数据库[25](http://metascape.org),进行GO功能富集分析,包括分子功能(molecular functions,MF)、生物过程(biological process,BP)和细胞组分(cellular components,CC)3个方面及KEGG通路富集分析。设置物种为“H.sapiens”,Min Overlap为3,Pvalue cutoff为0.01,保存结果并绘图。
1.7 分子对接评估
根据“中药-成分-靶点”、PPI网络及相关文献筛选主要活性成分与关键靶点进行分子对接评估。通过RCSB PDB数据库[26](https://www.rcsb.org/)获得靶点蛋白三维晶体结构的pdb格式;通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得药物小分子结构的sdf格式,并通过OpenBabel3.1.1[27](http://openbabel.org/wiki/Main_Page)转化为pdb格式保存。使用AutoDock Tools 1.5.7[28](https://ccsb.scripps.edu/mgltools/)对靶点蛋白和药物小分子进行pdb格式处理后保存为pdbqt格式:对靶点蛋白去水、加氢,并设置为受体;对药物小分子加氢,设置为配体,检测并选择扭转键。设置对接口袋后采用AutoDock Vina1.1.2[29](https://vina.scripps.edu/)进行分子对接,以对接评分结合能(affinity)评价配体与靶点的结合活性:对接结合能<-17.79 kJ/mol认为配体与靶点之间具有结合活性,结合能<-20.93 kJ/mol表明结合活性较佳,结合能<-29.30 kJ/mol说明两者之间有强烈的对接活性[14,30]。通过PyMOL 2.3.0[31]绘制部分分子对接模型。
2 结 果
2.1 三参通脉合剂的潜在活性化合物及靶点筛选
初步筛选后共获得437个三参通脉合剂主要活性成分,其中太子参14个,玄参16个,丹参68个,延胡索44个,赤芍29个,白芍38个,细辛75个,柴胡121个,枳实23个,娑罗子9个,合并后去除重复成分72个,最终筛选得到中药复方三参通脉合剂潜在活性化合物365个,基本信息见表1。初步共获得所有成分的预测靶点4 029个,其中太子参312个,玄参124个,丹参603个,延胡索564个,赤芍377个,白芍460个,细辛399个,柴胡542个,枳实503个,娑罗子145个,合并后去除重复靶点3 003个,最终获得三参通脉合剂主要活性成分预测靶点1 026个。

表1 三参通脉合剂的潜在活性化合物
2.2 冠心病相关靶点获取
检索GeneCards数据库得到9 393个疾病相关靶点,相关性得分(relevance score)最高值为131.24分,最低值为0.10分,以相关性得分≥17.93分为条件筛选得到1 175个靶点。检索DisGeNET数据库得到1577个疾病相关靶点,得分最高值为0.7,最低值为0.01,以得分≥0.02为条件筛选得到794个靶点。其余数据库检索结果分别为OMIM数据库420个、DrugBank数据库35个、TTD数据库6个。合并后共2 430个靶点,删除635个重复值,最终获得1 795个疾病相关靶点。
2.3 三参通脉合剂治疗冠心病潜在作用靶点预测
将筛选得到的1 026个三参通脉合剂作用靶点与1 795个冠心病靶点相映射,取交集得到320个潜在治疗靶点,绘制韦恩图。详见图2。

图2 三参通脉合剂-冠心病靶点韦恩图
2.4 “中药-成分-靶点”网络图与主要活性成分分析
交集得到的320个靶点来源于10味中药的212个潜在活性成分,将其导入Cytoscape 3.9.1系统,构建“中药-成分-靶点”网络图见图3。该网络包含561个节点、3 314条边。紫色圆形代表复方中的中药;六边形代表中药的活性化合物;蓝色菱形代表作用靶点。黄色为太子参、灰色为玄参、橙红色为丹参、青色为延胡索、淡粉色为赤芍、紫色为白芍、粉红色为细辛、淡黄色为柴胡、淡紫色为枳实、绿色为娑罗子、橙黄色为多种中药共有。网络中的成分为多种中药共有,以19个命名为A-S的节点表示共有化合物成分的中药组合,命名方式见表2。网络节点度值表示通过该节点的边的条数,认为度值越大表示该节点在网络中越重要。网络中有161个(76%)化合物与2个及以上靶点作用,化合物平均度值为15.38,中位数度值为8,度值居前10位的化合物见表3。度值较高的化合物可能在三参通脉合剂治疗冠心病中发挥重要的作用。253个(79%)靶点与2个及以上化合物连接,即与其他蛋白有共同配体,靶点度值越高提示该靶点可能参与三参通脉合剂治疗冠心病。

表2 “中药-成分-靶点”网络图中A-S命名规则

表3 “中药-成分-靶点”网络中度值居前10位的化合物
图3 三参通脉合剂-冠心病“中药-成分-靶点”网络图
2.5 PPI网络构建及核心基因筛选
将药物-疾病共同靶点导入STRING 11.5数据库得到PPI网络,将PPI网络导入软件Cytoscape 3.9.1可视化,利用CytoNCA插件进行拓扑分析,以参数(度值、BC、CC、LAC)大于中位数为条件,筛选核心靶点。共筛选2次:初始320个节点、6 145条边,第1次筛选(度值≥30、BC≥0.001、CC≥0.491、LAC≥14.08)后得到107个节点、2 517条边;第2次筛选(度值≥62、BC≥0.004、CC≥0.536、LAC≥30.034)后得到34个节点、511条边,筛选过程见图4。得到的34个节点为核心基因:清蛋白(ALB)、蛋白激酶B(AKT1)、甘油醛-3-磷酸脱氢酶(GAPDH)、血管内皮生长因子A(VEGFA)、白细胞介素1B(IL1B)、Src酪氨酸激酶(SRC)、表皮生长因子受体(EGFR)、丝裂原激活蛋白激酶3(MAPK3)、信号转导和转录激活因子3(STAT3)、胱天蛋白酶3(CASP3)、过氧化物酶体增生激活受体γ(PPARG)、90 kDa热休克蛋白αA1(HSP90AA1)、低氧诱导因子-1A(HIF1A)、HRAS原癌基因(HRAS)、雌激素受体1(ESR1)、基质金属蛋白酶9(MMP9)、酪氨酸激酶受体2(ERBB2)、前列腺素内过氧化物合酶2(PTGS2)、白细胞介素8(CXCL8)、G1/S-特异性周期蛋白-D1(CCND1)、趋化因子配体2(CCL2)、雷帕霉素靶蛋白(MTOR)、Toll样受体4(TLR4)、丝裂原激活蛋白激酶1(MAPK1)、Ras同源基因家族成员A(RHOA)、内皮型一氧化氮合酶(NOS3)、去乙酰化酶Sirtuin-1(SIRT1)、C型蛋白酪氨酸磷酸酶受体(PTPRC)、激酶插入结构域受体(KDR)、丝裂原激活蛋白激酶14(MAPK14)、Janus激酶2(JAK2)、丝氨酸蛋白酶抑制剂家族E成员1(SERPINE1)、E1A结合蛋白P300(EP300)、非受体型蛋白酪氨酸磷酸酶1(PTPN1)。核心基因的PPI网络见图5。

图4 核心靶点筛选过程及结果

图5 核心基因的PPI网络图
2.6 GO功能富集分析和KEGG通路富集分析
GO富集分析结果显示,三参通脉合剂活性化合物治疗冠心病的预测靶点主要富集在2 753个BP、305个MF、186个CC中。显著性较高的20个结果见图6A~图6C。三参通脉合剂治疗冠心病涉及的BP包括蛋白质磷酸化的正调节(positive regulation of protein phosphorylation)、细胞迁移的正向调节(positive regulation of cell migration)、循环系统过程(circulatory system process)等;MF包括蛋白激酶活性(protein kinase activity)、内肽酶活性(endopeptidase activity)、激酶结合(kinase binding);CC包括膜筏(membrane raft)、受体复合物(receptor complex)、轴突(axon)等。

图6 三参通脉合剂活性化合物预测靶点的GO和KEGG富集分析(A为GO-MF富集分析;B为GO-BP富集分析;C为GO-CC富集分析;D为KEGG富集分析)
KEGG富集分析结果显示,三参通脉合剂活性化合物治疗冠心病的预测靶点主要富集在226条通路,详见图6D。显著性较高的20条通路包括癌症途径(pathways in cancer)、脂质和动脉粥样硬化(lipid and atherosclerosis)、流体剪切应力和动脉粥样硬化(fluid shear stress and atherosclerosis)、Ca2+信号通路(calcium signaling pathway)、环磷酸腺苷信号通路(cAMP signaling pathway)等。根据靶点的信号通路富集构建“靶点-通路”网络见图7,该网络有229个节点、495条边,其中节点包括209个基因靶点、20条信号通路。黄色圆形代表预测靶点,红色箭头代表富集的KEGG信号通路。三参通脉合剂治疗冠心病涉及多靶点、多通路。

图7 “靶点-通路”网络图
2.7 分子对接结果
根据“中药-成分-靶点”网络及相关文献选择三参通脉合剂治疗冠心病潜在主要药物成分,综合考虑PPI网络与“中药-成分-靶点”网络选择可能的核心靶点基因。将11种主要药物成分与5个核心靶点AKT1、SRC、EGFR、STAT3、CASP3进行分子对接。共得到55组受体-配体,55组对接最低结合能见图8,55组对接结合能均<-20.93 kJ/mol,提示结合活性均较佳;其中39组(70.9%)对接结合能<-29.30 kJ/mol,提示有强烈的对接活性。以SRC-紫丹参素C(przewaquinone c,HBIN040997)组合对接结合能最低,为-41.02 kJ/mol,结合活性最佳;STAT3-去氢延胡索甲素(dehydrocorydaline,HBIN022998)对接结合能最高,为-24.70 kJ/mol,结合活性相对较差。55组受体-配体中有25组属于“中药-成分-靶点”网络,平均对接结合能为-32.40 kJ/mol,提示网络中药物化合物与靶点间对接活性良好,预测方法合理。另有30组网外组合,平均对接结合能为-31.52 kJ/mol,对接活性良好,在今后研究中值得进一步挖掘与探讨。部分受体-配体分子对接模型图见图9。靶点蛋白、蛋白质残基、药物小分子分别以3种不同颜色标记,黄色虚线为氢键。
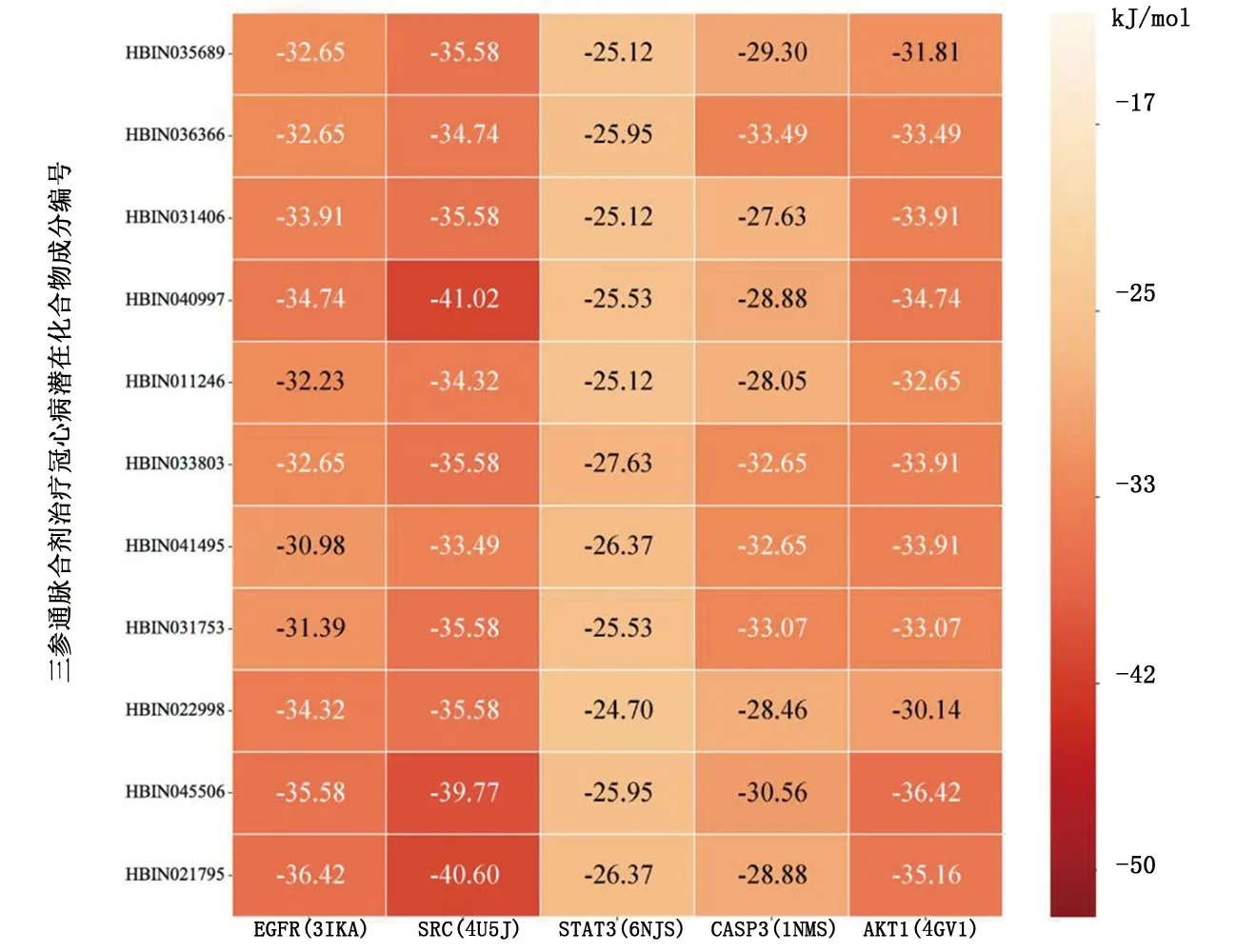
图8 三参通脉合剂预测潜在化合物成分与核心靶点分子对接结果

图9 三参通脉合剂预测化合物-靶点分子对接部分模型图
3 讨 论
冠心病的病理基础为动脉粥样硬化(atherosclerosis,AS),AS累及冠状动脉,冠状动脉供血减少,与心肌需血之间发生矛盾,即冠状动脉血流量无法满足心肌代谢的需要,引起心肌缺血缺氧,进一步积聚乳酸等代谢产物刺激神经产生疼痛。既往研究显示,AS的发生与脂质代谢异常、内皮细胞(EC)损伤、血小板功能异常、平滑肌细胞(SMC)增生等有关,炎症反应促使斑块不稳定或破裂,继发严重持续的心肌缺血[1]。现代医学药物治疗通过改善冠状动脉血供,降低心肌耗氧,改善病人症状,同时阻止AS进展,预防心肌梗死,改善预后。
中医学将冠心病归属于“胸痹”范畴,主要病机为心脉痹阻,瘀血为病理产物。本病临床以老年人多见,表现为气虚血瘀、气阴两虚等夹杂证候。许心如教授经多年临床观察,运用气血辨证理论,创建益气养阴、活血通脉的方法治疗胸痹,以三参通脉合剂为代表方剂。方中太子参益气养阴、丹参活血通脉为君药;延胡索通脉止痛,赤白芍共用养血散瘀止痛,玄参滋阴散结,上四味为臣药;佐娑罗子、细辛温通止痛,助君药通脉而制其苦寒;枳实、柴胡为使药,加强行气之功,助气机条达,诸药合用益气滋阴、理气活血、化瘀止痛。本方常用黄芪加强益气之功;加酸枣仁、女贞子之品效养阴之用。临床广泛使用三参通脉合剂辅助治疗冠心病。
3.1 三参通脉合剂治疗冠心病的潜在有效成分分析
本研究“中药-成分-靶点”网络图中,靶点数量排名居前5位的潜在有效成分为mono-O-methylwightin、柚皮素(naringenin)、izoteolin、紫丹参素C(przewaquinone C)、芹菜素三甲醚(5,7,4′-trimethylapigenin),来源于丹参、赤芍、枳实、延胡索4味药物。其中柚皮素来源于赤芍、枳实,既往研究显示,柚皮素通过减轻炎症反应及氧化应激、抑制血管SMC增殖和迁移[32]、改善脂代谢[33]、抗血小板聚集[34]等防治AS及冠心病。目前关于mono-O-methylwightin、izoteolin、紫丹参素C、芹菜素三甲醚干预冠心病的相关研究较少,作用机制有待进一步验证。网络中一些化学成分来源于三参通脉合剂中的多味中药,且与较多冠心病靶点相连,可能是三参通脉合剂治疗冠心病的物质基础。其中木犀草素来源于三参通脉合剂中3味药物,与38个靶点相连;槲皮素来源于4味药物,与38个靶点相连;山柰酚来源于7味药物,与37个靶点相连。既往研究显示,木犀草素、槲皮素、山柰酚通过调节脂代谢[35-36]、抗炎及抗氧化应激[35-39]、抑制SMC增生[40]等方面抗AS;可扩张血管、抗血小板聚集[36]防治冠心病;对心肌缺血再灌注损伤有保护作用[36,38-39]。
基于文献发现一些已知药物的主要药效成分在网络中与较多靶点相连。丹参主要成分丹参酮ⅡA(tanshinone ⅡA)、隐丹参酮(cryptotanshinone)均与22个靶点相连。既往研究显示,丹参酮ⅡA通过抗炎[41]、抑制SMC增殖并诱导凋亡[42-43]、抗血小板聚集[44]等机制干预冠心病。隐丹参酮可改善缺血区供血[45]、抑制SMC增殖[46]等。延胡索主要成分去氢延胡索甲素(dehydrocorydaline)在网络中与36个靶点相连。相关研究表明,去氢延胡索甲素可扩张冠状动脉,增加冠状动脉血流[47];作用于二磷酸腺苷(ADP)受体(P2Y1和P2Y12)以抗血小板聚集[48];抑制巨噬细胞炎症以改善动脉顺应性,增加斑块稳定性[49];降低钙超载,保护缺血心肌[50]。
3.2 三参通脉合剂治疗冠心病的潜在靶点分析
本研究PPI网络中Degree值排名居前10位的靶点为ALB、AKT1、GAPDH、VEGFA、IL1B、SRC、EGFR、MAPK3、STAT3、CASP3。综合考虑“中药-成分-靶点”网络中的重要性,AKT1、SRC、EGFR、STAT3、CASP3可能在三参通脉合剂治疗冠心病中发挥关键作用,主要涉及炎症反应、细胞异常增殖、细胞凋亡等。
相关研究显示,Src蛋白激酶通过细胞外调节蛋白激酶(ERK1/2)信号通路、p38丝裂原活化蛋白激(p38 MAPK)信号通路、磷脂酰肌醇-3-激酶/磷酸化丝氨酸-苏氨酸蛋白激酶(PI3K/AKT)信号通路等,参与EC的炎症反应、诱导巨噬细胞吞脂和迁移、刺激血管SMC迁移及增殖[51],参与AS整个病理过程;Src可促进血小板活化和血栓形成[52]。STAT3所属的STAT蛋白家族是酪氨酸蛋白激酶-信号转导和转录激活因子(JAK-STAT)信号级联的一部分,参与调控机体免疫反应、血管EC及SMC的迁移与增殖、血管SMC凋亡等[53]。有研究显示,JAK/STAT信号通路及其内源性细胞因子信号抑制物(SOCS)在AS炎症反应中有双向调控作用[54]。EGFR参与调控AS进程中SMC、EC及单核细胞/巨噬细胞的增殖与迁移,促进AS发展[55]。有研究显示,EGFR表达减少引起循环中骨髓源性循环内皮祖细胞(EPCs)数量减少,活性降低,不利于EC损伤修复,参与冠心病的发病机制[56]。CASP3、AKT1等靶点与细胞凋亡密切相关,细胞凋亡参与冠心病的病理过程,导致斑块不稳定、易于破裂,促进血栓形成,诱发冠状动脉痉挛;细胞凋亡是心肌梗死的方式之一,与心肌再灌注损伤密切相关,可能促使心力衰竭演化[57]。阻断或减少心肌细胞凋亡对治疗冠心病有重要意义。CASP3所在Caspase家族是参与和执行细胞凋亡的关键,在细胞凋亡过程中处于核心位置;AKT是PI3K/AKT信号通路的主要参与者,对细胞凋亡有负性调节作用。AKT1活化后通过Caspase家族、Bcl-2家族、Par-4、转录因子家族、代谢途径等调节细胞凋亡[58]。冠心病涉及多个病理过程,炎症反应、细胞异常增殖、细胞凋亡等机制不是绝对独立存在,而是互相作用,共同参与形成冠心病发生发展机制的复杂网络。三参通脉合剂的潜在有效成分可能在多方面发挥作用,进而干预冠心病及AS。
3.3 三参通脉合剂治疗冠心病KEGG通路富集分析
KEGG富集分析显示,三参通脉合剂治疗冠心病可能与脂质和AS途径、流体剪切应力和AS途径、Ca2+信号通路、cAMP信号通路、辅助性T细胞17(Th17)细胞分化通路、NF-κB信号通路、脂肪细胞脂解调节途径等相关,主要涉及脂质代谢、炎症反应、细胞增殖、细胞凋亡等机制。
脂质和AS途径、脂肪细胞脂解调节途径等提示三参通脉合剂干预冠心病可能与调节脂质代谢相关。AS动脉血管壁内斑块富含脂质,低密度脂蛋白胆固醇(LDL-C)水平升高,积聚于血管壁,生成氧化的低密度脂蛋白(ox-LDL),导致内皮功能障碍,促进冠心病进展,调节脂质代谢,降低LDL-C水平可防治冠心病。有研究显示,脂肪细胞脂解调节途径使巨噬细胞中脂滴稳定性升高,进而改善巨噬细胞极性和炎症反应,在危险因素未变化的情况下,防治AS进展[59]。NF-κB信号通路、Th17细胞分化通路等与调节炎症反应相关。AS是一种进展缓慢的慢性炎症疾病。炎症伴随从早期EC修饰脂质激活到斑块的破裂的AS全过程,并促进AS进展。NF-κB信号通路可从多种途径激活NF-κB。既往研究显示,NF-κB控制AS相关细胞因子、趋化因子、黏附分子、急性期蛋白、凋亡调节因子和增殖刺激因子等基因的转录,对AS有调节作用[60]。Th17在慢性炎症疾病中有促炎作用,有研究显示,AS进展与增殖激活的Th17细胞相关,在白细胞介素(IL)-18缺乏情况下,高胆固醇饮食小鼠中胆固醇与同型半胱氨酸通过替代的IL-23/Th17通路协同加速AS[61]。流体剪切应力和AS途径提示在动脉分叉、分支开口和弯曲处往复运动、低剪切应力的扰动流促进动脉壁的氧化、炎症状态和AS发展[62]。血管SMC的异常增殖和迁移受cAMP/PKA信号通路调控。有研究显示,质子感应受体T细胞死亡偶联基因8(TDAG8)通过cAMP/PKA信号通路介导血管SMC的增殖和迁移[63],参与AS发生发展。阿司匹林可抑制cAMP信号通路,下调血管SMC增殖率,上调血管SMC凋亡率,抑制AS进展[64]。钙信号通路调节钙稳态,钙超载促使心肌细胞凋亡、EC损伤,导致冠心病进展[65]。总之,主要的KEGG富集通路与冠心病及AS发生发展相关,三参通脉合剂可能通过调节上述信号通路脂质代谢、炎症反应、细胞增殖、细胞凋亡,从而干预冠心病及AS进展。
3.4 分子对接结果分析
分子对接是基于分子水平预测并评价药物小分子与靶点蛋白的相互作用,分析体的结合位点及二者的结合亲和力,在分子结构方面补充网络药理学的预测能力。本研究使用AutoDock软件进行分子对接,该软件基于格点能量的计算方法,将靶点蛋白嵌入网格中,在每个网格点放置1个探针原子,软件中AutoGrid程序将计算探针与目标之间的相互作用能,将数值存储在网格中[66]。在模拟对接阶段,AutoDock Vina程序根据构象搜索算法探索药物小分子对接的构象状态,并根据AutoGrid生成的能量网格评估对接模拟中每个点配体-受体的相互作用,二者结合力由自由结合能评价,自由结合能越低提示结合越紧密。
本研究对11个小分子化合物与5个核心靶点产生的55个组合以刚性受体-柔性配体的方式进行分子对接,即允许配体调整可旋转键。55组对接结合能均<-20.93 kJ/mol,提示结合活性均较好,其中有25组属于“中药-成分-靶点”网络,平均对接结合能为-32.40 kJ/mol,为网络药理学预测结果增加了分子结构上的可信度。网络Degree值居前5位的化合物中,mono-O-methylwightin、izoteolin、紫丹参素C、芹菜素三甲醚干预冠心病的机制缺少文献与研究的支持,与冠心病核心靶点AKT1、SRC、EGFR、STAT3、CASP3等结合活性较强,可能为今后治疗冠心病提供新的药物小分子选择。30组网外组合平均对接结合能为-31.52 kJ/mol,对接活性良好,为三参通脉合剂主要药物小分子干预冠心病的作用机制提出更多可能,值得进一步研究。总之,分子对接从分子水平解释药物小分子干预冠心病的作用机制提供了潜在依据,为冠心病基础研究尚未关注到的潜在小分子化合物提出新的可能性,增加了网络药理学研究结果的完整性与可靠性。
4 小 结
本研究基于网络药理学研究方法,预测三参通脉合剂作用于冠心病的主要成分与核心靶点,进行GO富集分析与KEGG富集分析预测主要涉及的分子功能、生物进程与信号通路。结果提示三参通脉合剂主要活性成分包括柚皮素、木犀草素、槲皮素、山柰酚、去氢延胡索甲素、丹参酮ⅡA、隐丹参酮等有相关研究支持的成分与mono-O-methylwightin、izoteolin、紫丹参素C、芹菜素三甲醚等有待继续研究的成分,可能主要通过SRC、STAT3、NF-κB信号通路、Th17细胞分化通路等抑制炎症反应;通过EGFR、cAMP信号通路等抑制SMC、EC等的增殖与迁移;通过AKT1、CASP3、Ca2+信号通路等下调心肌细胞凋亡;通过调节脂质代谢稳定斑块、降低危险因素等多种机制干预冠心病及AS的发生发展。本研究对核心靶点与主要活性成分进行分子对接,结果显示,所有预测的对接组合结合活性均较好,在物质结构方面增强了预测意义,可能为今后干预冠心病研究提供潜在选择。网络药理学研究结果是基于已有研究及实验数据,其可靠性受原始研究结果准确性影响较大;网络药理学研究方法弱化了各成分的含量关系,筛选潜在药用成分条件理想化,上述局限性可能导致本研究结果的假阳性与假阴性。本研究提供了今后冠心病研究的潜在方向,尚需大量针对性实验验证,深入探讨三参通脉合剂干预冠心病的药理学机制。

