基于网络药理学探讨柴胡-白术药对治疗阿尔茨海默病的作用机制
金士杰,赵凰宏,关东升,马 振,宋甜甜,王晓静
阿尔茨海默病又称老年性痴呆,临床以认知功能缺损、精神情感障碍等为主要表现,属于不可逆性神经系统退行性疾病。现代医学关于阿尔茨海默病的病理机制研究尚未统一定论,多数认为其可能涵盖Tau蛋白的异常表达、神经细胞的凋亡、基因的遗传关联等多方面。随着老龄化时代的到来,阿尔茨海默病发病率不断增长[1],预计2030年全球阿尔茨海默病病人将达到6 570万例[2]。然而阿尔茨海默病无法治愈,严重影响病人生存和生活质量,因此,亟须寻求新思路和新方法满足临床需求。随着现代生物-心理-社会医学模式普及,有研究显示,长期感知负性情绪可加速认知衰老的进程,是导致阿尔茨海默病的重要病因[3]。柴胡、白术始载于《神农本草经》,二者是临床用于疏肝健脾、调畅情志的经典配伍药对。有研究显示,柴胡、白术具有抗衰老、抗肿瘤、抗炎、调节内分泌的重要功能,是防治阿尔茨海默病的主要中药[4-5]。侯俊林等[6]运用以“柴胡-白术”药对为主的逍遥丸,对肝郁型轻度认知功能障碍进行药物干预,结果显示,用药后病人学习记忆成绩显著改善。网络药理学描述了中药与靶点、疾病等不同作用机制之间的复杂关系,可作为成分复杂、靶点众多中药及方剂的重要研究工具,与中医“整体观念”一致。现阶段运用网络药理学方法验证柴胡-白术治疗阿尔茨海默病的作用机制临床研究报道较少,限制了中药多成分、多靶点、多途径机制的研究新视角。本研究通过中药系统药理学数据库与分析平台(TCMSP)、GeneCards、STRING平台等,对柴胡-白术治疗阿尔茨海默病作用活性成分-靶点网络进行可视化分析,进而探讨该药对治疗阿尔茨海默病的作用机制,并采用DAVID平台进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,以期为探讨柴胡-白术治疗阿尔茨海默病的作用机制提供新思路。
1 资料与方法
1.1 柴胡-白术药对活性成分收集和成分-靶点网络的构建
利用TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)查找柴胡-白术的活性成分及与活性成分相关的潜在靶点。在UniProt数据库(https://www.uniprot.org/)中,将靶点物种限定为人,检索所有靶点蛋白的官方名称。将柴胡-白术药对活性成分和对应靶点导入Cytoscape 3.7.1,构建药物成分-靶点网络图。
1.2 柴胡-白术药对活性成分治疗阿尔茨海默病的蛋白-蛋白互作(PPI)网络构建
登录GeneCards(https://www.genecards.org/)数据库,在检索框中输入“Alzheimer disease”,得到阿尔茨海默病的人类基因。将疾病靶基因和柴胡-白术药对有效成分对应靶基因运用R3.6.2程序进行对接,找到柴胡-白术药对治疗阿尔茨海默病机制中发挥作用的靶基因。之后将这些靶点输入STRING数据库(https://string-db.org/cgi/input.pl),并运用CytoNCN对网络中所有靶点进行拓扑分析,共筛选出40个关键靶标,最后通过Cytoscape 3.7.1软件绘制柴胡-白术药对治疗阿尔茨海默病关键靶点的PPI网络图。
1.3 柴胡-白术药对活性成分与阿尔茨海默病作用靶点的网络构建
将得到的40个关键靶标和柴胡-白术药对有效成分,通过Cytoscape 3.7.1构建药物-分子-关键靶标网络。
1.4 柴胡-白术药对治疗阿尔茨海默病作用靶点的GO功能富集和KEGG通路富集分析
使用DAVID(http://david.ncifcrf.gov/)数据平台对得到的40个关键靶标进行GO功能富集分析和KEGG通路富集分析,以P<0.05作为筛选条件。
2 结 果
2.1 柴胡-白术药对活性成分收集和成分-靶点网络的构建
经过TCMSP收集得到柴胡的活性成分349种、白术的活性成分55种,根据口服生物利用度(OB)≥30%及类药性(DL)≥0.18,同时去掉重复成分,筛选出柴胡-白术药对的有效化合物成分共24种。通过UniProt数据库对24种活性成分进行对应靶点基因检索,其中将具有靶标的16种化合物(见表1)的294个基因进行去重处理,余167个靶基因,并将柴胡-白术16个活性成分及167个靶基因导入Cytoscape 3.7.1 软件中,构建药物-活性成分-靶点网络图(见图1)。柴胡活性成分-靶点网络包括185个节点、310条边,其中粉紫色为167个靶基因节点和黄色为16个活性化合物节点[柴胡(绿色)12个,白术(蓝色)4个]。根据化合物与靶基因关联的度值(Degree值),认为槲皮素、山柰素、豆甾醇、异鼠李素、3β-乙酸化苍术酮等可能是该药对发挥主要作用的活性成分。
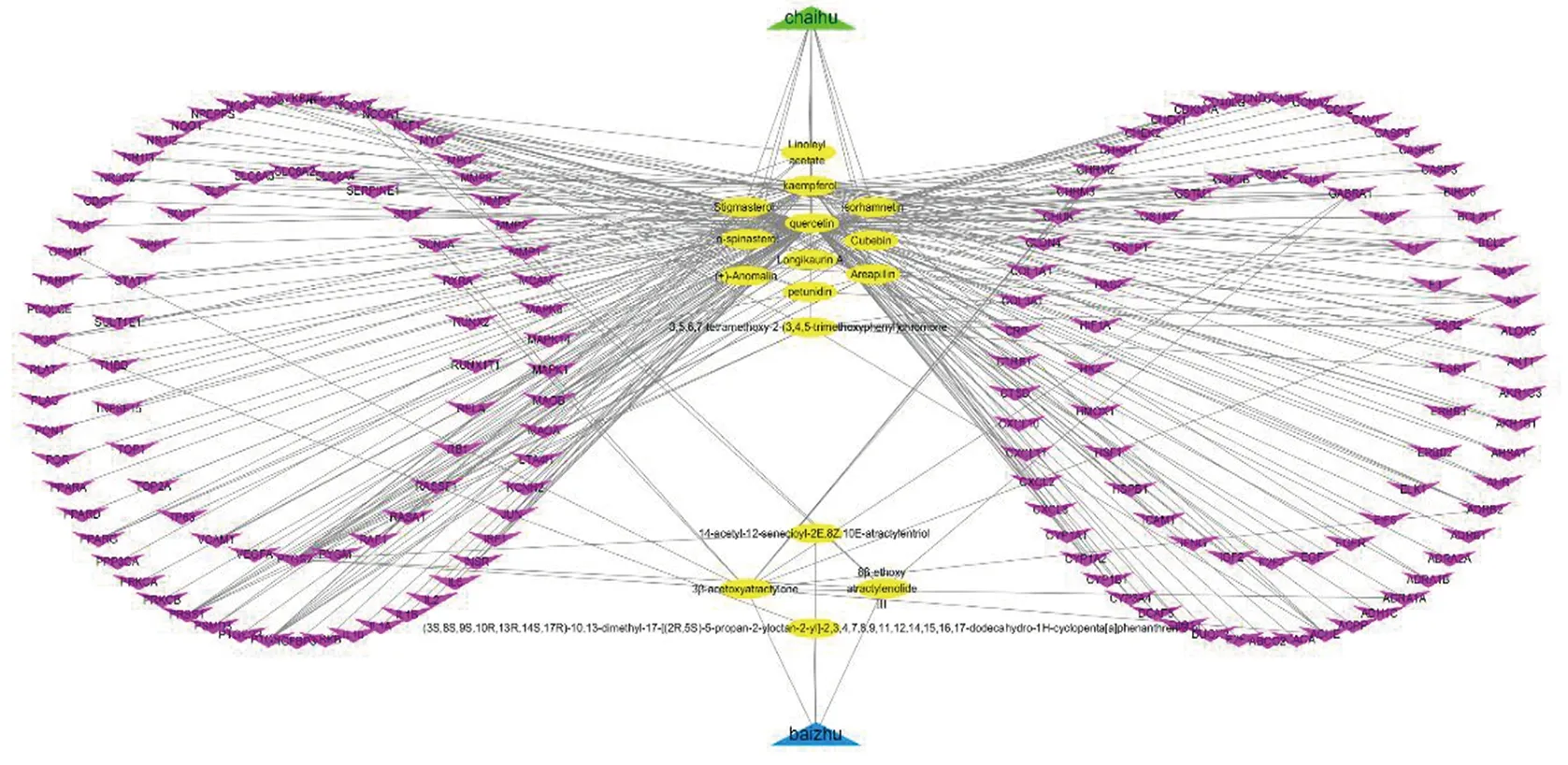
图1 柴胡-白术药对活性成分-基因靶点网络图

表1 柴胡-白术药对含有的16种活性成分
2.2 柴胡-白术药对活性成分治疗阿尔茨海默病PPI网络及活性成分-阿尔茨海默病作用靶点的网络构建
通过GeneCards收集到与阿尔茨海默病相关的靶基因8 730个,之后将疾病靶基因和柴胡-白术有效成分对应的167个靶基因运用R3.6.2程序进行对接,找到柴胡-白术治疗阿尔茨海默病机制中发挥作用的靶基因138个。将这些潜在靶标输入STRING数据库,将物种限定为“Homo sapiens”,探寻靶基因相互间的作用关系,并进行可视化分析(见图2)。其次,将STRING生成的文件输入Cytoscape 3.7.1,运用CytoNCN对网络中所有靶点进行拓扑分析,满足每个靶点的Degree值、接近中心度(betweenness)、介度中心度(closeness)等拓扑参数值大于中位数,筛选出40个基因作为关键靶点[7],绘制出柴胡-白术药对-阿尔茨海默病关键靶点的PPI网络图(见图3),共40个节点、493条边。Degree值代表该靶点在网络节点中需要承载的流量,即数值越大提示流量越大,居前10位分别为蛋白激酶B(AKT1)、丝裂原活化蛋白激酶1(MAPK1)、半胱氨酸蛋白酶3(CASP3)、白细胞介素-6(IL-6)、血管内皮生长因子A(VEGFA)、转录因子c-JUN N-末端激酶1/2(JNK)、癌基因(MYC)、表皮生长因子(EGF)、丝裂原活化蛋白激酶8(MAPK8)、核磷蛋白FOS(FOS)可能是该药对的主要调控对象。将上述40个关键靶点和柴胡-白术药对分子之间的相互关系通过Cytoscape 3.7.1进行可视化分析,构建“药物-分子-关键靶标”网络(见图4),9个活性成分与40个关键靶点之间的相互作用反映了柴胡-白术药对治疗阿尔茨海默病有效成分的多靶点作用机制,其中,槲皮素介数最高,可作用于33个核心靶基因,是柴胡-白术药对治疗阿尔茨海默病的主要成分。
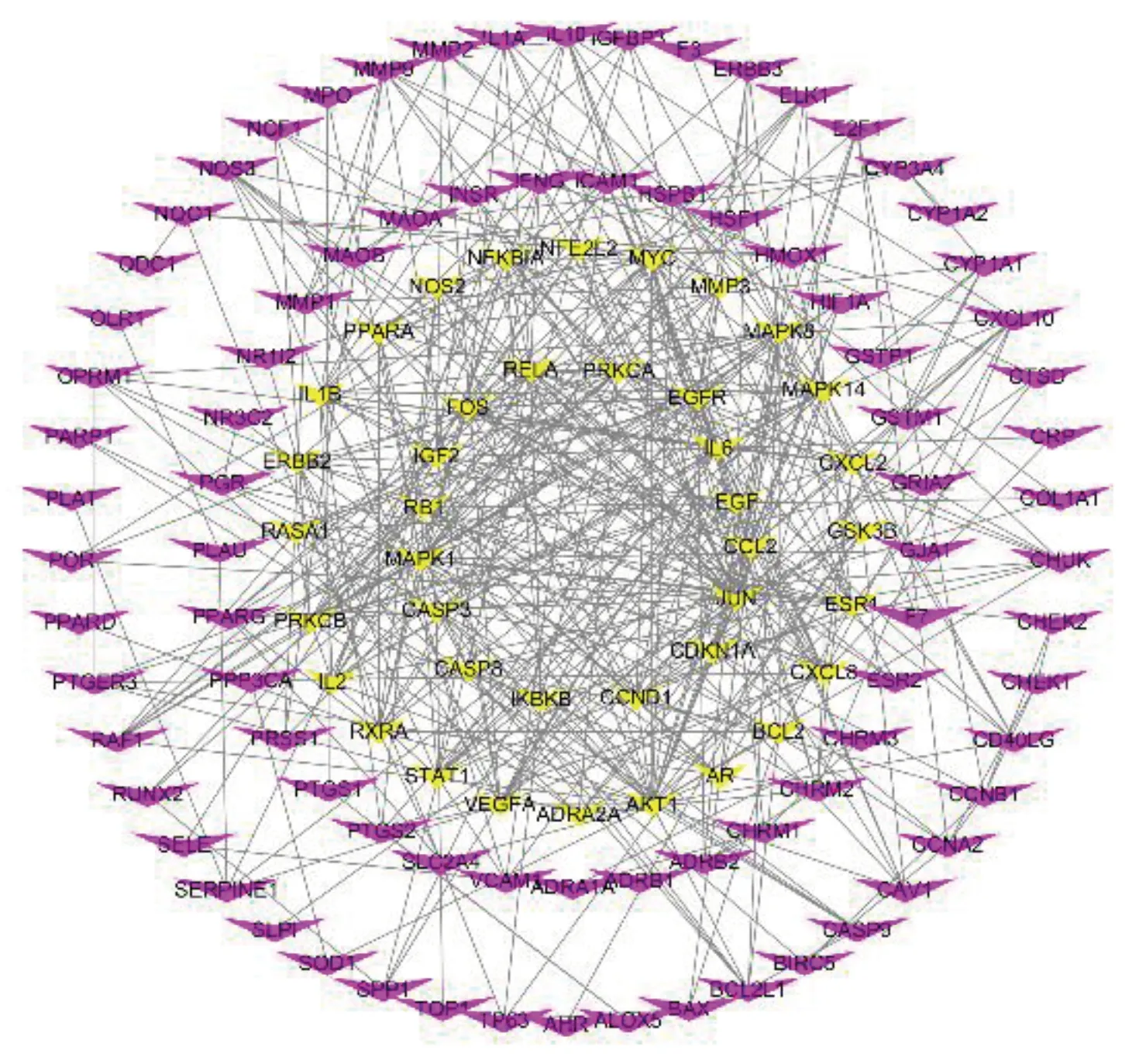
图2 柴胡-白术药对-阿尔茨海默病的作用靶点交互网络图
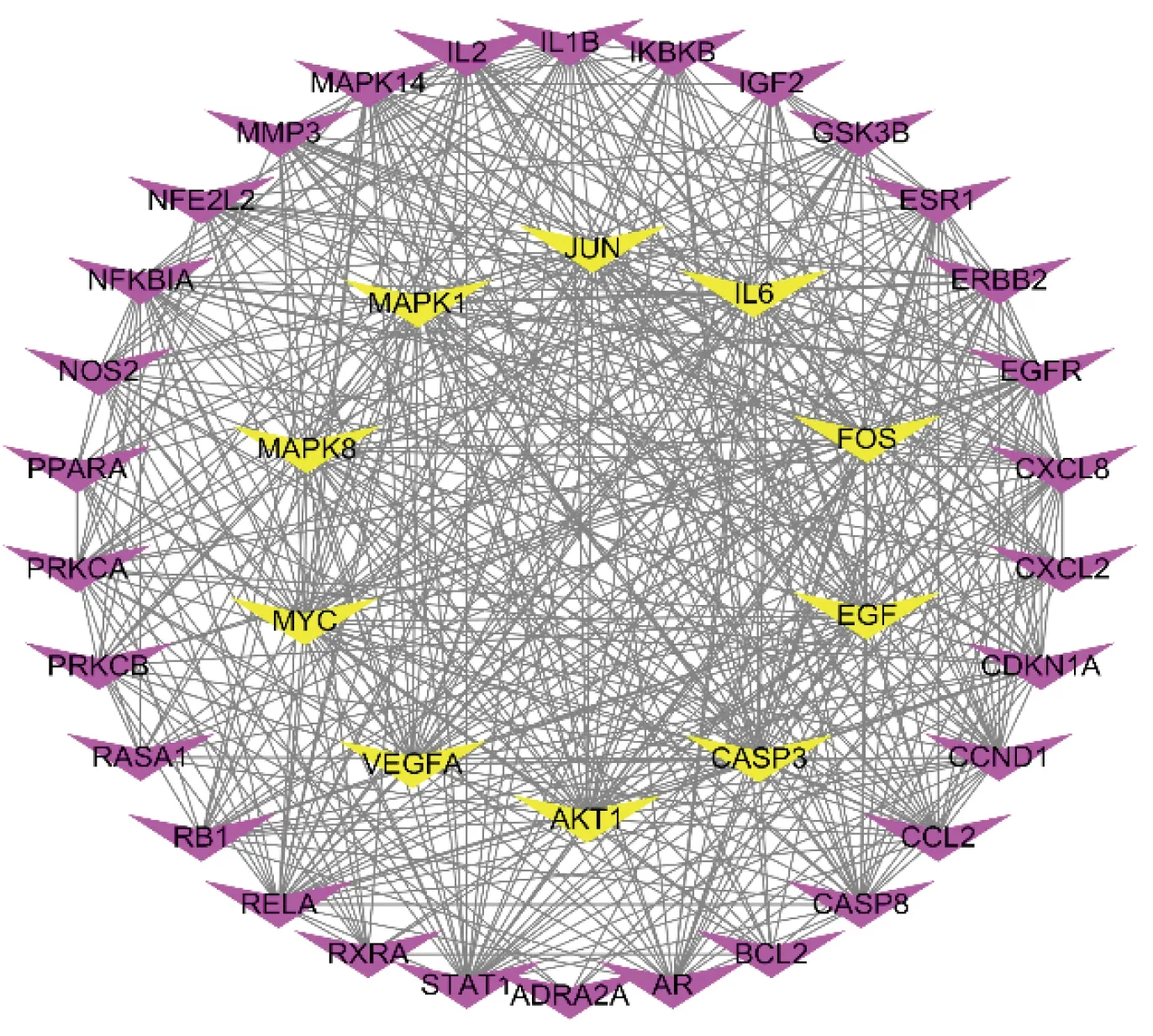
图3 柴胡-白术药对-阿尔茨海默病的关键靶点交互网络图
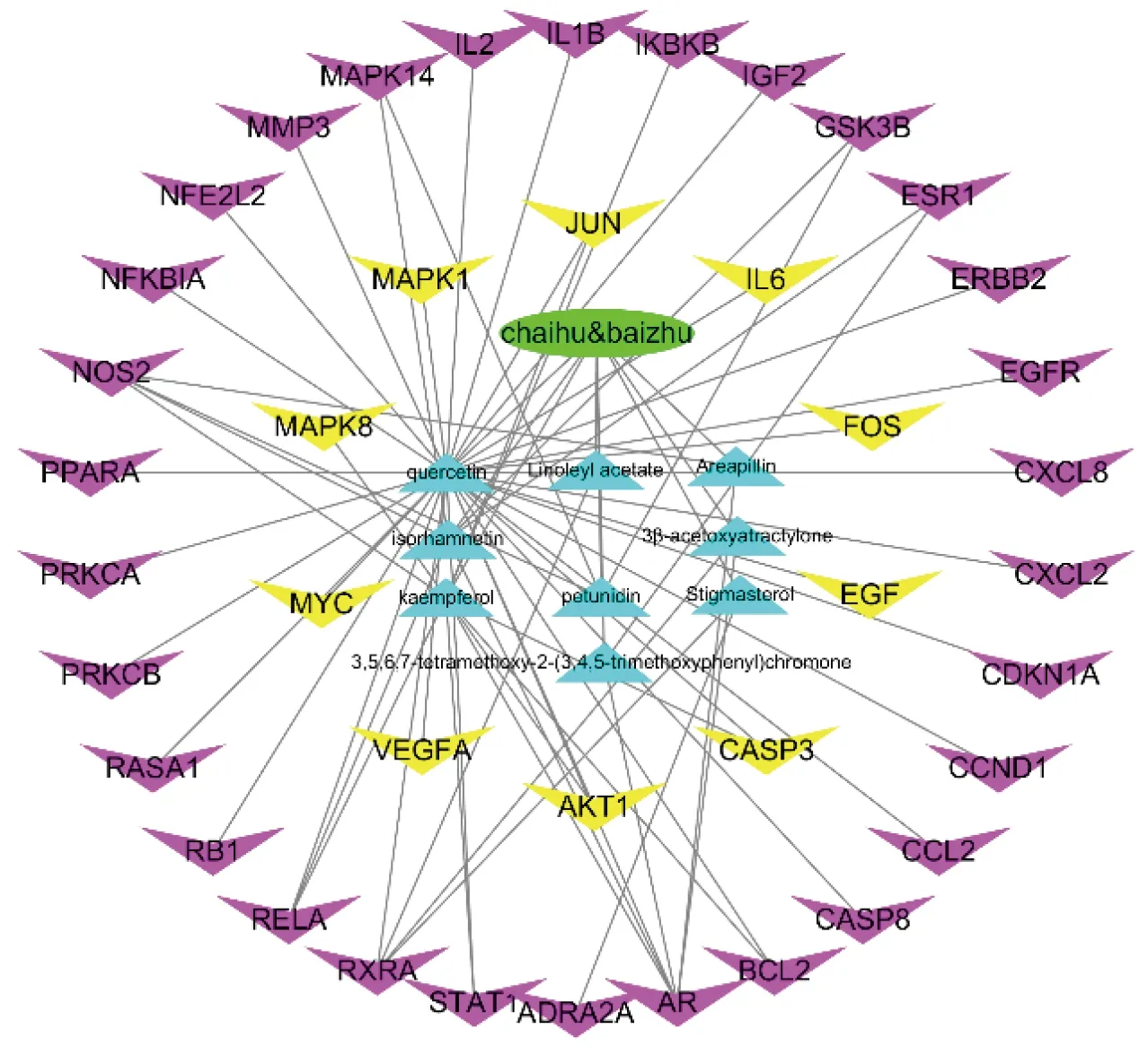
图4 “药物-成分-关键靶点”交互网络图
2.3 柴胡-白术药对治疗阿尔茨海默病作用靶点的GO功能富集分析
使用DAVID平台对40个关键靶标进行GO功能富集分析,按照P<0.05得到313条信号相关条目,其中19条细胞组分信号通路、241条生物过程信号通路及53条分子功能通路。选取20条密切的通路功能信息,详见表2。细胞组分方面,主要与细胞质有关,活性成分主要富集在转录因子结合、酶结合、蛋白质结合、相同蛋白结合、蛋白激酶活性等分子功能中;生物过程方面,主要通过RNA聚合酶Ⅱ启动子转录的正调控、凋亡过程的负调控、DNA模板转录正调控、对有机环状化合物的细胞反应、细胞增殖正调控、脂多糖介导的信号通路、肽基丝氨酸磷酸化、药物反应、血管内皮细胞迁移的阳性调节、基因表达的阳性调控、MAPK梯级、炎症反应等多个机制发挥治疗阿尔茨海默病的作用。

表2 柴胡-白术药对治疗阿尔茨海默病作用靶点的GO功能富集分析
2.4 柴胡-白术药对治疗阿尔茨海默病作用靶点的KEGG通路富集分析
将40个关键靶标导入DAVID平台进行KEGG通路富集分析。按照P<0.05筛选出104条信号通路,选取20条与阿尔茨海默病密切相关的重要通路。除了存在阿尔茨海默病通路外,还涉及癌症途径、乙型肝炎、NOD样受体信号通路、Toll样受体信号通路、缺氧诱导因子-1(HIF-1)信号通路、ErbB信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、磷脂酰肌醇3-激酶(PI3K)-AKT信号通路、胶质瘤、神经营养素信号通路、叉头蛋白表达因子O(FOXO)信号通路、细胞凋亡、胰岛素抵抗、多巴胺能突触、胆碱能突触、钙信号通路、5-羟色胺能突触、长期抑郁等通路。详见表3。柴胡-白术药对可能主要通过上述通路对阿尔茨海默病发挥作用。

表3 柴胡-白术药对治疗阿尔茨海默病作用靶点的KEGG通路富集分析
3 讨 论
中医学根据阿尔茨海默病的认知功能减退及人格、行为改变等典型症状,将其归属于“痴呆”的范畴,认为该病的发生、发展与情辨志关系密切,肝气郁结、脾胃亏虚是重要病机之一。《辨证录·呆病门》有云:“然而呆病之成,必有其因,大约其始也,起于肝气之郁;其终也,由于胃气之衰”。《滇南本草》记载:“柴胡,味苦,性微寒,阴中阳也。入肝、胆二经”。《药品化义》中言:“白术……性气与味俱厚,入脾胃三焦三经”。柴胡-白术是临床经典的配伍药对,二者合用具有疏解肝气、健运脾胃之功效。有研究显示,以“柴胡-白术”为主配伍的方剂,具有减轻自由基氧化损害、调节中枢胆碱能神经元和单胺类神经元活性的重要作用,是临床防治阿尔茨海默病的主要方剂之一[8]。侯俊林等[6]运用逍遥丸对痴呆临床前期中老年病人进行药物干预,结果显示,用药后DNA的氧化损伤较用药前明显改善。
柴胡-白术药对的“化合物-靶点”网络分析中,槲皮素对应的关键靶标最多,说明其是该药对防治阿尔茨海默病的主要成分。现代研究显示,槲皮素具有抗氧化、抗炎、保护神经元、平衡钙稳态和提高突触间传递的作用,可治疗神经系统退行性病变[9-10]。本研究通过对该药对关键靶点的筛选,发现其有效化合物成分主要通过AKT1、MAPK1、CASP3、IL-6、VEGFA、JUN、MYC、EGF、MAPK8、FOS等靶点改善认知功能。MAPK1和MAPK8是MAPK信号转导途径中的重要分子,可激活MAPK磷酸化和Bcl-2磷酸化途径,通过Tau的过度磷酸化和淀粉样蛋白-β(Aβ)肽在液泡中的积累,产生细胞内神经纤维缠结和神经元细胞死亡[11-12]。有研究显示,脑血流改变是阿尔茨海默病早期突出的持续性变化,VEGFA mRNA表达可影响神经元、星形胶质细胞和内皮细胞表达,EGF可防止Aβ诱导的体外对脑内皮细胞损害,若二者表达异常可能增加罹患阿尔茨海默病的风险[13]。AKT1、CASP3、IL-6、JUN等基因及MYC、FOS等参与氧化应激、炎症反应等生物过程,均在细胞凋亡、细胞增殖及细胞迁移等多种细胞过程中发挥着重要的调节作用[14-17]。GO功能富集分析结果显示,柴胡-白术药对的活性成分可能主要通过转录因子结合、蛋白激酶活性、细胞增殖正调控、肽基丝氨酸磷酸化、血管内皮细胞迁移的阳性调节、MAPK梯级、炎症反应等多机制发挥治疗阿尔茨海默病的作用。KEGG富集通路除了包括阿尔茨海默病通路、胆碱能突触、钙信号通路、5-羟色胺能突触等常见通路外,同时发现了多条重要通路,其中癌症的途径通路、MAPK信号通路值得关注。
痴呆和癌症是人口老龄化的病理产物,极大影响了人们的生存质量,二者存在相互冲突的现象,即癌症以不受控制的细胞增殖为特征,进行性神经元死亡提示着神经退行性变。相关研究团队检索138个与阿尔茨海默病、癌症相关的基因,发现124个在细胞代谢过程中紧密相连,选择性自噬接头蛋白(SQTM1)、泛素竣基末端水解酶(UGHL1)、分子伴侣蛋白(STUB1)、表皮生长因子受体(EGFR)等9个基因在二者疾病中呈显著相关[18]。有研究对神经胶质瘤和阿尔茨海默病的miRNA表达数据库分析后发现,has-miR-106a、has-miR-20b、has-miR-424等13个miRNA中有12个出现反向表达模式[19]。因此,可能需要在阿尔茨海默病群体中研发特定癌症药物或在癌症病人中运用特定的治疗阿尔茨海默病药物。本研究结果显示,MYC、FOS、AKT1及游离DNA EGFR等与胶质瘤、乳腺癌等多个途径关系密切,均是柴胡-白术药对治疗阿尔茨海默病的关键靶标,且EGFR也是Cristina研究团队检索结果中阿尔茨海默病和癌症显著相关的基因之一,柴胡、白术也是癌症治疗常用药[20-21]。推测柴胡-白术药对治疗癌症和阿尔茨海默病具有“异病同治”的双向调节功效。因此,探讨癌症与阿尔茨海默病之间看似冲突疾病的干预机制,可能为今后新药研发、临床研究提供了方向。无论是关键靶标还是富集结果,MAPK信号通路均与阿尔茨海默病有密切联系。ERK1/2、c-JUN和p38-MAPK是MAPK信号通路主要组成部分,激活信号通路在阿尔茨海默病发生发展中具有重要作用。其中的MAPK/ERK通路可在纤维状Aβ诱导下持续激活,引起Tau蛋白的异常磷酸化、神经突的变性及神经元细胞凋亡,进而影响学习记忆能力[22]。因此,认为柴胡-白术治疗阿尔茨海默病的调节是通过多途径实现的。
综上所述,基于网络药理学技术探讨柴胡-白术药对治疗阿尔茨海默病的复杂机制,柴胡-白术药对多成分作用于相关靶点及通路,从而发挥治疗作用。本研究存在一定的局限性:中药复方中其他中药成分对该药对的活性成分差异产生影响、过滤掉的药物成分作用贡献及上述提及的该药对治疗癌症与阿尔茨海默病机制的关联性等尚未明确,本研究结果有待后续实验进一步验证。

