经皮冠状动脉介入术后支架内再狭窄的研究进展
杨尚铭,李首才,耿超强,高 奋
目前,我国心血管疾病病人约3.3亿例,其中冠心病病人约1 139万例[1]。经皮冠状动脉介入(percutaneous coronary intervention,PCI)已成为诊断冠心病及治疗严重冠状动脉狭窄的重要手段[2-4]。据估计,我国行PCI术的病人平均置入支架1.46枚[1]。虽然PCI可使闭塞的血管再通,改善血流动力学,缓解临床症状,挽救生命,但PCI后可能激活新的动脉粥样硬化,在数月到数年内发生支架内再狭窄(in-stent restenosis,ISR)。ISR是支架置入的不良后果,也是PCI的重要限制。虽然支架可减少管腔急性回缩并重塑动脉管腔,但会促进新生内膜增生及平滑肌细胞的增殖和迁移,导致血运重建失败,发生不良心血管事件。综述ISR的影响因素、发病机制及治疗策略。
1 ISR概述
1.1 ISR的定义与分类
ISR是指PCI术后复查冠状动脉造影(coronary angiography,CAG),支架内及近端、远端5 mm范围内管腔直径狭窄程度≥原有管腔的50%,伴有或不伴有临床症状及主要不良心血管事件等。ISR通常与急性冠脉综合征的复发有一定相关性,可能导致病人再次进行PCI或冠状动脉旁路移植(coronary-artery-bypass-grafting,CABG)干预,即靶病灶血管重建(target lesion revascularization,TLR)[5]。为描述ISR的形态特征,Mehran等于1999年提出了ISR分类系统,将ISR分为4型:Ⅰ型(局灶型)指ISR病变长度≤10 mm;Ⅱ型(弥漫型)指ISR病变长度>10 mm,狭窄处于支架内;Ⅲ型(增殖型)指ISR病变长度>10 mm,且病变延伸到支架外;Ⅳ型(闭塞型)指支架所在血管管腔完全闭塞,Ⅰ、Ⅱ、Ⅲ、Ⅳ型所需血运重建的概率分别为19%、35%、50%及98%,对临床初步评估ISR病人的预后也有一定价值[6-7]。基于血管内超声(intra vascular ultra-sound,IVUS)及光学相干断层扫描(optical coherence tomography,OCT),Shlofmitz等[8]按ISR的形成机制分为5类,即机械因素、生物因素、混合(机械及生物)、慢性完全闭塞(chronic total occlusion,CTO)和多层支架置入。
1.2 ISR的影响因素
有研究显示,超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、同型半胱氨酸(homocysteine,Hcy)、糖尿病、冠状动脉分叉病变和支架长度是PCI术后ISR的独立危险因素[9],且尿酸、血脂代谢紊乱等会影响ISR的发生发展。
1.2.1 hs-CRP
hs-CRP是动脉粥样硬化的炎症介质,也是反映心脑血管事件发生的有效炎症标志物。PCI术后hs-CRP水平升高提示血管处于炎症反应活动期,增加了动脉粥样硬化斑块的不稳定性,导致血液高凝状态,这可能是ISR的一个发病因素。Cheng等[9]研究结果表明,与正常的hs-CRP水平相比,较高水平的术前hs-CRP与较高的动脉再狭窄发生率相关,因此,测定PCI手术前后hs-CRP水平可能有助于预测ISR发生。目前关于hs-CRP水平对ISR影响的具体机制及界值仍需进一步研究证实。
1.2.2 Hcy
Hcy是蛋氨酸向半胱氨酸转化的中间氨基酸。Hcy水平升高对血管内皮细胞的基因表达产生直接或间接的影响,进而导致内皮细胞的毒性作用,引起细胞凋亡。因此,动脉血管平滑肌细胞过度生长、增殖和纤维化,引起血管内皮增厚,动脉弹性受损,支架内形成硬化斑块可能是ISR潜在的发病机制。Guo等[10]研究显示,血清Hcy水平可作为PCI术后ISR严重程度的预测指标,且血清Hcy水平与ISR严重程度呈正相关。因此,对高同型半胱氨酸血症病人进行早期干预,可降低术前和术后Hcy水平,有助于预防ISR的发生。
1.2.3 糖尿病
糖尿病是预测ISR发生的一个独立因子[11]。Paramasivam等[12]随访PCI术后病人发现,1年后行TLR治疗的2型糖尿病病人占6.8%,非糖尿病病人占4.6%,且CAG结果显示2型糖尿病病人支架边缘ISR发生率(20.3%)较高。糖尿病心血管疾病的病因包括多种因素,如促进炎症反应、增加氧化应激、肾素-血管紧张素-醛固酮系统的慢性激活和先天免疫异常的适应不良相互作用的融合。2型糖尿病病人特别是存在胰岛素抵抗的病人,机体胰岛素水平升高,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)激活,诱导内皮细胞的过度增殖,激活凝血系统,促进血栓形成,引起对标准抗血栓治疗有抵抗力的血栓形成,从而导致糖尿病病人死亡率升高。Chandrasekhar等[13]随访1年发现,与非糖尿病病人相比,糖尿病病人发生主要不良心脏事件风险较高,且胰岛素治疗的糖尿病病人较非胰岛素治疗的糖尿病病人具有更大的调整风险。经胰岛素治疗的糖尿病病人相关死亡率增加原因尚未明确,仍需进一步探讨。
1.2.4 冠状动脉分叉病变及支架长度
冠状动脉病变分叉决定了PCI操作的复杂程度,导丝牵拉、球囊扩张等操作均引起血管内皮功能障碍,加重炎症反应,导致支架置入后再狭窄发生率增加。Cheng等[9]研究显示,冠状动脉分叉病变是ISR的独立危险因素。支架长度是ISR的另一个独立危险因素,随着支架长度的增加,手术操作复杂,球囊扩张次数增多,进一步加大对血管的损伤,增强了炎症反应,从而增加了ISR的风险。因此,CAG可准确预测病灶长度和血管直径,PCI术中精准防止支架可降低ISR发生率。
1.2.5 尿酸
尿酸是机体内嘌呤代谢的最终产物,通过肾脏排泄。低浓度尿酸可保护血管紧张素转换酶(angiotensin converting enzyme,ACE)免于氧化失活,表现为抗氧化作用;当尿酸水平升高时,介导自由基产生,导致内皮细胞损伤。Lan等[14]研究显示,尿酸水平升高可增加冠心病发病率。Turak等[15]研究显示,血清尿酸>327.25 μmol/L是发生ISR的独立危险因素。李子文等[16]研究显示,尿酸水平与冠状动脉病变程度呈正相关。目前尿酸水平对ISR的影响机制尚未明确,低水平尿酸对心血管系统的影响仍需进一步阐明。
1.2.6 血脂代谢异常
血脂代谢异常包括高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)升高。O′Neill等[17]研究显示,HDL-C通过降低炎性因子释放、抑制单核细胞趋化因子-1表达、阻止单核细胞迁移等机制发挥抗炎作用;另一方面,HDL-C水平升高可影响纤维蛋白凝块的渗透性和溶解时间[18],其作用机制可能为HDL-C在高密度脂蛋白受体(SR-BI)介导下抑制血小板聚集、纤维蛋白连接及血栓素-2分泌。HDL-C的抗凝活性主要由HDL-C颗粒大小决定,血脂水平升高的病人体内HDL-C颗粒直径变小或有变小趋势,增强HDL-C颗粒的凝血活性,继而导致ISR进展。LDL-C作为动脉粥样硬化的始动因素,通过损伤内皮细胞、促进泡沫细胞和支架内新发动脉粥样斑块形成,引起ISR事件的发生。氧化型低密度脂蛋白(ox-LDL)作为ISR的一个独立危险因素,可诱导内皮细胞、血小板、吞噬细胞释放生长因子,引起血管平滑肌增殖,参与支架内新发动脉粥样斑块形成。
1.3 ISR对临床预后的影响
ISR并发症包括稳定型心绞痛、不稳定型心绞痛、急性冠脉综合征、急性心肌梗死或死亡。ISR的血运重建过程可能发生入路部位出血、支架扩张不足、血运重建不完全、冠状动脉夹层和支架内血栓再次形成等并发症。目前针对ISR的治疗策略,如第2代DES和药物洗脱球囊(DEB)已显示出良好的疗效和安全性[19]。但目前对比2种方案心血管获益方面的研究较少。
2 ISR的发生机制
2.1 血管内膜结构的新生
有研究显示,PCI术后3~6个月内血管内膜新生是ISR的主要机制之一[20],新生内膜增生涉及血小板、平滑肌细胞(smooth muscle cell,SMC)和内皮细胞(endothelial cells,EC)及炎症细胞之间的相互作用。行PCI治疗时,球囊扩张及支架置入等操作在减轻血管狭窄同时不可避免地造成血管内膜损伤,从而诱导血小板的活化等一系列生理过程;活化的血小板释放各种生物活性因子,通过黏附分子的级联反应诱导平滑肌细胞增殖、白细胞募集和凝血级联活化,促进平滑肌细胞去分化后迁移到内膜损伤处形成新内膜。Brancati等[21-22]研究显示,PCI术后6个月膜形成达到高峰,之后3年内逐渐衰减。多能血管干细胞(multipotent vascular stem cell,MVSC)作为一种机械敏感单元,在内膜增生过程中也发挥作用。通过生物反应器系统模拟支架置入的细胞实验显示,MVSC拉伸应变方向发生变化,观察到高度增殖区域,可能与体内新生内膜增生导致ISR有关[23]。
2.2 新动脉粥样硬化形成
Hong等[24]研究显示,新生的动脉粥样硬化是发生ISR的另一重要机制。新生动脉粥样硬化在ISR的表现为支架周围形成泡沫样巨噬细胞富集,进而发展成纤维粥样瘤,最后形成坏死的脂质核心。泡沫状巨噬细胞浸润新生内膜,导致脂质斑块的纤维帽变薄,可能增加斑块破裂的风险[25]。Nakamura等[26]研究显示,新生动脉粥样硬化是支架置入后晚期ISR发生的主要机制。随着支架置入时间的延长,在支架中观察到新生动脉粥样硬化概率增加。有研究显示,不管是支架内ISR,还是支架边缘发生的ISR,均与新生动脉粥样硬化密切相关[27]。目前关于ISR机制的研究尚未明确,有待进一步研究证实。
2.3 血管平滑肌细胞(vascular smooth muscle cell,VSMC)的迁移及增殖
动脉内皮上均存在平滑肌细胞,保证了动脉的收缩过程。血管内皮正常时,VSMC表现为静止表型,当发生动脉粥样硬化时,VSMC可下调VSMC收缩标志物的基因表达,同时上调骨桥蛋白(osteopontin,OPN)的合成蛋白表达而转变为合成表型,具有增殖和迁移能力[28]。在转化生长因子β(TGF-β)等炎性因子作用下,VSMC由中膜迁移到内膜,同时分泌细胞因子,促进内膜增生,导致ISR[29]。VSMC的异常增殖和迁移是心血管疾病共存的病理生理表现,动脉粥样硬化发生时,内膜增生,高血压和血管成形术后再狭窄中广泛存在。有研究表明,VSMCs 的表型转化可能有核因子(NF)-κB、丝裂原活化蛋白激酶信号通路、磷脂酶C/蛋白激酶C信号等,同时,血小板源性生长因子(platelet derived growth factor,PDGF)在血管损伤过程中促进VSMC表型转化。PDGF家族由PDGF-AA、PDGF-AB、PDGF-BB、PDGF-CC和PDGF-DD共5种蛋白组成。有研究表明,PDGF-BB是有效的VSMC增殖刺激物之一[30]。
2.4 血小板激活
血小板是最小的血细胞,可从细胞内颗粒中释放数10种活性剂,在血栓形成和止血过程中发挥重要作用。PCI球囊扩张及支架置入损伤血管弹性管腔,血小板和纤维蛋白首先在破损的内皮处聚集,血小板被激活,表达P-选择素,同时通过淋巴细胞功能相关抗原-1(LFA-1)等黏附分子结合内皮细胞、细胞外基质蛋白和血小板受体,上调免疫细胞的募集和黏附分子表达。血小板与中性粒细胞的结合诱导增强中性粒细胞的活性,增强炎症反应,从而导致VSMCs释放某些趋化因子如PDGF、碱性成纤维细胞生长因子2(FGF-2)等。参与炎症反应的细胞通过细胞外基质重构,导致新生内膜进一步增生[31]。血小板在新生内膜增生的过程中均发挥一定作用,因此,ISR病人的抗血小板治疗十分必要。考虑到血小板在新生内膜形成过程中的作用,较高的血小板活性可能是ISR病人的不良预后因素。
2.5 细胞外基质重构
细胞外基质是人体的重要组成部分,可在体内维持心血管网络的结构完整性,调节细胞黏附,参与血管修复及重构。支架置入后早期反应即SMC迁移、增殖和细胞外基质产生增加。有研究显示,约50%的新生内膜由细胞外基质蛋白构成,ISR后冠状动脉细胞外基质中的蛋白质组学蛋白聚糖水平升高[32]。随着VSMCs和炎性细胞黏附在细胞外基质上增殖,更多的基质金属蛋白酶(matrix metalloproteinase,MMP)释放,参与ISR的发生。
2.6 microRNA(miRNA)
miRNA在转录后可上调节基因的表达,影响心血管疾病在内的众多病理生理过程[33-34]。miRNA在血管组织中大量表达,并调节抗促血管生成的表达基因[35]。miRNA可在血管细胞分化、收缩、迁移、增殖等不同功能中发挥重要作用。调节NF-κB的miRNA[36]可作为免疫、炎症、细胞存活、分化和增殖的潜在调节剂,影响动脉粥样硬化在内的许多心血管疾病。miRNA可影响脂质代谢,miRNA-223的转录和表达增加,之后胆固醇在这些细胞中积累,通过负反馈作用,抑制细胞中胆固醇合成,增加RCT效率[37]。
3 ISR的治疗策略
根据个体差异进行ISR治疗策略的制定。参照指南[38],推荐DES可用于裸金属支架(bare metal stent,BMS)或DES术后的ISR(ⅠA)、DCB治疗ISR(ⅠA)应考虑使用IVUS和/或OCT研究ISR机制问题(ⅡAC),对反复发生ISR的病人优先考虑CABG(ⅡAC)。无症状ISR病人的干预措施不应完全依赖血管造影结果。有研究表明,中等程度的无症状病人从常规再干预中受益的可能性较小[39]。可使用分数流量储备(fractional flow reserve,FFR)评估ISR病人的冠状动脉,明确再干预的必要性。ISR分类[8]见表1。
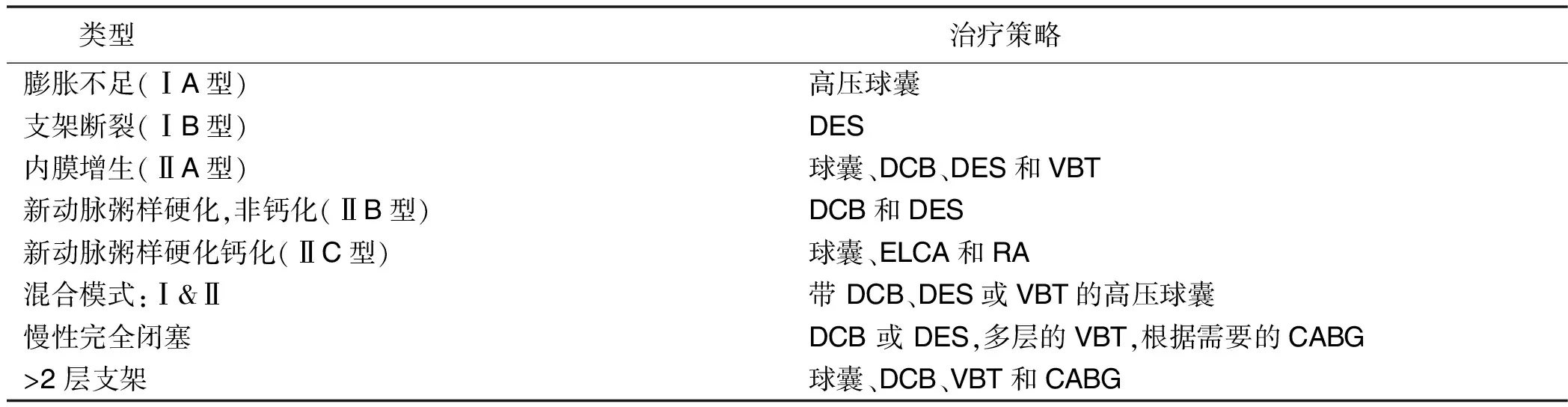
表1 ISR分类
3.1 一般治疗
ISR的一般治疗包括控制危险因素及药物治疗。控制危险因素方面包括控制血糖、血压、血脂、血尿酸水平,戒烟、控制体重、纠正不良的生活习惯。药物治疗方面,术后指导病人规律服用冠心病二级预防药物,避免私自停药、换药,定期复查各项指标,以便及时调整药物剂量。加强病人健康宣教,提高用药依从性。有研究显示,DES-ISR可延长双联抗血小板治疗时间[40],再次干预前后应按照指南建议使用双联抗血小板药物,降脂药物也应继续使用。
3.2 无异物治疗策略
3.2.1 单纯球囊扩张术(percutaneous transluminal coronary angioplasty,PTCA)
PTCA作为开展最早的ISR治疗策略之一,因技术简单、风险低,效果显著被广泛接受,CAG可见支架与天然动脉管径大小不匹配时,PTCA是一种优选。PTCA存在局限性,主要包括支架边缘的损伤及球囊滑脱。虽然通过增加球囊尺寸可避免球囊滑脱的问题,但其再发ISR的风险未得到有效解决。对股腘(FP)动脉ISR的研究中发现,PTCA术后发生ISR概率较高,按照FP-ISR的分类标准,Ⅰ类(局灶性病灶长度≤50 mm)ISR再发率为49.9%,Ⅱ类(包括弥漫性病灶长度>50 mm)ISR再发率为53.3%,Ⅲ类(完全闭塞的ISR)ISR再发率为84.8%[41]。早期关于PTCA的研究主要为作用机制及临床应用可能出现的并发症,包括斑块破裂、内膜剥离和血管过度拉伸等,这些也是引起术后血栓形成、ISR等问题的主要原因[42]。随着PTCA球囊临床应用数量和种类的增多,对不同类型钙化病变的PTCA球囊选择精细化,仍需进一步临床研究验证。
3.2.2 切割球囊
切割球囊是治疗ISR简单、有效的技术,将切割球囊送入病变部位后,扩张球囊刀片先伸出,纵行切开支架内增生的内膜组织后,使球囊完全扩张,血管弹性膜和钙化斑块产生受控的断裂线,破坏钙化斑块的连续性,以增强病变血管段顺应性,使管腔增大,并有效减少弹性回缩[43],同时该装置的侧向刀片可将球囊固定在目标病变内,防止球囊滑动。切割球囊的刀片集中了扩张压,克服了狭窄血管抵抗;其次,刀片切入病变内膜减弱了血管伸展和损伤,防止中层SMC增生,降低再狭窄率,切割球囊刀片破坏的血管内膜可被药物涂层支架或药物球囊附壁药物的吸收[44]。与PTCA相比,切割球囊对血管壁的损伤较小,血管被动扩张小,术后再狭窄率降低。再狭窄切割球囊评估试验(restenosis cutting balloon evaluation trail,RESUCT)显示,与单纯球囊扩张术相比,切割球囊血管成形术未表现出再狭窄及中晚期临床事件发生率的降低,同时表明,切割球囊血管成形术使用的球囊更少,重要的额外支架更少,同时球囊滑脱率较低(6.5%比25.0%)。但切割球囊存在穿孔和刀片嵌顿的风险,因此不适用中重度、严重成角的偏心钙化病变。
3.2.3 棘突球囊
与切割球囊相似,棘突球囊内有3根尼龙元件组成的应力集中,有助于使钙化斑块形成裂隙,达到破坏钙化连续性的目的。棘突球囊的优势在于良好的形变能力及较小的直径,可到达切割球囊无法通过的钙化病变部位[45]。Soga等[46]研究表明,棘突球囊只需更低的充气压力即可达到扩张钙化病变的目的。虽然棘突球囊在通过性方面得到了改善,但其破坏钙化病变连续性方面较切割球囊差一些。
3.2.4 冠状动脉斑块旋切术(coronary atherectomy,CA)
CA包括RA和激光动脉切除术(laser atherectomy,LA),该技术首先用减压装置获取狭窄组织,再用扩张球囊再灌注。对顽固ISR的病人、因斑块质硬导致支架膨胀严重不全或CTO病人,CA可能有较好的临床疗效。有研究显示,因支架扩张严重不足出现顽固性ISR的病人,RA可能是最后选择[47]。质软的病变如新生内膜或血栓等均不适宜使用CA治疗。
3.2.5 DCB
采用治疗DCB的目的是将抗增殖药物输送到ISR区域,不留有额外的支架支柱层。一项研究将第2代依维莫司洗脱支架与DCB血管成形术治疗DES-ISR进行了比较,血管造影和临床结果均支持第2代DES而不是DCB[48]。若无明确的重复支架置入禁忌证,DES策略可能是首选方案。
在DES-ISR病人治疗中,DCB是否与第2代DES重复支架术效果相当,仍存在争议。一项比较第2代依维莫司DES与DCB治疗DES-ISR的随机试验结果显示,6~9个月随访中,第2代DES的血管造影和临床结果均优于DCB[48]。
3.2.6 生物可吸收血管支架(bioresorbable vascular scaffolds,BVS)
BVS的出现是完美代替DCB的产物,可较好地解决DCB回撤球囊之后血管管腔损失的问题。BVS与传统的DES结构不同,BVS生物可吸收性避免了支架支柱附加层的永久沉积,可能降低ISR的风险。一项随机试验中验证了BVS安全性,随访1年的临床结果显示,目标病变的血运重建率约为12%,与重复DES概率相当,且所有病人均避免了永久性第2层支架支柱沉积[49]。目前缺乏BVS在ISR治疗中有效性的比较研究。
3.3 置入异物治疗策略
3.3.1 BMS
冠心病的治疗中首先应用了BMS,较好地解决了PTCA带来的管腔面积迅速减小的并发症。因此,可将BMS应用于ISR的治疗。BMS虽然解决了当时狭窄问题,但两层支架相互重叠,引起管腔面积绝对减小,即“洋葱皮效应”。一项大型随机对照试验将PTCA与BMS重复置入进行了比较,BMS组即时血管造影结果较好,PTCA血管面积丢失较少,在6个月随访中,BMS组晚期管腔丢失导致两组最终CAG显示剩余管腔面积相似。虽然未发现BMS相较于PTCA的优势,但其为今后DES应用于ISR的治疗提供了参考。
3.3.2 DES
因DES对新生内膜增殖具有显著的抑制作用,已成为治疗ISR的优选[50]。第2代DES(依维莫司洗脱支架)相较于第1代(西罗莫司洗脱支架和紫杉醇洗脱支架),DES改善了支架相容性、辐射透明度和径向强度,支架支柱更薄,抗增殖作用更强,从而降低炎症反应,且第2代DES较第1代DES及BMS支架具有更薄的支板/聚合物,因此,可较好地预防需要重复置入支架的病人发生ISR。多次使用支架导致血管腔绝对减小,可能引起耐药,更易导致ISR,顽固ISR病人的最佳治疗方案仍需进一步研究。
3.4 各种治疗手段的对比
Siontis等[51]分析了单独使用PTCA、BMS、DES和DCB治疗ISR的方式,终点包括TLR、心肌梗死或死亡,依维莫司-DES重复支架置入优于所有其他方式;DCB可能是第2种优选的治疗方法,其疗效与西罗莫司或紫杉醇洗脱支架比较无显著差异。因此,DCB和DES均优于其他治疗方式,首选DES治疗ISR。
4 小结与展望
ISR是PCI术后主要的并发症,也是一项临床挑战,对病人不良心血管事件的发生有较大的影响。临床治疗ISR的选择性多,建议借助新技术进一步明确ISR的发生机制,以此为依据对病人进行个体化治疗,以最大限度地提高疗效,改善预后。

