产果胶酶菌株的分离鉴定及其产酶条件优化
彭洁英,黄琳茹,方坚濠,李昆太*
(1.广东海洋大学 食品科技学院,广东 湛江 524088;2.广东省水产品加工与安全重点实验室,广东 湛江 524088;3.广东省海洋食品工程技术研发中心,广东 湛江 524088)
果胶酶是指能够分解高等植物细胞壁的重要组成部分,果胶类物质中半乳糖醛酸长链残基的糖苷键的一类酶的总称,主要包括原果胶酶、果胶酯酶、多聚半乳糖醛酸酶和果胶裂解酶四大类,属于复合酶,广泛分布于高等植物和微生物中,是全球四大工业酶制剂之一[1]。研究表明,优良的果胶酶产生菌主要为细菌和真菌[2]。AHLAWAT S等[3]使用枯草芽孢杆菌(Bacillus subtilis)生产果胶酶,其所产酶展现出广泛的pH适应性和热稳定性,为高温和极端pH下的果胶处理工艺提供了酶学基础。KHATRI B P等[4]分离出一株能够产生碱性果胶酶的黑曲霉(Aspergillus oryzae)菌株,能应用于植物纤维脱胶、废水处理等过程。池彬彬等[5]从盐井土壤样品中分离得到一株产果胶酶的中度嗜盐菌,解决了果胶酶在高浓度盐溶液下酶活性较低的缺陷。除对产果胶酶菌进行分离鉴定以外,众多学者对产果胶酶菌的最佳发酵条件进行了研究[6-8],KASHYAP D R等[7]从农场的土壤中分离出产果胶酶菌株,通过响应面法优化了其发酵产酶条件,即在含有果胶10 g/L和K2HPO40.8 g/L的培养基中,28 ℃下发酵3 d后的最高酶活力为14.16 U/mL,约是优化前的12倍。
果胶酶是重要的商用酶之一,在食品工业和纺织行业占有重要地位。以食品工业为例,微生物果胶酶占全球食品酶销售总额的25%,年销售达到100多万t[9-11]。其在果蔬汁的澄清[12]、果蔬出汁率的提高[13]、改善果酒品质[14]、提取天然产物[15]、提取油脂[16]、生产果胶低聚糖[17]以及咖啡和茶叶加工[18]等方面都有应用。由于果胶酶在食品工业中应用广泛,使得人们对于果胶酶的来源研究也越来越深入。果胶酶可以从微生物或植物中分离获得,植物中的果胶酶产量较低、提取成本高且提纯方法繁琐,不利于进行大规模生产。所以目前果胶酶的生产主要依靠微生物代谢产生,其中黑曲霉(Aspergillus niger)是工业生产上较为常见的产果胶酶菌株,但其果胶酶的产量与酶活性仍然不能满足市场发展的需求[19]。因此,亟需选育新的高产果胶酶菌株,更好地满足市场发展与工业生产的需求。此外,对筛选的果胶酶产生菌进行发酵工艺优化也是提高其产酶经济效益的一个重要方式[20],响应面法可以在几次试验中确定几个变量之间的相互作用,并在尽可能短的时间内获得最佳结果[21-22]。
菠萝富含果胶且易分泌果胶胶液,本研究拟从菠萝种植地靶向分离筛选产果胶酶的微生物菌种,并通过单因素试验和响应面法对其产酶发酵培养基和产酶条件进行优化,以提高菌株产果胶酶的能力,为该菌的工业化应用提供源头资源和研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 土样来源
土样采自广东省湛江市徐闻县曲界镇菠萝种植地。
1.1.2 试剂
果胶、D+(-)半乳糖醛酸:上海麦克林生化科技有限公司;磷酸氢二钾、磷酸二氢钾、七水硫酸镁、七水硫酸亚铁、刚果红、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、柠檬酸、酒石酸钾钠、苯酚、磷酸氢二钠、氯化锌、氯化铜、氯化锰、六水合氯化钴:上海麦克林生化科技有限公司;革兰氏染液、微生物检测配套试剂、氯化铵、技术琼脂粉、酵母浸膏:广东环凯微生物科技有限公司。以上试剂均为分析纯或生化试剂。
1.1.3 培养基
分离培养基:果胶3.0 g/L,NH4C1 0.4 g/L,MgSO4·7H2O 2 g/L,K2HPO41 g/L,FeSO4·7H2O 0.01 g/L,琼脂20 g/L,pH 7.0~7.2,121 ℃灭菌30 min。
LB固体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.4,琼脂粉15 g/L,121 ℃高压蒸汽灭菌20 min。LB液体培养基中不添加琼脂。
复筛培养基:果胶20 g/L,MgSO4·7H2O 2 g/L,K2HPO41 g/L,FeSO4·7H2O 0.01 g/L,121 ℃灭菌30 min。
初始发酵培养基:果胶30 g/L,蛋白胨20 g/L,K2HPO41 g/L,MgSO4·7H2O 2 g/L,FeSO4·7H2O 0.01 g/L,121 ℃灭菌30 min。
1.2 仪器与设备
HZQ-F160振荡培养箱:哈尔滨市东联电子技术开发有限公司;DM500生物显微镜:上海Leica显微系统有限公司;UV-5800PC紫外可见分光光度计:上海元析仪器有限公司;BPMJ-150F生化培养箱:上海一恒科学仪器有限公司;YXQ-LS-70A立式压力蒸汽灭菌锅:宁波久兴医疗器械有限公司;3K-15 SIGMR台式高速冷冻离心机:扬州离心机有限公司;SSW-420-2S电热恒温水槽:上海博远实业有限公司医疗设备厂。
1.3 试验方法
1.3.1 产果胶酶微生物的分离
称取土壤样品10 g加入到盛有90 mL无菌水且带有玻璃珠的200 mL锥形瓶中,将土样充分打散、混匀,即成10-1泥浆稀释液,然后再按10倍稀释法依次稀释到10-2、10-3、10-4、10-5等梯度。吸取10-3、10-4、10-5梯度稀释液各200 μL分别涂布至分离培养基平板上,放入30℃培养箱中培养约2~3d。分离出能在以果胶为唯一碳源的固体培养基上生长的微生物。
1.3.2 产果胶酶菌株的初筛
将步骤1.3.1分离得到的菌株接种到分离培养基上,待菌落明显长出后,将平板倒浸于刚果红溶液(5 mg/mL水溶液)中静置15 min。取出平板倒去刚果红溶液,用氯化钠溶液(1 mol/L)重新覆盖平板表面,静置15 min,观测菌落旁有无明显水解圈的出现。挑取平板上水解圈较大的菌落平板划线于LB固体培养基上,反复纯化直至得到纯培养物后转接至LB斜面培养24 h,置于4 ℃冰箱短时间保存备用。
1.3.3 产果胶酶菌株的复筛
将初筛菌株的新鲜斜面以10 mL无菌水洗下菌体,打散均匀后取1 mL菌悬液接种于装有50 mL LB液体培养基的250 mL锥形瓶中,置于恒温振荡培养箱中160 r/min、30 ℃振荡培养16 h,获得种子液。将种子液以5%(V/V)的接种量接种于装液量为40 mL/250 mL三角瓶的初始发酵培养基中,30 ℃、160 r/min恒温振荡培养24 h。所得发酵液装入50 mL离心管中,于4 ℃、3 000 r/min离心5 min,收集上清液并使用DNS法测定果胶酶的酶活力,复筛出所产果胶酶酶活力高的菌株。
1.3.4 果胶酶酶活力的测定
果胶酶酶活力的测定方法参照谷艺明[23]的方法并稍加改进。吸取0.8 mL果胶溶液加入50 mL的比色管中,50 ℃水浴加热5 min,加入0.2 mL的稀释粗酶液,50 ℃水浴30 min,加入3 mL的DNS试剂,沸水浴10 min,流水冷却,用蒸馏水定容至25 mL,混合均匀,10 000 r/min离心10 min,以灭活的粗酶液为对照,用分光光度计在波长540 nm处测溶液的OD540nm值。根据半乳糖醛酸标准曲线测定果胶酶酶活力。酶活力定义:在50 ℃的条件下,每1 min水解果胶产生1 μg半乳糖醛酸为一个酶活力单位,计算公式如下[23]:
式中:UI表示果胶酶酶活力,U/mL;N表示粗酶液稀释倍数;A1表示粗酶液在波长540 nm处的吸光度值(OD540nm值);1 000表示mg与μg的换算系数;A2表示灭活的粗酶液在波长540 nm处的吸光度值(OD540nm值);0.2表示粗酶液添加量,mL;K表示半乳糖醛酸标准曲线斜率;t表示反应时间,min。
1.3.5 产果胶酶菌株的鉴定(1)形态观察
将分离筛选得到的菌株划线于LB平板,30 ℃培养24 h,观察并记录单菌落的颜色、形状、透明度、大小、表面隆起和菌落培养基的颜色等。利用扫描电子显微镜[24],对所筛菌株的微观形态和大小进行分析观察。
(2)生理生化鉴定
菌株的生理生化试验参照《伯杰氏细菌鉴定手册》(第8版)和《常见细菌系统鉴定手册》中菌种鉴定方法对菌株的部分生理生化进行鉴定[25-26]。
(3)分子生物学鉴定
参考杨逸飞等[27]的方法,将纯化后的菌种送至上海生工生物工程有限有限公司进行测序,采用细菌通用引物7F(5'-CAGAGTTTGATCCTGGCT-3')和1540R(5'-AGGAGGTGATCCAGCCGCA-3')聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rRNA。PCR扩增体系(25 μL):10×PCR Buffer 2.5 μL(含Mg2+),脱氧核糖核苷三磷酸(dNTP)各2.5 mmol/L,TaqPlus脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(5 U/μL)0.2 μL,引物7F(10 μmol/L)和1540R(10 μmol/L)各0.5 μL,模板(基因组DNA 20~50 ng/μL)0.5 μL。PCR扩增程序:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。对扩增的产物进行测序。将测序结果提交至美国国家生物技术信息中心(national center or biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,在比对结果中下载同源性较高的序列,采用邻位相连法将目的菌种的16S rDNA与下载的序列一起构建进化树,利用Bootstrap自举法检测序列1 000次后建立系统进化树。
1.3.6 产果胶酶发酵条件优化单因素试验
设置初始发酵条件:蔗糖30 g/L,蛋白胨20 g/L,K2HPO41 g/L,MgSO4·7H2O 2 g/L,FeSO4·7H2O 0.01 g/L,pH 7.0,发酵温度30 ℃;装液量40 mL/250 mL,接种量5%(V/V),发酵时间24 h。
考察碳源(葡萄糖、蔗糖、麦芽糖、果胶、可溶性淀粉、玉米浆干粉)、最佳碳源添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)、有机氮源(牛肉膏、蛋白胨、酵母浸膏、黄豆饼粉)、最佳氮源添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)、微量元素(Zn2+、Cu2+、Mn2+、Co2+)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、37 ℃)以及pH(3、5、7、9、11、13)对菌株产果胶酶的影响。
1.3.7 响应面法优化
根据上述单因素试验的结果,利用Design-Expert V12.0.3.0软件设计3因素3水平的响应面试验,探究筛选菌株产果胶酶的最优产酶条件,响应面试验因素与水平见表1。

表1 产酶条件优化响应面试验因素及水平Table 1 Factors and levels of response surface experiments for enzyme production conditions optimization
1.3.8 数据分析
使用Excel 2016进行数据统计,使用Origin 2022对数据进行作图分析,使用Design-Expert V12.0.3.0软件设计响应面试验。
2 结果与分析
2.1 产果胶酶微生物的初筛
果胶经果胶酶分解后,其多糖水解物可与刚果红染料形成有红色透明圈的复合物,由此可判别菌株是否具有产果胶酶的能力[28]。经过以果胶为唯一碳源的分离培养基的筛选分离,从采集的土样中一共初筛到9株能够产生水解圈的菌株,并分别命名为XW-1、XW-7、XW-12、XW-14、XW-15、XW-18、XW-19、XW-20、XW-23。代表菌株XW-18的水解圈见图1。

图1 菌株XW-18降解果胶所产的水解圈Fig.1 Hydrolysis circle of strain XW-18 by degrading pectin
2.2 产果胶酶微生物的复筛
初筛获得的9株微生物经发酵后,利用DNS法测定其所产的果胶酶酶活,结果见图2。由图2可知,果胶酶活力>200 U/mL的菌株有XW-1、XW-7、XW-14、XW-15、XW-18、XW-20。其中菌株XW-18所产果胶酶酶活最高,达到(306.22±0.59)U/mL,因此将菌株XW-18作为进一步研究对象。

图2 筛选菌株的酶活力测定结果Fig.2 Determination results of enzyme activity of re-screening strains
2.3 菌株XW-18的鉴定
2.3.1 形态观察结果
将菌株XW-18点接于LB固体培养基上,观察其菌落形态特征,结果见图3。由图3可知,该菌单菌落为椭圆状突起,呈现明显的细菌菌落特征。菌落生长初期为乳白色,表面湿润,有黏性,培养时间稍长后,菌落表面变干燥,有褶皱。扫描电子显微镜观察结果显示,菌株呈短杆状,周生鞭毛。

图3 菌株XW-18的菌落形态(a)及细胞形态(b)Fig.3 Colony morphology(a)and cell morphology(b)of strain XW-18
2.3.2 生理生化试验结果
菌株的生理生化试验结果见表2。由表2可知,菌株XW-18的葡萄糖、蔗糖、淀粉、果糖、木糖、麦芽糖、半乳糖、阿拉伯糖、甘露醇发酵结果以及吲哚、2-硝基苯基-β-D-吡喃半乳糖苷(2-nitrophenyl-β-D-galactoside,ONPG)、M.R.、H2S、脂肪酶、淀粉酶、明胶液化试验结果均为阳性;V.P.、几丁质酶、脲酶试验结果均为阴性。通过对菌株的形态观察、生理生化检测结果和检索《伯杰式细菌鉴定手册》,菌株XW-18与芽孢杆菌生理生化特征较吻合。因此,初步判定菌株XW-18属于芽孢杆菌属(Bacillussp.)。

表2 菌株XW-18的生理生化特性Table 2 Physiological and biochemical characteristics of strain XW-18
2.3.3 分子生物学鉴定
菌株XW-18的16S rDNA基因序列总长为1 481 bp(GenBank登录号:OP430540),通过在NCBI的GenBank数据库中进行BLAST序列比对分析,结果表明,该菌株与枯草芽孢杆菌亲源性最近,同源性达到99%。利用MEGA7.0.26软件构建菌株XW-18的系统发育树,结果见图4。由图4可知,菌株XW-18与枯草芽孢杆菌(Bacillus subtilissubsp.subtilis)168的遗传距离最近,结合该菌株的形态特征,将菌株XW-18鉴定为枯草芽孢杆菌(Bacillus subtilis)。

图4 基于16S rRNA基因序列菌株XW-18的系统发育树Fig.4 Phylogenetic tree of strain XW-18 based on 16S rRNA gene sequence
2.4 枯草芽孢杆菌XW-18产果胶酶条件优化
2.4.1 碳源及其添加量对菌株的影响
碳源在微生物的培养过程中起着非常重要的作用,为微生物正常生长发育提供了物质基础。不同的碳源对菌株的生长和产酶能力都会产生影响。在发酵培养基中分别加入30 g/L不同的碳源,探究碳源对枯草芽孢杆菌XW-18菌体生长和产果胶酶的影响,结果见图5。由图5可知,当选择蔗糖为碳源时,所产酶果胶酶活力最高,达到(970.78±7.37)U/mL。而以玉米浆干粉作为碳源时,果胶酶活力最低。此外,以可溶性淀粉作为碳源时,菌体量最高,说明以可溶性淀粉作为碳源有利于菌株的生长,但是会抑制菌株的产酶能力,降低菌株的产酶活性。而以蔗糖为碳源时,不仅能促进菌株生长,还能提高菌株的产酶活性,因此选择蔗糖作为枯草芽孢杆菌XW-18发酵产酶的碳源。

图5 不同碳源对菌株XW-18生长量和产果胶酶活性的影响Fig.5 Effect of different carbon sources on growth and pectinaseproducing activity of strain XW-18
不同蔗糖添加量对菌株生长和产酶活性的影响见图6。由图6可知,随着蔗糖添加量的增加,菌株所产果胶酶的活性逐渐升高,在蔗糖添加量为40 g/L时果胶酶酶活达到最高值,为(1 702.43±13.14)U/mL。因此最适蔗糖添加量为40 g/L。
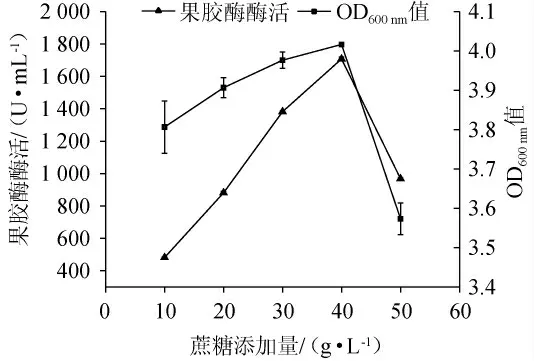
图6 蔗糖添加量对菌株XW-18生长量和产果胶酶活性的影响Fig.6 Effect of sucrose addition on growth and pectinase-producing activity of strain XW-18
2.4.2 氮源及其添加量对菌株的影响
氮源作为营养物质广泛参与到微生物的生长代谢、次生代谢产物合成中,其种类与用量会对微生物发酵过程产生重要影响[29]。在最优碳源以及其添加量的基础下,探究氮源种类及最佳氮源添加量对枯草芽孢杆菌XW-18菌体生长量和产果胶酶能力的影响,结果见图7和图8。
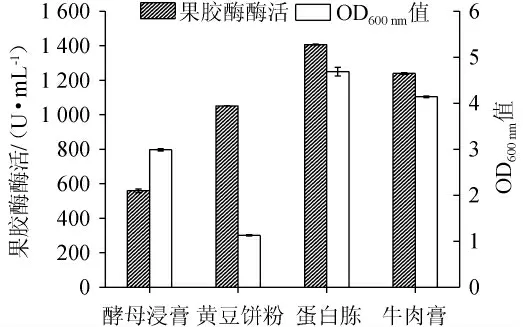
图7 不同氮源对菌株XW-18生长量和产果胶酶活性的影响Fig.7 Effect of different nitrogen sources on growth and pectinase-producing activity of strain XW-18
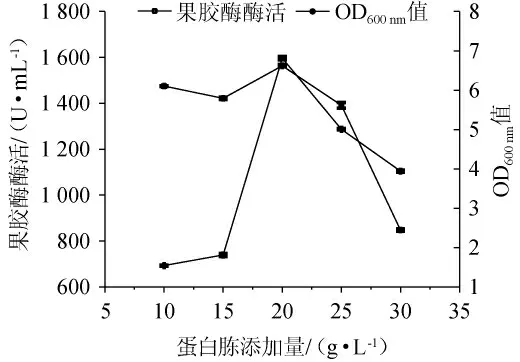
图8 蛋白胨添加量对菌株XW-18生长量和产果胶酶活性的影响Fig.8 Effect of peptone addition on growth and pectinase-producing activity of strain XW-18
由图7可知,当发酵氮源为蛋白胨时,菌体生长量(OD600nm值=4.69±0.09)及所产的果胶酶酶活[(1 406.77±2.36)U/mL]均为最高,因此选择蛋白胨作为枯草芽孢杆菌XW-18发酵产果胶酶的氮源。由图8可知,随着蛋白胨添加量的增加,菌株的菌体量和果胶酶酶活也随着提高。当蛋白胨添加量为20 g/L时,枯草芽孢杆菌XW-18的菌体量(OD600nm值=6.81±0.04)和产酶活性[(1 563.35±4.96)U/mL]达到最高。随后增加蛋白胨的含量,酶活跟生长量均下降,这可能是蛋白胨含量过高,使得发酵培养基中C/N比例不适于菌株生长及产酶,导致菌体含量和酶活都降低。因此最佳蛋白胨添加量为20 g/L。
2.4.3 微量金属元素对菌株的影响
在最佳碳源、氮源以及其添加量的基础上,考察了1 mmol/L Zn2+、Cu2+、Mn2+、Co2+微量金属元素的加入对枯草芽孢杆菌XW-18菌体生长量和产果胶酶能力的影响,结果见图9。由图9可知,Mn2+能够有效促进菌体生长,但会抑制菌株的产酶活性,而Zn2+和Co2+会抑制菌株的生长,但Co2+能够稍微促进菌株产果胶酶。此外,Cu2+对菌体生长和菌株产酶活性均产生严重的抑制作用。尤其是Zn2+和Co2+添加下的菌体量受到明显抑制,但是果胶酶酶活却未出现明显下降。因此,选择不添加微量金属元素进行发酵培养。

图9 不同微量金属元素对菌株XW-18生长量和产果胶酶活性的影响Fig.9 Effect of different trace metal elements on growth and pectinase-producing activity of strain XW-18
2.4.4 发酵温度对菌株的影响
不同发酵温度对菌株XW-18菌体生物量及产果胶酶活性的影响见图10。由图10可知,随着温度的升高,菌株的生物量及产果胶酶活力均呈现先升高后降低的趋势,当培养温度为30 ℃时,枯草芽孢杆菌XW-18的菌体量(OD600nm值=5.59±0.03)和产酶最高,果胶酶酶活力达到(1 332.06±3.64)U/mL。当培养温度高于30 ℃后,菌株的产酶活力开始下降。培养温度是影响微生物代谢的关键因素之一,有研究表明果胶酶产生菌发酵温度过高或过低都不利于菌株生长,进而影响果胶酶的产生和释放[13]。因此,选择30 ℃作为枯草芽孢杆菌XW-18发酵产果胶酶的最适温度。
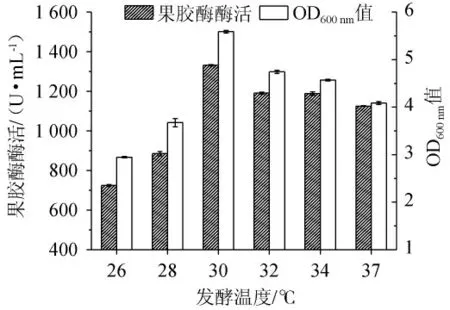
图10 不同发酵温度对菌株XW-18生长量和产果胶酶活性的影响Fig.10 Effect of different fermentation temperature on growth and pectinase-producing activity of strain XW-18
2.4.5 初始pH值对菌株的影响
探究了培养基初始pH值对枯草芽孢杆菌XW-18菌体生长和产果胶酶能力的影响,结果见图11。由图11可知,随着初始pH值的不断升高,菌株的产酶活力先升高后下降,当pH值为7时,菌株产酶能力最高,酶活力达到(1 556.19±2.75)U/mL,说明菌株产果胶酶的最佳初始pH值为7。此外,该菌株在初始pH 5~11之间生长良好,其中,当初始pH为9时,菌体生物量最大,OD600nm值为5.51±0.01,但在初始pH为9时的果胶酶酶活[(1 030.84±4.96)U/mL]要远低于初始pH为7时的果胶酶酶活[(1 556.19±2.75)U/mL]。而两者的菌体生物量相差不大(pH 7时的OD600nm值为5.41±0.01)。因此,菌株生长发酵产酶的最佳初始pH为7。值得注意的是,除了在最适初始pH下,枯草芽孢杆菌XW-18在初始pH值范围为3.0~13.0之间均具有产酶活力,说明该菌株的生长和产果胶酶均展现出了广泛的pH适应性。
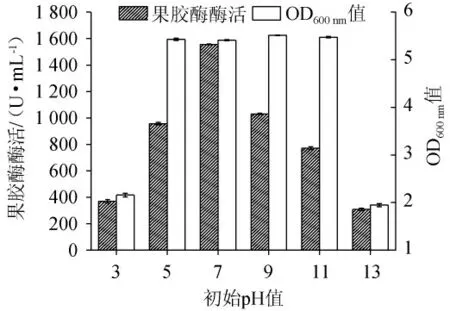
图11 不同初始pH对菌株XW-18生长量和产果胶酶活性的影响Fig.11 Effect of different initial pH on growth and pectinaseproducing activity of strain XW-18
2.5 响应面试验设计及结果
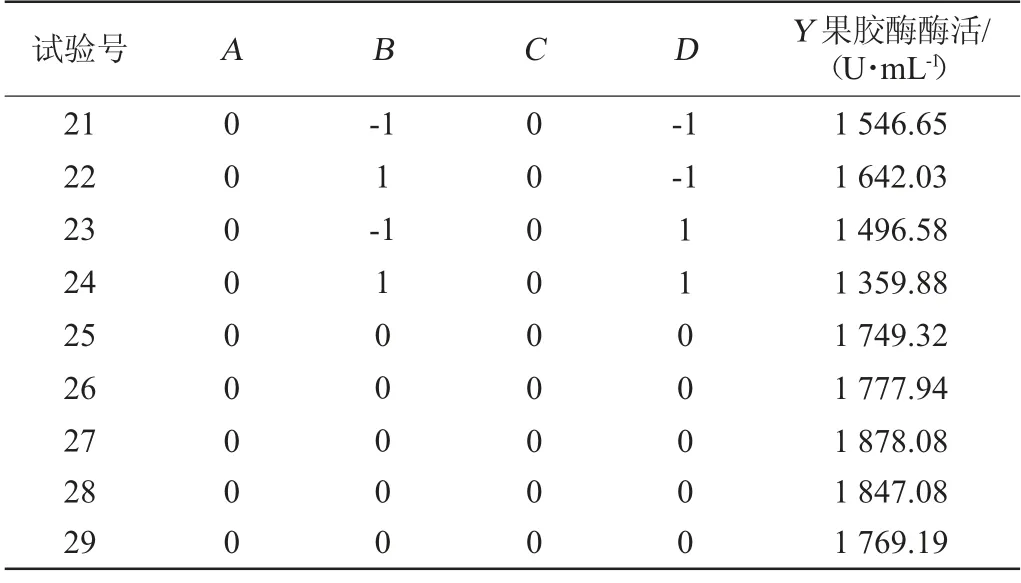
根据上述单因素试验的结果,以蔗糖添加量(A)、蛋白胨添加量(B)、发酵温度(C)、初始pH值(D)为评价因素,果胶酶酶活力(Y)作为考察指标,用Design-Expert V12.0.3.0软件设计4因素3水平的响应面试验,响应面试验设计及结果见表3,方差分析结果见表4。

表3 菌株XW-18产酶条件优化响应面试验设计及结果Table 3 Design and results of response surface experiments for enzyme production conditions optimization of strain XW-18
续表

表4 回归模型方差分析Table 4 Variance analysis of regression model
利用Design-Expert V12.0.3.0软件对试验数据进行分析,得到以酶活性为响应值的回归方程为:Y=1 804.32+128.29A+18.84B-21.53C-113.19D+6.76AB+13.91AC+111.47AD-47.09BC-58.02BD-7.55CD-253.72A2-187.75B2-79.66C2-134.10D2。
由表4可知,回归方程的决定系数R2=0.855 5,表明其拟合度较好;而变异系数(coefficient of variation,CV)=7.20%表明试验的重复性较高;模型的P值=0.001 0<0.05,说明对结果影响极显著;而失拟项的P值=0.063>0.05,说明失拟项不显著。发酵条件的4个因素对酶活性的影响大小为A>D>C>B,其中因素A和D对结果影响极显著(P<0.01),说明蔗糖添加量及培养基初始pH会对枯草芽孢杆菌XW-18产果胶酶产生极显著的影响,此外,二次项A2、B2、D2对结果影响也极显著(P<0.01),其余因素影响不显著(P>0.05)。利用Design-Expert V12.0.3.0软件对蔗糖添加量、蛋白胨添加量、发酵温度以及初始pH这4个因素之间的交互作用进行了响应面图绘制,结果见图12。

图12 各因素间交互作用对果胶酶活性影响的响应面和等高线Fig.12 Response surface plots and contour lines of effect of interaction between each factors on pectinase activities
由图12可知,蛋白胨添加量与蔗糖添加量之间所形成的交互作用最弱,而初始pH与蔗糖添加量所形成的交互作用最强。结合方差分析可知各因素交互作用大小为AD>BD>BC>AC>CD>AB。综合响应面结果,得出枯草芽孢杆菌XW-18产果胶酶的最优发酵条件为:蔗糖添加量41.69 g/L,蛋白胨添加量20.64 g/L,发酵温度29.72 ℃,初始pH 6.25,此方程预测的最大酶活可达1 839.07 U/mL。为了操作方便,修正发酵参数为:蔗糖添加量40 g/L,蛋白胨添加量20 g/L,发酵温度30 ℃,初始pH 7.0。在此优化条件下进行3次重复性试验,其果胶酶酶活力为(1 804.32±55.28)U/mL,结果与预测值基本符合,表示该模型与实际情况基本吻合,拟合良好。
3 结论
本研究从广东省湛江市徐闻县曲界镇菠萝种植地里的土壤中分离到一株产果胶酶的菌株XW-18,经鉴定为枯草芽孢杆菌(Bacillus subtilis),同时对其发酵产酶工艺进行了优化,得到该菌最佳产果胶酶发酵条件为:蔗糖添加量40 g/L,蛋白胨添加量20 g/L,发酵温度30 ℃,培养基初始pH 7.0,在此条件下,果胶酶酶活力提高到(1 804.32±55.28)U/mL。可见,本研究不仅丰富了产果胶酶的微生物种质资源,而且通过发酵工艺优化使其产酶得到大幅提高,为后续的工业应用提供了基础。

