一测多评法同时测定连翘叶红茶中5种指标成分的含量
杨莹莹
(山西省药品审评中心(山西省医药与生命科学研究院),山西 太原 030006)
连翘叶为木犀科植物连翘(Forsythia suspense(Thunb.)Vahl)的干燥叶,具有清热解毒之功效[1]。我国连翘叶资源丰富,在我国河北、山西、河南等地连翘叶历来有作为保健茶饮用的传统,具有良好的开发前景。现代药理学研究表明,连翘叶具有抑菌[2-3]、抗氧化[4-6]、抗肿瘤[7]、护肝[8]、降血脂[9]、降血糖[10]等多种生物活性,含有木质素类、黄酮、三萜类等活性成分,其中连翘苷、连翘酯苷A、芦丁、连翘脂素和槲皮素含量较高[11]。同时还富含蛋白质、氨基酸、膳食纤维、维生素及矿物质等多种营养成分[12-13]。
2018年连翘叶被批准作为山西省特色地方食品管理,为连翘叶作为食品开发奠定了基础。因此,近年来连翘叶茶成为众多研究学者的研究对象。原江锋等[14]将一芽二叶至一芽三叶的连翘嫩叶加工成连翘叶绿茶,并对连翘叶绿茶的活性成分进行分析,结果表明,连翘叶绿茶具有较强的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力。尤颖[15]以阴干的连翘叶、炒制杀青的连翘叶和杀青发酵的连翘叶作为原料,制备出三种连翘叶速溶茶,通过单因素和响应面试验优化了连翘叶速溶茶水提工艺。结果表明,杀青发酵的连翘叶制备速溶茶的感官评价得分最高。杨丽霞等[16-17]以连翘叶为主要原料,研制了连翘叶绿茶和连翘叶复合袋泡茶两种产品。
目前,关于连翘叶茶的质量控制研究相对较少,且多以1种或2种指标成分进行含量测定[18-19],无法客观反映产品的内在质量。在对照品难以获得、价格昂贵的前提下,多指标含量质量控制模式的发展在一定程度上受到了限制。本研究以连翘叶红茶为研究对象,建立一测多评法[20-23](quantitative analysis of multi-components by single marker,QAMS)测定连翘叶红茶中的芦丁、连翘酯苷A、槲皮素、连翘苷和连翘脂素5种指标成分含量,并进行方法学考察。采用高效液相色谱(high performance liquid chromatography,HPLC)法,以连翘苷作为内参物,建立其与芦丁、连翘酯苷A、槲皮素和连翘脂素的相对校正因子。利用一测多评法(QAMS)和外标法(external standard method,ESM)同时测定5种指标成分含量,并比较这2种方法检测结果的差异,探索QAMS法在连翘叶红茶质量评价中的可行性,为连翘叶红茶的多指标质量控制提供参考。
1 材料与方法
1.1 试剂与材料
1.1.1 材料
连翘叶红茶样品(产地为山西省长治市):由山西盘秀山农业科技开发有限公司提供。样品共10批,批号分别为①20200412、②20200413、③20200415、④20210411、⑤20210413、⑥20210416、⑦20220413、⑧20220415、⑨20220418、⑩20220420。
1.1.2 化学试剂
芦丁对照品、槲皮素对照品、连翘苷对照品(纯度均≥98%):中国食品药品检定研究院;连翘酯苷A对照品(纯度≥98%)、连翘脂素对照品(纯度≥98%):成都麦德生科技有限公司。乙腈(色谱纯):德国CNW科技公司;甲醇、乙醇、磷酸(均为分析纯):天津市凯通化学试剂有限公司;水为实验室自制超纯水。
1.2 仪器与设备
LC-2010A型高效液相色谱(HPLC)仪:日本岛津公司;1260型高效液相色谱仪、ZORBAX SB-C18色谱柱(5 μm,4.6 mm×250 mm):美国安捷伦公司;HH-6型数显恒温水浴锅:常州国华电器有限公司;AR124CN型分析天平:奥豪斯仪器(常州)有限公司;Thermoscientific HyPURITY C18色谱柱(250 mm×4.6 mm,5 μm):美国Thermo Scientific公司;Athena C18-WP色谱柱(250 mm×4.6 mm,5 μm):上海安谱实验科技股份有限公司;UPHW-I-90T型优普系列超纯水系统:成都超纯科技有限公司。
1.3 方法
1.3.1 混合对照品溶液的制备
精密称取芦丁、连翘苷、槲皮素、连翘酯苷A和连翘脂素对照品适量,置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,制得质量浓度分别为芦丁101 μg/mL、连翘苷402 μg/mL、槲皮素102 μg/mL、连翘酯苷A 403 μg/mL和连翘脂素99 μg/mL的混合对照品溶液,备用。
1.3.2 样品溶液的制备
本研究结合连翘叶茶的日常饮用习惯,采用水为溶剂,以加热回流的方式进行提取。提取条件考察了提取时间、提取温度和提取次数。由于本方法为检测方法,样品制备方法要求操作简便、重复性好、稳定可靠,因此综合考虑方法的可操作性、系统误差、时间成本等多种因素,最终确定提取时间为1 h、提取温度为95 ℃、提取次数为1次。
精密称取连翘叶红茶粉末5.0 g,置于200 mL具塞锥形瓶中,加入50 mL蒸馏水,95 ℃恒温水浴加热回流1h,取出放凉,称定质量,用蒸馏水补足质量损失,过滤,得连翘叶红茶提取液。精密量取上述提取液1 mL置于10 mL容量瓶中,加蒸馏水稀释至刻度,过0.22 μm的微孔滤膜,得到样品溶液,备用。
1.3.3 高效液相色谱条件
Thermoscientific HyPURITY C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.1%磷酸溶液(B),梯度洗脱:0~20 min,A相为10%~25%;20~30 min,A相为25%~40%;30~35 min,A相为40%~60%;35~36 min,A相为60%~10%;36~40 min,A相为10%~10%。检测波长277 nm,柱温30 ℃,流速1.0 mL/min,进样量10 μL。
1.3.4 相对校正因子的计算
以连翘苷为内参物,相对校正因子计算公式如下[24]:
式中:fs/i为内参物与其他组分之间的相对校正因子;As为内参物的峰面积;Cs为内参物的质量浓度,μg/mL;Ai为其他组分的峰面积;Ci为其他组分的质量浓度,μg/mL。
1.3.5 样品的测定
精密称取10批连翘叶红茶样品粉末各5.0 g,按照“1.3.2”项下方法制备样品溶液,各平行制备3份,按照“1.3.3”项下色谱条件进行HPLC分析,采用外标法和一测多评法分别计算5种指标成分的含量。
1.3.6 数据处理
采用Excel 2019和SPSS25.0软件对2种方法检测数据进行分析。
2 结果与分析
2.1 混合对照品及样品中5种指标成分高效液相色谱法测定结果
混合对照品及样品中5种指标成分高效液相色谱法测定结果见图1。由图1可知,5种指标成分的色谱峰分离情况良好。

图1 混合标准品(A)及样品(B)中5种指标成分高效液相色谱图Fig.1 High performance liquid chromatography of 5 indexes components in mixed standards (A) and samples (B)
2.2 色谱条件优化
2.2.1 流动相的选择
本研究考察了甲醇-水、乙腈-水、乙腈-0.1%磷酸溶液等不同流动相体系的色谱峰分离情况,结果表明,乙腈-0.1%磷酸溶液体系各色谱峰峰型良好、基线平稳。因此,确定最适流动相为乙腈(A)-0.1%磷酸溶液(B),梯度洗脱。
2.2.2 检测波长的选择
对5种指标成分进行了全波长扫描,根据扫描结果选择各指标成分的最大吸收波长为检测波长。本研究分别考察了254 nm、277 nm、330 nm和365 nm检测波长下的色谱出峰情况。结果显示,5种指标成分在波长277 nm条件下均有较强的紫外吸收。因此,选择检测波长为277 nm。
2.3 方法学考察
2.3.1 标准曲线线性回归方程、相关系数、线性范围、检出限及定量限
取混合对照品溶液适量,稀释成6个不同质量浓度水平的混合对照品溶液,分别置于进样瓶中,按照“1.3.3”项下色谱条件下进样检测,记录峰面积,以质量浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线,得到标准曲线回归方程、相关系数及线性范围。5种指标成分以信噪比(S/N)=3时的质量浓度为检测限,S/N=10时的质量浓度为定量限,结果见表1。
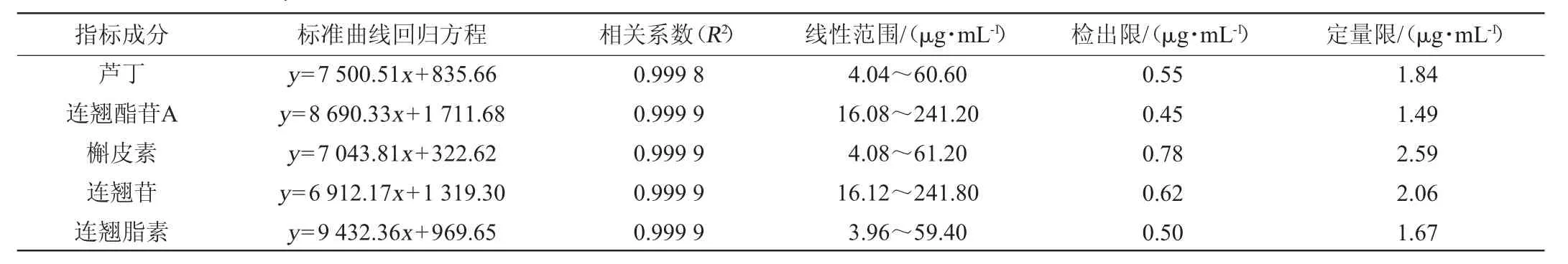
表1 5种指标成分的标准曲线回归方程、相关系数、线性范围、检出限及定量限Table 1 Standard curve regression equations, correlation coefficients, linear range, detection limit and quantitative limit of 5 kinds of index components
由表1可知,5种指标成分的质量浓度和峰面积在各自范围内线性关系良好(相关系数R2均>0.999),其检出限范围为0.45~0.78 μg/mL,定量限范围为1.49~2.59 μg/mL。结果表明,检出限和定量限均能满足5种指标成分的检测分析要求。
2.3.2 精密度试验
取同一批次连翘叶红茶粉末(批号:20220418)5份,按照“1.3.2”项下方法制备样品溶液进样测定,记录峰面积,计算精密度试验结果的相对标准偏差(relative standard deviation,RSD)。结果表明,芦丁、连翘酯苷A、槲皮素、连翘苷和连翘脂素测定结果的RSD分别为2.24%、1.50%、2.06%、1.43%、2.39%,RSD均<3.0%。结果表明,该方法的精密度良好。
2.3.3 加样回收率试验
称取已知5种指标成分含量的连翘叶红茶样品(批号:20220418)约0.10 g,平行制备5份,分别加入适量混合对照品溶液,按“1.3.2”项下方法制备样品溶液进样测定,计算加样回收率,结果见表2。

表2 5种指标成分的加标回收率试验结果(n=5)Table 2 Results of standard recovery rate tests of 5 kinds of index components (n=5)
由表2可知,各成分加样回收率为95.19%~101.77%,平均加样回收率为98.25%~99.63%,RSD为1.34%~2.54%,RSD均<3.0%。结果表明,该方法准确度良好。
2.3.4 稳定性试验
取同一样品溶液(批号:20220418),样品制备后分别在0 h、2 h、4 h、8 h、12 h、24 h进样测定,记录峰面积,计算RSD。结果表明,芦丁、连翘酯苷A、槲皮素、连翘苷和连翘脂素检测结果的RSD分别为2.05%、2.16%、2.53%、1.46%、2.44%,RSD均<3.0%。结果表明,该方法稳定性良好。
2.4 相对校正因子的建立
2.4.1 相对校正因子的计算
以连翘苷作为内参物,根据公式分别计算连翘苷对芦丁、槲皮素、连翘酯苷A和连翘脂素4种指标成分的相对校正因子,结果见表3。
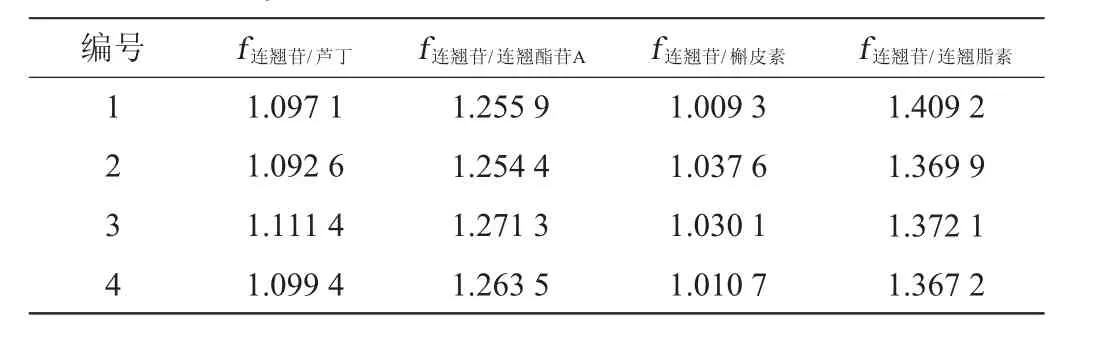
表3 4种指标成分对连翘苷的相对校正因子Table 3 Relative correction factors of 4 kinds of index components to forsythin
由表3可知,各校正因子的RSD均<2.0%。综合比较影响校正因子的各个因素,最终确定取各校正因子的均值,即连翘苷对芦丁、槲皮素、连翘酯苷A和连翘脂素的校正因子分别为1.091 4、1.257 5、1.019 1、1.373 7。
2.4.2 校正因子的耐用性考察
校正因子的耐用性可通过改变不同的色谱参数来考察各因素对校正因子的影响。通常用不同条件下各指标成分校正因子之间的RSD表示。柱温、流速、检测波长等条件的微小变化一般对耐用性影响较小,而不同品牌色谱柱和不同型号高效液相色谱仪对其影响较大,因此本研究选择3种不同色谱柱和2种不同仪器进行校正因子的耐用性考察。
取混合对照品溶液适量,精密吸取10 μL进样测定,分别考察了HyPURITY C18色谱柱(250 mm×4.6 mm,5 μm)、Athena C18-WP色谱柱(250 mm×4.6 mm,5 μm)和ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm)3种不同色谱柱、岛津LC-2010A型液相色谱仪和安捷伦1260型液相色谱仪等2种色谱仪的耐用性,结果见表4。

表4 不同色谱柱和不同仪器条件下4种指标成分对连翘苷的相对校正因子比较Table 4 Comparison of relative correction factors of 4 kinds of index components to forsythin under different chromatographic columns and instruments conditions
由表4可知,4个指标成分对连翘苷的相对校正因子变化较小,RSD均<3.0%,表明不同色谱柱和不同仪器的耐用性良好。
2.5 一测多评法与外标法检测结果比较
取10批连翘叶红茶样品,按“1.3.2”项下方法制备样品溶液,分别吸取10 μL进样测定。利用一测多评法和外标法分别计算连翘叶红茶中芦丁、连翘酯苷A、槲皮素、连翘苷和连翘脂素的含量,结果见表5。由表5可知,2种方法测得含量结果均无显著性差异(P>0.05),表明QAMS法准确度良好,可用于连翘叶红茶的多指标成分检测。
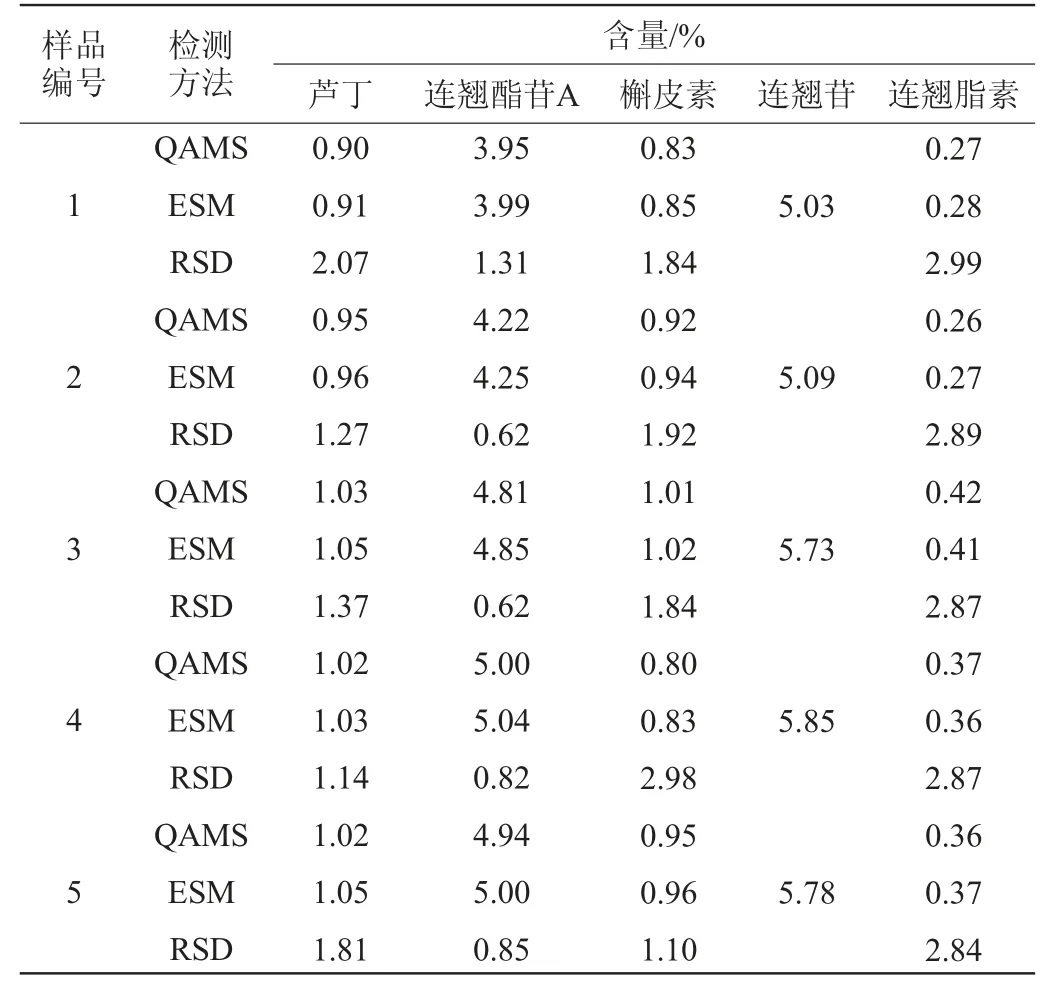
表5 一测多评法和外标法5种指标成分含量测定结果比较(n=3)Table 5 Comparison of determination results of 5 kinds of index components contents by quantitative analysis of multicomponents by single marker and external standard method (n=3)
3 结论
本研究以连翘叶红茶为研究对象,采用高效液相色谱法,以连翘苷为内参物,计算其与芦丁、连翘酯苷A、槲皮素和连翘脂素的相对校正因子,建立一测多评法计算各指标成分的含量,并与外标法的结果进行比较。结果表明,5种指标成分的质量浓度和峰面积在各自范围内线性关系良好,相关系数R2均>0.999,其检出限范围为0.45~0.78 μg/mL,定量限范围为1.49~2.59μg/mL,平均加标回收率在98.25%~99.63%,加标回收率、精密度、稳定性试验结果RSD均<3.0%,表明QAMS法精密度、准确度、稳定性良好。一测多评法(QAMS)和外标法(ESM)测定10批连翘叶红茶中5种指标成分含量结果之间无显著差异(P>0.05),表明一测多评法用于连翘叶红茶的多指标质量控制具有良好的可行性,可为连翘叶红茶的质量控制提供参考。

