胸横肌联合前锯肌平面阻滞对心脏瓣膜置换术患者术后镇痛及心肌保护的影响*
张淑琪,邢 珍
(1.河北北方学院,河北张家口 075000;2.河北北方学院附属第一医院麻醉科,河北张家口 075000)
体外循环(cardiopulmonary bypass,CPB)下心脏瓣膜置换术是瓣膜病主要的外科治疗措施,但其创伤大,应激反应强烈,疼痛刺激明显,传统多通过应用大剂量阿片类药物来减轻疼痛[1],削弱应激反应。随着多模式镇痛理念的新兴,区域阻滞技术逐渐被应用于心脏手术的围手术期镇痛。近期胸横肌平面阻滞应用于心脏手术的报道[2-3]显示,其未能阻滞外侧肋间神经、躯体和内脏神经[4],对胸骨器撑开胸骨所引起的疼痛不能完全阻滞,而前锯肌平面阻滞可弥补这一不足。两种阻滞联合应用将有效减弱术中切皮、劈胸骨、牵开胸及胸骨复位固定等有创操作引起的疼痛刺激向中枢的传导,实现疼痛传导的最大范围阻滞,达到预防性镇痛的目的[5]。目前,两种阻滞方法联合应用于正中开胸心脏手术国内外鲜有报道,本研究拟通过观察双侧胸横肌联合前锯肌平面阻滞对心脏瓣膜置换术患者术中血流动力学、术后镇痛及心肌保护的影响,为临床提供参考依据。
1 资料与方法
1.1 一般资料
选取2019年9月至2021年12月于河北北方学院附属第一医院收治的50例心脏瓣膜病患者,女23例,男27例,年龄45~75岁,BMI 18~25 kg/m2。纳入标准:(1)择期于CPB下行正中开胸心脏瓣膜置换术;(2)美国麻醉医师协会(ASA)分级Ⅱ~Ⅲ级;(3)近3个月内未发生心肌梗死;(4)既往无严重心力衰竭或恶性心律失常发生。排除标准:(1)换瓣+搭桥;(2)二次换瓣;(3)左室射血分数(LVEF)≤45%;(4)手术时长>7 h;(5)肝、肾、肺、脑及凝血功能严重障碍;(6)穿刺部位有感染,患有带状疱疹后神经痛累及前胸;(7)近期患有牙周炎;(8)严重窦性心动过缓和(或)房室传导阻滞;(9)拒绝实施阻滞。退出标准:(1)研究者在治疗过程中拒绝继续配合或情况出现恶化;(2)因各种原因导致检测值异常而无法采用;(3)术中再次CPB;(4)术后2 d内未能拔管或无尿需透析;(5)术后出现严重低心排需大量血管活性药物维持。将患者随机分为对照组(C组)和研究组(R组),每组25例。两组基线资料比较差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准(W2022012),患者及家属知情同意。

表1 两组基线资料比较(n=25)
1.2 方法
1.2.1麻醉过程
所有患者术前常规禁食禁饮。术前30 min皮下注射吗啡0.15~0.20 mg/kg。入室后面罩吸氧,建立两条外周静脉通路。监测血氧饱和度(SpO2)、血压、心电图(ECG)和脑电双频指数(BIS)。局部麻醉下桡动脉穿刺置管,持续监测有创血压。麻醉诱导:依次静脉注射咪达唑仑2 mg、芬太尼8~10 μg/kg、依托咪酯0.1~0.3 mg/kg、罗库溴铵0.6 mg/kg,给氧去氮5 min待肌肉松驰效果满意后,可视喉镜下插管,接麻醉机行机械通气,设定I∶E为1∶2、潮气量6~8 mL/kg、呼吸频率12~18次/分,维持呼气末二氧化碳分压(PetCO2)在35~45 mmHg,BIS值在40~60。麻醉诱导后,R组于超声引导下行双侧胸横肌联合前锯肌平面阻滞,C组不予以阻滞,操作均由同一位高年资麻醉医生完成。行中心静脉穿刺置管,持续监测中心静脉压。CPB前维持患者平均动脉压(MAP)在基础值±20%内波动。术中维持:右美托咪定0.2~0.7 μg·kg-1·h-1,瑞芬太尼0.15~0.25 μg·kg-1·min-1,丙泊酚4~6 mg·kg-1·h-1,间断静脉注射罗库溴铵,根据BIS值及血流动力学的变化及时调整及追加麻醉药。CPB期间维持MAP在50~80 mmHg。心脏恢复自主跳动后持续泵注多巴胺5.0 μg·kg-1·min-1、肾上腺素0.05 μg·kg-1·min-1;复跳后若HR<65次/min,则泵注异丙肾上腺素0.05~0.10 μg·kg-1·min-1提升HR至80~120次/min,或安置心脏起搏导线,接临时起搏器,设置起搏HR为80次/min。手术结束后停止泵入麻醉药,保留气管导管维持泵注血管活性药,入ICU后连接镇痛泵,芬太尼15~20 μg/kg+右美托咪定200 μg+灭菌注射用水至100 mL。镇痛泵背景剂量2 mL/h。拔管后若患者诉疼痛,且视觉模拟量表(VAS)评分≥4分,则给予地佐辛5~10 mg。
1.2.2胸横肌平面阻滞(改良入路)
患者取平卧位,以胸骨柄计数第2肋,向下计数2个肋间隙至第4肋,于第4、5肋间胸骨旁1~2 cm处矢状位放置探头,超声下识别胸大肌和肋间内肌,针尖朝向头侧,当针尖到达胸大肌深面抵住第4肋软骨时,略微退针,回抽无血、无气后将10 mL局部麻醉药缓慢注入,注药时可见局部麻醉药在筋膜间隙内扩散,筋膜平面扩开后将穿刺针放平稍向头侧进针后再注射局部麻醉药10 mL,双侧各20 mL。
1.2.3前锯肌平面阻滞(深平面)
患者取平卧位,以胸骨柄计数第2肋,向下计数2个肋间隙至第4肋,于腋中线4、5肋间水平矢状位放置探头,超声下识别前锯肌、肋间外肌,针尖朝向头侧,当针尖触及第4肋骨上缘到达前锯肌深平面时,略微退针,回抽无血、无气,局部麻醉药缓慢推入(双侧各15 mL),注药时可见筋膜间隙内局部麻醉药的扩散,筋膜平面扩开后将穿刺针放平稍向头侧进针,边进针边注射局部麻醉药。
1.2.4观察指标
主要指标:记录术中芬太尼总使用量、拔管后补救镇痛地佐辛的用量、拔管后静息及咳嗽两种状态下VAS评分;ELISA法检测T1(入室后5 min)、T8(CPB开始后30 min)、T9(CPB结束后30 min)、T10(术后24 h)血清IL-6、IL-10水平;检测T1、T10、T11(术后48 h)BNP、cTnⅠ水平。次要指标:记录患者T1、T2(切皮前5 min)、T3(切皮后1 min)、T4(胸骨正中锯开后1 min)、T5(CPB开始前1 min)、T6(拔主动脉插管时)及T7(术后5 min)的MAP和HR,以及患者术后首次清醒时间、拔管时间。
1.3 统计学处理
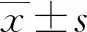
2 结 果
2.1 两组芬太尼和地佐辛用量比较
与C组相比,R组术中芬太尼总用量及拔管后补救镇痛地佐辛用量均减少(P<0.05),见表2。
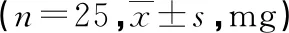
表2 两组术中芬太尼及术后补救镇痛地佐辛用量比较
2.2 两组拔管后静息及咳嗽时VAS评分比较
与C组相比,R组拔管后咳嗽时VAS评分降低(P<0.05),静息时VAS评分无明显变化(P>0.05),见表3。
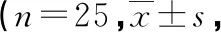
表3 两组拔管后静息及咳嗽时VAS评分比较分)
2.3 两组不同时点IL-6、IL-10水平比较
与T1相比,两组T8、T9、T10时IL-6、IL-10水平升高(P<0.05)。与C组相比,T8、T9、T10时R组IL-6水平降低,IL-10水平升高,差异有统计学意义(P<0.05),见表4。

表4 两组不同时点IL-6和IL-10水平比较
2.4 两组不同时点BNP、cTnⅠ水平比较
与T1相比,两组T10、T11时BNP、cTnⅠ水平升高(P<0.05)。与C组相比,T10时R组BNP、cTnⅠ水平降低(P<0.05),见表5。
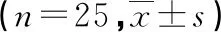
表5 两组不同时点BNP和cTnⅠ水平比较
2.5 两组不同时点血流动力学指标比较
与T2相比,T3、T4时C组MAP及HR明显升高(P<0.05),而R组无明显变化(P>0.05)。与C组相比,T3、T4时R组MAP及HR降低(P<0.05),见表6。
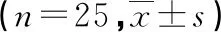
表6 两组不同时点血流动力学指标比较
2.6 两组术后首次清醒时间和拔管时间比较
与C组相比,R组术后首次清醒及拔管时间均较早(P<0.05),见表7。
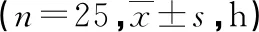
表7 两组术后首次清醒时间和拔管时间比较
3 讨 论
正中开胸心脏手术其切口从胸骨上切迹延伸至剑突长达20 cm,且术中会长时间维持对胸骨宽达16 cm的牵开,二者共同作用对皮肤、皮下组织、胸骨肌、胸大肌及骨膜等造成不同程度的损伤,加上引流管的置入,最终导致较为剧烈的术后疼痛[6],如果处理不够及时,不仅增加其转为慢性疼痛的风险,还会影响生活质量[7]。目前区域阻滞技术已成为心脏手术围手术期镇痛的重要辅助手段[8],其不仅减少了单一药物的使用量,也削弱了各自的不良反应[9],如阿片类药物带来的呼吸抑制[10]、插管时间延长[11]及胃肠道反应[12]等。
超声引导下胸横肌平面阻滞[13]最早于2015年提出其可阻滞肋间神经前皮支支配的T2~T6正中胸壁区域,目前主要用于乳腺癌[14]及正中开胸[15]等手术。然而由于胸横肌位置较深,存在发生气胸及血管损伤的风险,有学者提出了可达到与胸横肌平面阻滞相同效果的改良入路[16-17]。正中开胸心脏手术为了充分暴露术野,有时会将胸骨撑开至超过锁骨中线,造成非生理性肋骨回缩,增加肋骨骨折发生的风险,而早在1983年此并发症就得到了GREENWALD 等[18]的证实。而作用范围以胸壁正中区域为主的胸横肌平面阻滞不足以覆盖肋骨骨折所在的双侧侧胸壁区域,因此寻求另一种阻滞联合以提供更加满意的镇痛效果成为本研究的关键所在。BLANCO等[19]首次于2013年报道前锯肌平面阻滞,可覆盖T2~T9肋间神经外侧皮支所在的侧胸壁区域,在微创心脏外科中有研究采用单侧前锯肌平面阻滞进行侧胸壁镇痛[20],而且其在小儿正中开胸心脏手术中也有报道[8],由此为联合双侧前锯肌平面阻滞用于成人正中开胸心脏手术提供了理论依据,可用于阻滞CT无法发现的肋骨骨折所引起的疼痛。此外两种阻滞操作时均为平卧位即可,操作简单且易于实施。
本研究显示,与C组相比,R组患者术中芬太尼的总使用量较少(P<0.05),说明两种阻滞联合可为患者提供较单纯全身麻醉更加完善的镇痛,发挥了联合麻醉的优势。在超过罗哌卡因作用时长的情况下,R组患者咳嗽时VAS评分更低,出现这一结果的原因可能是阻滞对疼痛的传导实现了超前的抑制,且术后与PCIA进行了良好的衔接,为患者提供了较长时效的镇痛,从而减少了拔管后补救镇痛药地佐辛的使用量,当麻醉性镇痛药的使用减少时,则有效地促进了患者术后自主呼吸的及早恢复,从而早期拔管,尽早恢复肺功能。
有效而充分的镇痛对平稳血流动力学的维持是必不可少的,若术中镇痛不完善,不仅会使患者的HR加快、血压升高,还会相应地增加镇静药及血管活性药的应用。本研究显示,两组患者T2时MAP及HR均较T1降低,这是因为诱导时麻醉药物的应用抑制了交感神经的活性,对血管产生了一定的扩张作用所致。相比T2,T3、T4时C组患者MAP及HR均明显升高(P<0.05),说明单纯全身麻醉尚不足以对心脏手术中切皮、劈胸骨等有创操作完全抑制,而R组患者的MAP及HR无明显变化(P>0.05),说明两种阻滞的联合不仅对疼痛反射的传入神经进行了阻滞,也对交感神经系统的兴奋产生了更进一步地抑制,维持了患者术中血流动力学的平稳。
平稳的血流动力学可减轻缺血再灌注损伤所引起的炎性应激反应对心肌的损伤。IL-6是促炎细胞因子的一种,可用来评估CPB所致的全身炎症反应的严重程度,在心功能损害[21]时升高;IL-10是抗炎细胞因子一种,可启动过度炎症反应的自动调节[22]。cTnⅠ 是心肌收缩的调节蛋白之一,其水平与心肌损伤程度呈正相关[23]。BNP由心室肌细胞产生,反映了左室功能障碍的程度及心脏术后的患者预后[24]。本研究显示,两种阻滞的联合应用实现了镇痛范围的最大覆盖,从传入神经上阻断了疼痛的传导,从而对交感神经系统的激活具有一定的抑制作用,其效果体现在R组更加平稳的血流动力学当中,而R组平稳的血流动力学也减轻了缺血再灌注损伤及血液与管道的机械剪切作用,最终IL-6的增长幅度较低,而IL-10的增长幅度较高,维持了患者促炎与抗炎因子的相对平衡,避免了炎症反应的过度活化,这与SONG等[25]研究总体趋势相一致;且R组患者术后24 h及48 h cTnⅠ及BNP增长幅度均较C组低,这可能与R组患者较低的血流动力学波动幅度有关,从而产生一定的心肌保护的作用。
本研究尚有不足之处:(1)患者为麻醉后进行阻滞,未能清楚测得阻滞范围,但术中平稳的血流动力学及围手术期较少的阿片类药物使用量表明阻滞效果良好。(2)筋膜内阻滞均为单次,虽避免了置管所带来的风险,但不能提供连续长时间的术后镇痛。本研究采用了联合术后PCIA的多模式镇痛,弥补了这一不足。(3)本研究所纳入的样本数量偏小,后续会增加一定样本量来继续完善研究。
综上所述,超声引导下胸横肌联合前锯肌平面阻滞是全身麻醉下正中开胸心脏瓣膜置换术中一种有效的辅助镇痛技术,可为患者提供较单纯全身麻醉更加完善的镇痛效果,减少阿片类药物的用量,削弱炎性应激反应,产生一定的心肌保护作用。

