细菌性肝脓肿合并糖尿病患者的临床表现特点
李强 刘峰 谢芳 洪明昭 徐亚楠
细菌性肝脓肿(bacterial liver abscess,BLA)是指细菌经血流性、胆汁性或其他途径侵犯肝脏所形成的感染性疾病,早期表现为肝脏组织炎性浸润,晚期则出现脓肿。20 世纪最初的30 年间BLA 病死率高达75%~80%[1-2]。随着医疗水平提高,BLA 病死率已大幅降低,但发病率及复发率仍较高[3]。BLA 患者多有糖尿病、胆石症、肝硬化及肝胆系统肿瘤等基础疾病。有研究显示,中国大陆地区BLA 合并糖尿病患者占BLA 患者的40%以上[4],临床表现多不典型或隐匿,早期不易识别,常被误诊和(或)延迟诊断,影响患者治疗和临床结局[5-6]。本研究分析BLA 合并糖尿病患者的临床表现特点,以期为临床诊疗提供参考。
1 对象和方法
1.1 对象 收集2017 年1 月至2022 年12 月中国科学院大学深圳医院收治的62 例BLA 患者临床资料。纳入标准:参照BLA 诊治急诊专家共识(2022 年),依据临床症状、体征以及实验室检查、肝脏B 超、CT 等影像学检查表现诊断为BLA。参照中国2 型糖尿病防治指南(2020 版)诊断为糖尿病。参照Sepsis 3.0 标准[6],有明确感染、序贯器官衰竭评估评分(sequential organ failure assessment score,SOFA)≥2 分,诊断为脓毒血症。排除标准:阿米巴肝脓肿、结核性肝脓肿以及未合并化脓病变的肝肿瘤患者;临床病历资料不完整的患者。62 例BLA 患者中合并糖尿病28例(45.16%),不合并糖尿病34 例(54.84%);来自于感染科17 例(27.42%),内分泌科12 例(19.35%),普外科8 例(12.90%),消化科7 例(11.29%),其他科室18例(29.03%)。本研究经本院医学伦理委员会审查通过(批准文号:LL-KT-2023120),所有入组患者均知情同意。
1.2 方法 根据患者是否合并糖尿病,将62 例BLA患者分为合并组和不合并组。比较两组患者的性别、年龄、临床表现、科室来源等一般资料;检查并比较两组患者血清ALT、TBil、白蛋白、降钙素原、超敏C 反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、外周血WBC、中性粒细胞比例等实验室资料;记录并比较两组患者影像学检查手段、脓肿位置和数量等影像学资料;收集两组患者的血液、脓液,使用VITEK 2 compact 全自动细菌鉴定及药敏仪,分离并培养细菌,比较两组患者细菌阳性率及致病菌构成。
1.3 统计学处理 使用SPSS 21.0 统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;偏态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验。计数资料用例表示,组间比较采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床一般资料比较 两组患者性别、年龄比较,差异均无统计学意义(均P>0.05)。与不合并组患者相比,合并组患者出现腹痛占比更低,出现脓毒血症者占比更高,差异均有统计学意义(均P<0.05),见表1。
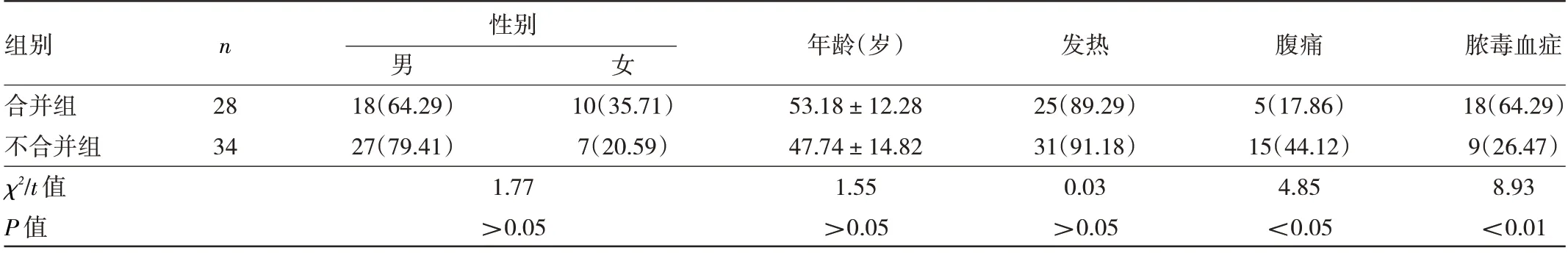
表1 两组患者临床一般资料比较[例(%)]
2.2 两组患者实验室资料比较 相比不合并组患者,合并组患者ALT 水平更高,差异有统计学意义(P<0.05),见表2。
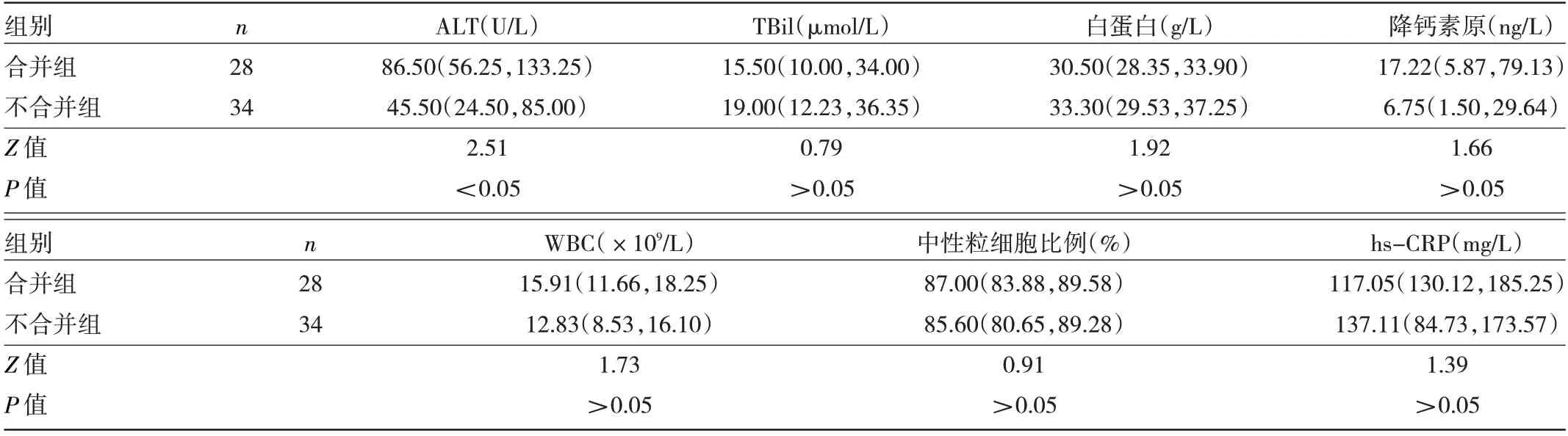
表2 两组患者实验室指标比较
2.3 两组患者影像学资料比较 62 例患者均行影像学检查,其中首次发现肝脓肿的影像学手段经腹部B超检查29 例(46.77%),腹部CT 检查16 例(25.81%),胸部CT 检查15 例(24.19%),腹部MRI 检查2 例(3.23%)。胸部CT 检查发现的患者进一步完善腹部B超或腹部CT 检查确诊。肝脓肿位于右叶患者最多[43例(69.35%)],且大多数为单发[44 例(70.97%)]。两组患者肝脓肿的位置、数量及最大径比较,差异均无统计学意义(均P>0.05),见表3。
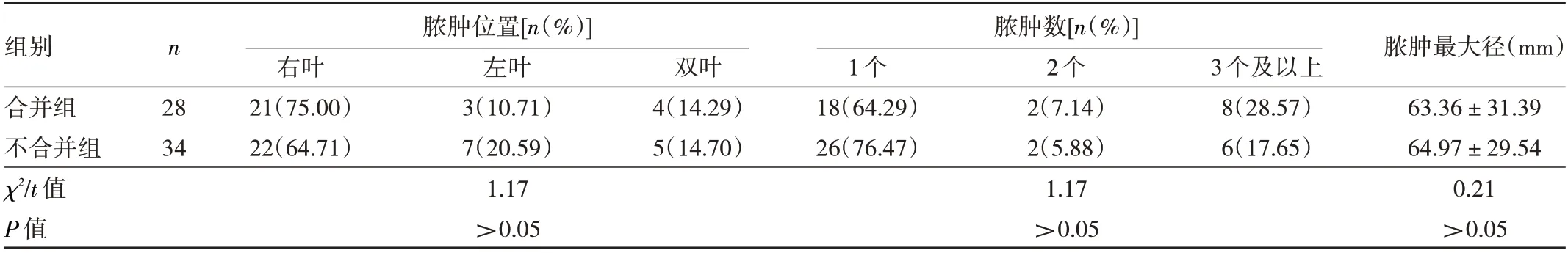
表3 两组患者影像学资料比较
2.4 两组患者微生物学检查资料比较 62 例患者均经血液、脓液病原微生物培养,检出阳性率为58.06%(36/62)。合并组中脓液培养阳性5 例,血液培养阳性9 例,脓液、血液培养均阳性7 例,病原微生物培养检出阳性率为75.00%(21/28),不合并组中脓液培养阳性5 例,血液培养阳性4 例,脓液、血液培养均阳性6 例,病原微生物培养检出阳性率为44.12%(15/34)。相比不合并组,合并组阳性率更高,差异有统计学意义(χ2=6.01,P<0.05)。主要致病微生物为肺炎克雷伯菌(61.11%,22/36),其次是大肠埃希菌(16.67%,6/36)。肺炎克雷伯菌在合并组中的检出率达76.19%(16/21),显著高于不合并组的40.00%(6/15),差异有统计学意义(P<0.05)。
3 讨论
肝脓肿常见病原微生物包括细菌、真菌、阿米巴等,以细菌感染最常见,占肝脓肿发病率的80%[7-8]。不同病原微生物所致的肝脓肿患者临床表现缺乏特异性,鉴别诊断较困难。本研究排除结核性肝脓肿的依据[9],一是根据CT 见病灶内钙化或粉末状钙化表现,二是根据穿刺液抗酸杆菌涂片阳性或一般抗生素治疗脓肿无缩小,三是合并肝外感染如肺结核。排除阿米巴肝脓肿的依据[10],一是穿刺液呈“果酱”样脓液,二是合并肝外感染如肠道阿米巴。
BLA 患者多患有基础疾病,目前以糖尿病最为常见。本研究发现,BLA 合并糖尿病患者占比为45.16%,与相关报道较接近[11-12]。BLA 合并糖尿病患者中89.29%有发热症状,而有腹痛症状者仅有17.86%,显著低于不合并糖尿病患者的44.12%,因而不易被发现。分析原因可能为糖尿病患者长期高血糖状态导致微循环障碍及并发神经病变,机体对疼痛的敏感性下降,使得腹痛症状不明显或者不出现[13]。
实验室检查结果显示合并糖尿病BLA 患者ALT水平更高,且出现脓毒血症更多。分析原因,一是糖尿病患者肝脏的免疫反应状态下调,导致清除内毒素、吞噬微生物能力减弱。二是高糖内环境下淋巴细胞、巨噬细胞和中性粒细胞的免疫趋化、吞噬和黏附能力都可能都受到抑制,而病原微生物繁殖能力则可能增强。合并糖尿病BLA 患者出现重症感染风险也更高[14]。
目前BLA 的主要影像学检查手段是B 超和CT。本研究中合并及不合并糖尿病的BLA 被发现方式均主要为B 超,其次是腹部CT。此外还有24.19%(15/62)的肝脓肿为胸部CT 检查被意外发现,可见肝脓肿常被临床医生忽视。影像学诊断结果显示,合并和不合并糖尿病的BLA 患者,肝脓肿均以单发、右叶脓肿为主,与既往文献报道相一致[15]。原因可能与肝脏解剖结构有关,即肝右叶比左叶更大,血流更多,自肝门静脉入肝的血液进入右前支阻力最小,因而右侧感染更多。
既往研究认为BLA 患者最常见致病菌为大肠埃希菌,但近10 年的流行病学研究发现肺炎克雷伯菌已经成为其最主要的病原菌[16]。本研究发现肺炎克雷伯菌在合并组中的检出率达76.19%(16/21),显著高于不合并组40.00%(6/15),这为临床医生经验性选择抗生素提供一定的参考。
综上,合并糖尿病的BLA 发病率有上升趋势,大部分有发热表现,但腹痛症状隐匿,临床表现缺乏特异性。糖尿病患者出现不明原因发热,尤其是伴血清ALT 明显升高、发生脓毒血症应警惕BLA 的可能。无论患者有无腹痛表现,均需及时完善腹部B 超或CT检查。临床医生可根据本单位监测数据选择使用覆盖肺炎克雷伯菌敏感抗生素。

