大承气汤用于过敏性哮喘对MAPK 信号通路和Th1/Th2 型细胞因子影响的动物模型研究
尹志鹏,张 全,谭 俊,雷明盛
(湖南省张家界市人民医院 呼吸与危重症医学科,湖南 张家界 427000)
哮喘是一种患病人数较多的呼吸系统疾病,其典型特征是患者气道存在慢性炎症及高反应性[1]。西医对其的治疗主要是给予糖皮质激素进行抗炎、β2 受体激动剂舒张支气管等[2]。大承气汤最早记载于《伤寒论》中,为“肺肠同治”典型药方,有通腑泄热、峻下热结等效,以往常用于治疗胰腺炎、肠梗阻等病症[3]。有研究报道,大承气汤能够改善呼吸窘迫综合征等肺系疾病患者肺部损伤,并减轻其炎症反应,改善患者免疫功能[4-5]。目前关于大承气汤用于过敏性哮喘的研究较少,其治疗过敏性哮喘的作用机制也缺乏理论依据支持。有研究报道,辅助性T 细胞(Th)1/Th2 比例失衡在哮喘发作中有重要地位;同时,有研究显示,p38 蛋白激酶(p38 MAPK)通过调控白细胞介素(IL)-4 等细胞因子参与到炎症反应中,由此推测大承气汤治疗过敏性哮喘、减轻炎症反应可能与丝裂原活化蛋白激酶(MAPK)与Th1/Th2 平衡有关[6-7]。本次研究对过敏性哮喘小鼠应用大承气汤,观察大承气汤对MAPK 信号通路和Th1/Th2 的影响,以探讨大承气汤治疗过敏性哮喘的机制,为临床治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 BALB/c 小鼠40 只,6 ~8 周龄,体质量20 ~25 g,恒温恒湿,自由食水。
1.1.2 药物、试剂与仪器 美国Sigma 公司生产,卵清白蛋白(OVA),四甲基乙二胺(TEMED),十二烷基硫酸钠(SDS)十二烷基硫酸,批号依次是SLBM7240V,T9281,L3771;地塞米松片(福州海王福药制药有限公司,国药准字H35021170);美国Thermo 公司生产,BCA 蛋白测定试剂盒,广谱彩虹预染低蛋白Marker,氢氧化铝凝胶,批号依次是A53225,26628,R1235952B;美国CST 公司生产,磷酸化(p)-MAPK 单克隆抗体,MAPK 单克隆抗体,批号依次是9910,9926;美国Abgent 公司生产,羊抗小鼠免疫球蛋白(Ig)G-辣根过氧化物酶(HRP)二抗,β-肌动蛋白(β-actin)抗体,批号分别为ASS1007,AM1021B;Bio legend 公司生产,IL-4 ELISA Kit、IL-17A ELISA Kit、INF-γ ELISA Kit,批号分别为B187236、B181929、B1887025;深圳达科生物技术公司生产,mIL-5 检测试剂盒;迪夫快速染液,批号为L9210789。显微镜(美国Olympus 公司,型号TH4-200),石蜡切片机(德国Microm 公司,型号HM325),1703930 型湿转电转印仪、数码凝胶成像系统(美国Bio-Rad 公司),高速离心机(德国Eppendorf公司,型号5415),酶标仪(瑞士Tecan公司)。1.1.3 大承气汤的制备 大承气汤药方组成:大黄、枳实各12 g,厚朴24 g,芒硝9 g,药物浸泡30 min 后,武火煎煮10 min,再以文火煎煮20 min,煎煮2 次,将所得药液混合,水煎浓缩含生药1.9 g/mL,通过双层纱布滤过药液,分装储存于4℃冰箱。
1.2 方法
1.2.1 动物模型的构建与给药 小鼠适应性饲养7 d后,通过随机数字表法将小鼠分为空白对照组(A组)、模型组(B 组)、地塞米松组(C 组)和大承气汤组(D 组),每组各10 只。通过OVA 致敏激发构建过敏性哮喘小鼠模型,分别在第0 天、第14 天,B 组、C 组和D 组每只小鼠于腹腔注射0.2 mL 抗原液(氢氧化铝2 mg,OVA 20 μg),A 组给予等量生理盐水注射;第21 ~27 天,将小鼠放进雾化箱中,B 组、C 组和D 组雾化吸入1% OVA 激发,A 组小鼠给予生理盐水雾化,每日1 次,每次0.5 h;C 组及D 组在雾化前1 h 分别给予地塞米松及大承气汤干预,每只0.2 mL,A 组、B 组给予等量生理盐水。地塞米松给药量:0.005 g/kg,大承气汤给药量:19 g/mL。
1.2.2 肺指数测定 实验结束后,测量小鼠体质量。小鼠麻醉后处死,打开胸腔,取出肺组织,通过生理盐水冲净后吸除其表面液体,测量肺组织质量,肺指数=小鼠肺质量(g)/小鼠体质量(g)×100 %。
1.2.3 气管肺泡灌洗液(BALF)的获取及细胞计数 气管插管插入气管内1 cm 进行缝合固定,用0.8 mL 含0.5 %牛血清白蛋白(BSA)的无菌PBS 缓冲液灌洗气管、支气管及全肺并回收,进行离心处理后使用1 mL 含0.5 % BSA 的PBS 缓冲液重悬细胞计算细胞总数,通过迪夫染液迅速染色,拍照,细胞分类计数,取300 个细胞计算其中嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞的比例,依据细胞总数计算BALF 中各类炎症细胞数量。
1.2.4 蛋白免疫印迹法检测MAPK 信号通路蛋白表达 造模完毕后,取100 mg 肺组织,放在冰上的1.5 mL离心管中,然后放进-80℃冰箱中储存。使用RIPA 裂解液提取总蛋白后对蛋白浓度进行检测,利用聚丙烯酰胺电泳依据相对分子质量大小进行分离,利用湿转法将蛋白转移至聚偏二氟乙烯膜(PVDF),加入封闭液后置于摇床上于室温下封闭孵育2 h,将一抗p38 蛋白激酶(p38 MAPK),细胞外调节蛋白激酶(ERK),p-p38 MAPK 及p-ERK1/2 按1:1 000 稀释后分别加入适量,摇床上4℃孵育过夜;使用聚山梨酯与三乙醇胺缓冲盐水溶液(TBST)缓慢冲洗3 次,分别加入相应1:5 000 稀释后二抗,于室温下孵育2 h,TBST 缓慢冲洗3 次,通过化学发光试剂,暗室内曝光显影,进行图像分析,检测目的蛋白及内参β-actin 灰度值。
1.2.5 BALF 中细胞因子检测 取离心后染色清液,通过对应试剂盒对人干扰素-γ(INF-γ)、IL-4、IL-5、IL-17A 水平进行检测。
1.2 统计学方法 采用SPSS 22.0 统计软件进行数据分析,计量资料以(±s)表示,组间比较采用t检验,多组间行方差齐性检验;计数资料以例(%)表示,采用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 4组小鼠肺指数水平比较 A组肺指数为(0.639±0.003),B 组肺指数为(0.725±0.005),C 组肺指数为(0.680±0.006),D 组肺指数为(0.673±0.005),肺指数水平:A 组<D 组<C 组<B 组(P<0.05)。
2.2 4 组小鼠BALF 中细胞总数及各类炎症细胞数目比较 总细胞数水平:A 组<C 组<D 组<B 组(P<0.05);嗜酸性粒细胞水平:A 组<C 组<D 组<B 组(P<0.05);中性粒细胞水平:A组<C组<D组<B组(P<0.05);淋巴细胞水平:A 组<C 组<D 组<B组(P<0.05);巨噬细胞水平:A 组>B 组>D 组>C 组(P<0.05)。见表1。
表1 4 组小鼠BALF 中各类炎症细胞数目比较(±s,n = 10) ×105/mL
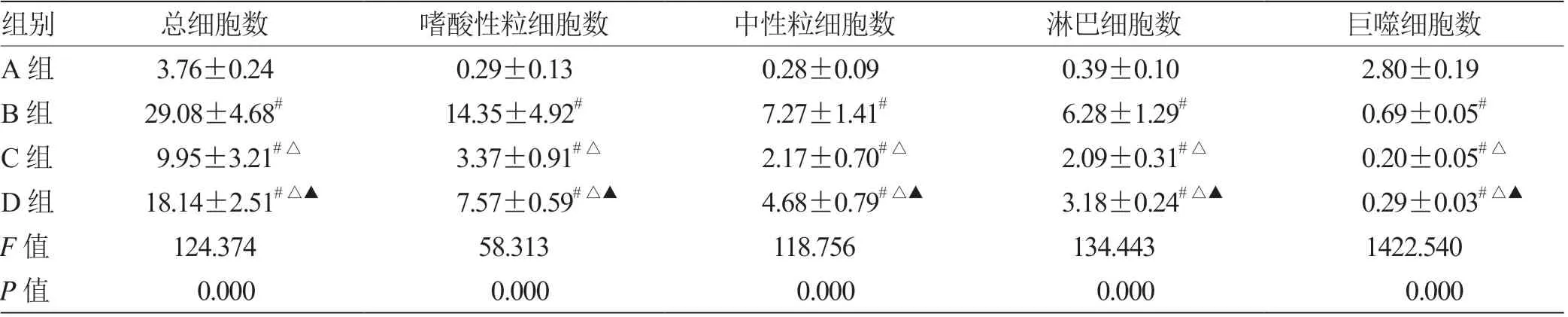
表1 4 组小鼠BALF 中各类炎症细胞数目比较(±s,n = 10) ×105/mL
注:与A 组比较,# P <0.05;与B 组比较,△P <0.05;与C 组比较,▲P <0.05
组别总细胞数嗜酸性粒细胞数中性粒细胞数淋巴细胞数巨噬细胞数A 组 3.76±0.24 0.29±0.130.28±0.090.39±0.102.80±0.19 B 组29.08±4.68#14.35±4.92#7.27±1.41#6.28±1.29#0.69±0.05#C 组 9.95±3.21#△ 3.37±0.91#△2.17±0.70#△2.09±0.31#△0.20±0.05#△D 组18.14±2.51#△▲ 7.57±0.59#△▲4.68±0.79#△▲3.18±0.24#△▲0.29±0.03#△▲F 值124.37458.313118.756134.4431422.540 P 值 0.000 0.000 0.000 0.000 0.000
2.3 4 组小鼠肺组织MAPK 信号蛋白表达水平比较 以β-actin 为内参对照,p-p38/β-actin 水平:A 组=C组<B组(P<0.05),C组=D组<B组(P<0.05),A 组<D 组(P<0.05);p38/β-actin 水平:A 组=C组=D 组=B 组(P>0.05);p-ERK1/2/β-actin 水平:A 组<C 组<D 组<B 组(P<0.05);ERK1/2/β-actin水平:A 组=C 组=D 组=B 组(P>0.05)。见表2。
表2 4 组小鼠肺组织MAPK 信号蛋白表达水平比较(±s,n = 10)
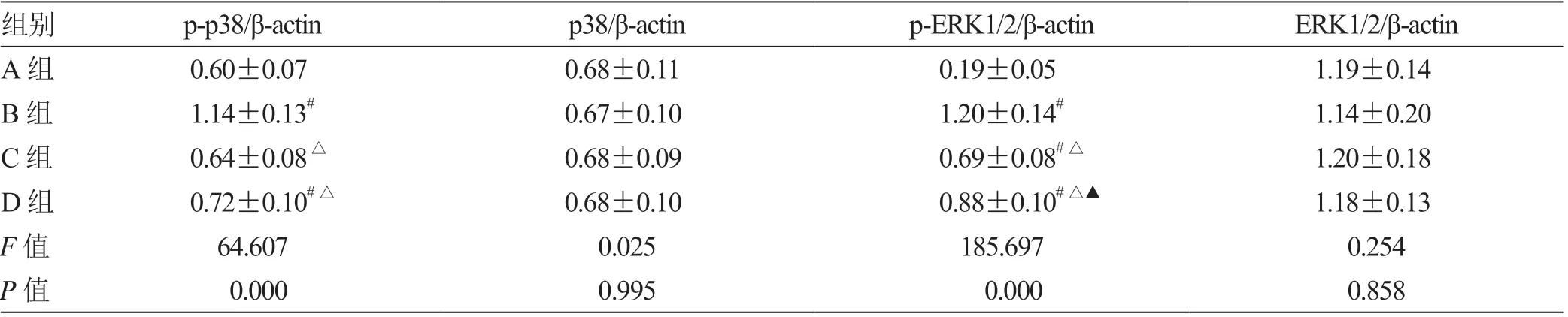
表2 4 组小鼠肺组织MAPK 信号蛋白表达水平比较(±s,n = 10)
注:与A 组比较,# P <0.05;与B 组比较,△P <0.05;与C 组比较,▲P <0.05
组别p-p38/β-actinp38/β-actinp-ERK1/2/β-actinERK1/2/β-actin A 组0.60±0.070.68±0.110.19±0.051.19±0.14 B 组1.14±0.13#0.67±0.101.20±0.14#1.14±0.20 C 组0.64±0.08△0.68±0.090.69±0.08#△1.20±0.18 D 组0.72±0.10#△0.68±0.100.88±0.10#△▲1.18±0.13 F 值64.6070.025185.6970.254 P 值 0.0000.995 0.0000.858
2.4 4组小鼠BALF中细胞因子水平比较 INF-γ水平:A 组>C 组>D 组>B 组(P<0.05);IL-4 水平:A 组<C 组<D 组<B 组(P<0.05);IL-5 水平:A组<C组<B组(P<0.05),A组<D组(P<0.05),C 组=D 组(P>0.05),B 组=D 组(P>0.05);IL-17A 水平:A 组<C 组<D 组<B 组(P<0.05)。见表3。
表3 4 组小鼠BALF 中细胞因子水平比较(±s,n = 10) pg·mL-1

表3 4 组小鼠BALF 中细胞因子水平比较(±s,n = 10) pg·mL-1
注:与A 组比较,# P <0.05;与B 组比较,△P <0.05;与C 组比较,▲P <0.05
组别IFN-γIL-4IL-5IL-17A A 组141.27±19.85 13.08±4.12 20.13±2.65 51.09±9.88 B 组 30.14±8.53#106.83±10.49#119.64±7.58#163.27±23.42#C 组 62.59±7.64#△ 56.38±7.91#△112.34±7.16#△ 81.95±15.53#△D 组 51.37±13.86#△▲ 71.84±20.65#△▲114.86±9.51#102.62±18.71#△▲F 值131.29798.079443.95872.495 P 值 0.000 0.000 0.000 0.000
3 讨论
过敏性哮喘是哮喘中最常见的类型,遗传因素、过敏原接触等均会使其发生风险上升。西医理论认为其发病受遗传与环境的双重影响,患者在接触变应原后,体内特异性免疫球蛋白E 与肥大细胞、嗜酸性粒细胞等细胞结合,使得炎症介质分泌水平上升,进而发生哮喘[8-9]。中医理论中将此病归入“哮病”等范畴,认为其多因外感风邪、情志失畅等引起宿痰内伏于肺,以致痰阻气道,肺失肃降,肺气上逆,因此对其的治疗以治肺为主[10]。中医认为肺与大肠在经络上相互络属,功能上相互协调,因此又有“肺与大肠相表里”之论,对于肺系、肠系疾病也采用“肺肠同治”之法[11]。
本次研究结果显示,肺指数水平:A 组<D 组<C组<B 组;p-p38/β-actin 及p-ERK1/2/β-actin 水平均C组、D 组明显低于B 组;INF-γ 水平:A 组>C 组>D组>B 组;IL-4、IL-17A 水平均A 组<C 组<D 组<B组,提示大承气汤具有与地塞米松相似的效果,能够抑制MAPK 信号通路相关磷酸化蛋白表达,减少炎症因子水平,调节Th1/Th2 平衡。MAPK 在信号从细胞表面传至细胞核内部的过程中具有重要作用,其参与到细胞的增殖、分化、炎症反应等多种重要过程中,包括ERK、p38 等4 个亚族[12]。MAPK 在碱形式中没有活性,只有经过磷酸化后其活性才会被激发。辅助性T 细胞在免疫系统中占有核心地位,包括Th1 及Th2 2 个亚群,Th1 介导细胞免疫,主要调节IFN-γ、IL-2 等水平,Th2 介导体液免疫,主要调节IL-4、IL-5等炎症因子水平[13]。一般情况下,Th1/Th2 系统处于平衡状态,当机体受到外界刺激,Th1/Th2 即会失衡,造成炎症反应[14]。大承气汤中含有大黄、枳实、厚朴、芒硝4 味中药,其中大黄具有清热泻火、泻下攻积、祛痰等功效,对于宣降肺气有所裨益;枳实能够破气消积、止咳化痰、止泻通便,厚朴能够燥湿消痰、下气平喘、行气消积,二者合用能够行气散结、平喘消痰;芒硝能够泻下通便、清火消肿,裨益大肠功能,通肺气[15-17]。现代药理学研究发现,大黄中含有β-谷甾醇、芦荟大黄素等有效成分,通过作用于钙离子、P13K、MAPK 等信号通路,能够发挥抗炎作用[18]。枳实中含有木犀草素、柚皮素等活性成分,能够作用于肿瘤坏死因子、T 细胞受体等信号通路,来发挥抗炎作用[19]。
综上所述,大承气汤能够改善过敏性哮喘小鼠肺损伤,其可能机制是抑制MAPK 信号通路磷酸化进程,调节Th1/Th2 平衡,进而减轻炎症。

