不可切除肝细胞癌患者肝动脉灌注化学治疗效果分析*
杜瑶,劳茜莹,唐敏,史炯,曹亚娟
(南京大学医学院附属鼓楼医院 1.药学部;2.影像科;3.病理科;4.普通外科,南京 210008)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,居我国恶性肿瘤发病率第4-位,是我国第2位的肿瘤致死原因[1]。根治性切除是肝癌患者得以长期生存的主要治疗手段,然而我国肝癌患者确诊时多处于中晚期,初诊可行手术切除的患者仅占15%~30%[2]。《原发性肝癌诊疗规范(2022年版)》[3]、《肝癌转化治疗中国专家共识(2021年版)》[4]均推荐中晚期不可切除的肝癌可采取包括介入治疗、消融治疗、放射治疗、系统治疗等多种治疗手段,争取转化为可手术切除。近年来采用的以FOLFOX方案为基础的肝动脉灌注化学治疗(化疗)(hepatic artery infusion chemotherapy,HAIC),被证明有效率高达79.6%,可有效延长患者生存期,明显优于索拉非尼[5]。笔者对我院不可切除性肝细胞癌患者接受基于HAIC的抗癌治疗方案的效果进行总结分析,现报道如下。
1 资料与方法
1.1临床资料 通过医院信息系统(hospital information system,HIS)病历系统,收集2020年10月—2021年11月在南京大学医学院附属鼓楼医院肝胆胰中心接受FOLFOX方案HAIC患者的临床资料。纳入标准:①经肝穿刺活检明确诊断为肝细胞癌;②根据《原发性肝癌诊疗规范》(2019年版)及外科医生评估认为不适宜手术切除;③年龄≥18岁;④肝功能Child-Pugh分级为A、B级;⑤美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;⑥骨髓状态良好,接受FOLFOX方案HAIC治疗。排除标准:①随访期间影像学或实验室检查资料缺失;②合并其他器官恶性肿瘤;③有其他器官恶性肿瘤病史者;(4)肌酐清除率(CrCl)<30 mL·min-1。
1.2研究方法
1.2.1患者分组 根据所接受的治疗方案,将患者分为HAIC单独治疗组与HAIC联合治疗组。HAIC联合治疗组包括HAIC联合分子靶向药物酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),HAIC联合细胞程序性死亡受体-1(programmed cell death-1,PD-1)单抗,以及HAIC联合TKI和PD-1单抗。
1.2.2治疗方案 每次化疗前评估患者肝肾功能、血常规、电解质、肿瘤标记物、心电图等指标,每2个治疗周期行影像学检查评估疗效。抗癌治疗一直持续到疾病进展、出现不能耐受的不良反应或患者要求停止治疗为止。
①HAIC:25例患者经左锁骨下动脉穿刺植入动脉药盒,介入下放置导管末端于肝动脉,港座埋于锁骨下窝皮下,经肝动脉药盒行灌注化疗,用药完毕后封管,药盒可长期留存;4例患者经右股动脉插管选择肿瘤主要供血血管进行灌注化疗,操作在介入下完成,每次化疗结束后拔除插管。化疗方案为FOLFOX6(或mFOLFOX6):奥沙利铂(注射用奥沙利铂,江苏恒瑞医药股份有限公司,批准文号:国药准字H20040817,规格:每支100 mg)130 mg·(m2)-1[或85 mg·(m2)-1]持续灌注3 h;亚叶酸钙(注射用亚叶酸钙,江苏恒瑞医药股份有限公司,批准文号:国药准字H32022391,规格:每支0.1 g)400 mg·(m2)-1持续灌注2 h;氟尿嘧啶(氟尿嘧啶注射液,天津金耀药业有限公司,批准文号:国药准字H12020959,规格:10 mL:0.25 g)400 mg·(m2)-1持续灌注1 h,氟尿嘧啶2 400 mg·(m2)-1持续灌注46 h,每3~4周重复1次。
CrCl<50 mL·min-1患者,奥沙利铂剂量减少25%。转氨酶>3倍参考值上限(upper limit of normal value,ULN)或总胆红素>50 μmol·L-1,则先给予保肝利胆治疗。如果白细胞计数<3×109·L-1和(或)血小板<100×109·L-1,中断治疗,并给予升白细胞或升血小板治疗;如果白细胞或血小板在7 d内恢复,则继续治疗而不减少剂量,否则将奥沙利铂剂量减少25%,可在随后2周内给予遗漏剂量。如存在电解质紊乱,则纠正电解质紊乱后开始化疗。
②PD-1单抗:卡瑞利珠单抗(注射用卡瑞利珠单抗,苏州盛迪亚生物医药有限公司,批准文号:国药准字S20190027,规格:每支200 mg)200 mg,静脉滴注,每3周1次;替雷利珠单抗(替雷利珠单抗注射液,广州百济神州生物制药有限公司,批准文号:国药准字S20190045,规格为10 mL:100 mg)200 mg,静脉滴注,每3周1次;信迪利单抗[信迪利单抗注射液,信达生物制药(苏州)有限公司,批准文号:国药准字S20180016,规格为10 mL:100 mg]200 mg,静脉滴注,每3周1次。
③TKI:仑伐替尼(甲磺酸仑伐替尼胶囊,Eisai Co.,Ltd.,批准文号:国药准字J20200044,规格:每粒4 mg)8 mg(体质量≥60 kg,每次12 mg)口服,qd;或索拉非尼(甲苯磺酸索拉非尼片,Bayer HealthCare AG,批准文号:国药准字J20160201,规格:每片200 mg)400 mg口服,bid;或给予多纳非尼(甲苯磺酸多纳非尼片,苏州泽璟生物制药股份有限公司,批准文号:国药准字H20210020,规格:每片100 mg)200 mg口服,bid。
1.3效果评估 疗效:于末次治疗前,根据实体瘤疗效评价标准(response evaluation criteriain solid tumors,RECIST)1.1将疗效评估标准确定为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)或疾病进展(progressive disease,PD)。统计患者生存时间(overall survival,OS),并计算客观缓解率(object response rate,ORR),ORR(%)=(完全缓解+部分缓解)/总例数×100%,疾病控制率(disease control rate,DCR)(%)=(完全缓解+部分缓解+稳定)/总例数×100%。随访时间终止于2022年2月。
安全性:根据2011年《药物不良反应报告和监测管理办法》,报告关联性为肯定、很可能及可能的不良反应。不良反应根据美国国家癌症研究所不良事件通用术语标准(common terminology criteria for adverse events,CTCAE)5.0版本记录。
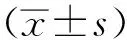
2 结果
2.1患者临床资料 最终纳入患者29例,HACI单独治疗组9例,HAIC联合治疗组20例,平均年龄(53.97±11.89)岁,身体质量指数(body mass index,BMI)(23.06±2.89)kg·(m2)-1。纳入研究的患者病程较晚,肿瘤负荷重,中晚期患者占55.17%(16/29),最大肿瘤直径平均(9.14±4.43) cm,55.17%(16/29)的患者肿瘤数量≥3个,具体见表1。
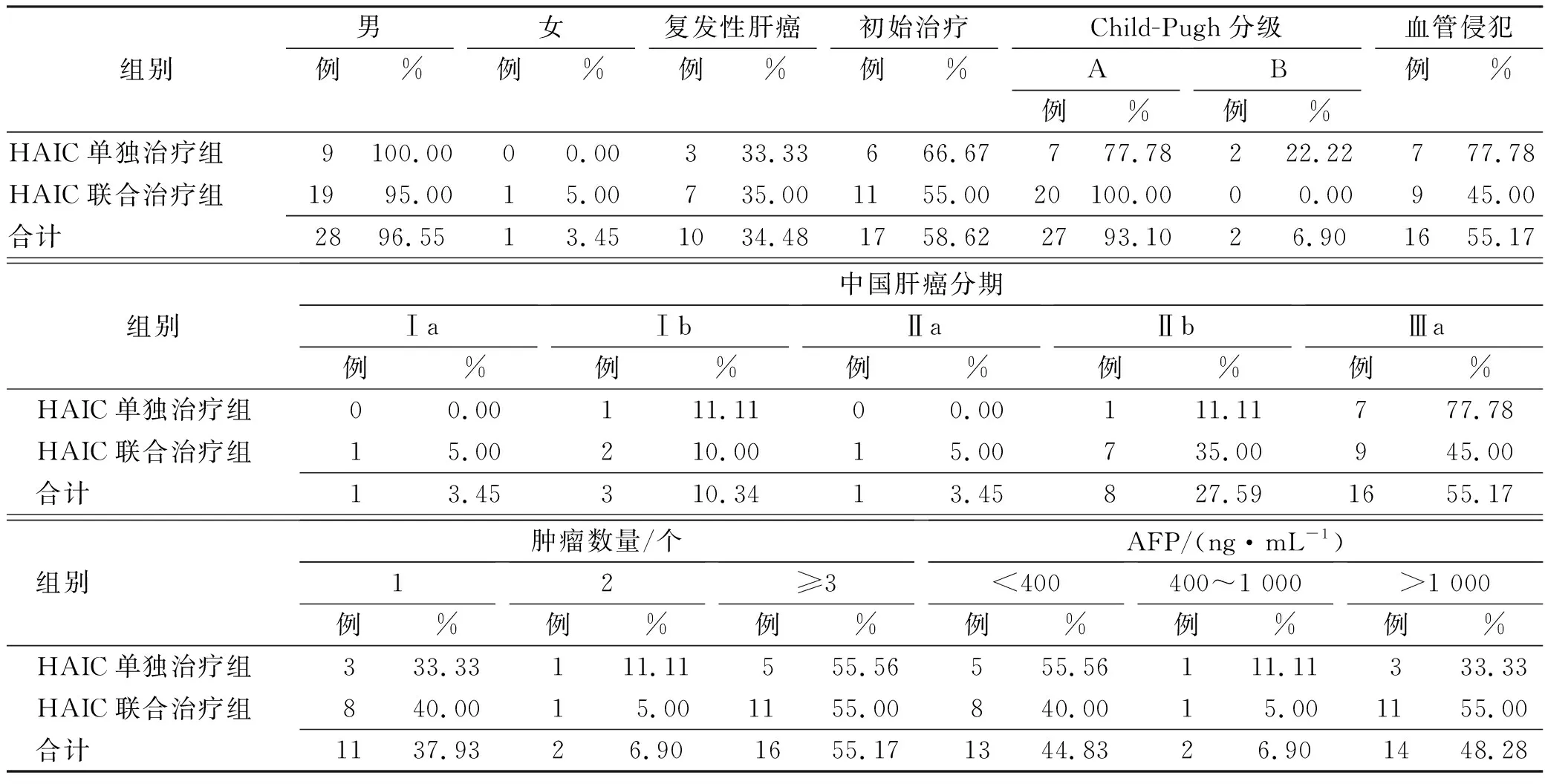
表1 患者临床资料Tab.1 Clinical profile of patients
HAIC治疗相关信息见表2。所有患者共接受HAIC 93个周期,平均(3.21±1.95)个周期[HAIC单独治疗组vs.HAIC联合治疗组,(2.11±0.78)vs.(3.70±1.96),P=0.04]。
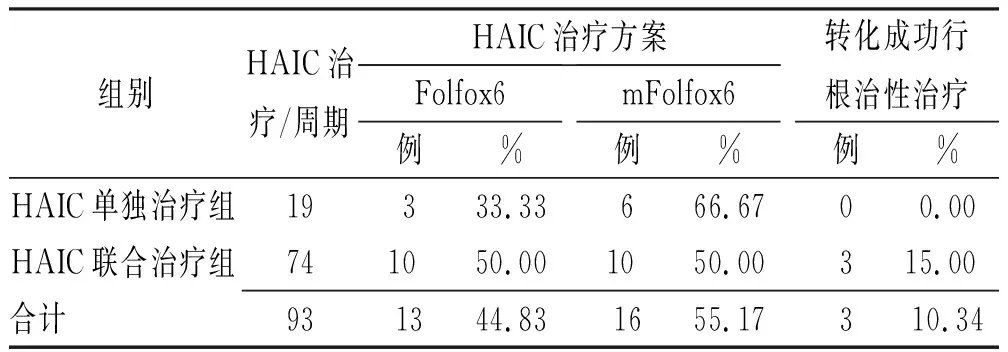
表2 HAIC治疗详情Tab.2 Details of HAIC treatment
2.2疗效 截至2022年2月,29例患者中位随访时间6.4个月(4.3,10.8)。其中转化治疗成功接受肝切除术2例,消融术1例,全部为HAIC联合治疗组患者(表2)。所有患者OS15.9个月[95%CI=(11.4,20.3)],HAIC单独治疗组与HAIC 联合治疗组OS差异无统计学意义(15.1个月vs.14.9个月,P=0.449)。所有患者ORR为34.45%,DCR达89.66%,两组间ORR及DCR差异无统计学意义(ORR 33.33%vs.35.00%,P=1.000;DCR 77.78%vs.95.00%,P=0.220)。
亚组分析显示,CNLC分期Ⅰa-Ⅱa及初始选择基于HAIC治疗、甲胎蛋白(alpha-fetoprotein,AFP)≤200 ng·mL-1患者ORR更高(Ⅰa-Ⅱavs.Ⅱb-Ⅲa 80.00%vs.25.00%,P=0.036;初始治疗vs.非初始治疗52.94%vs.8.33%,P=0.019;AFP≤200 ng·mL-1vs.AFP>200 ng·mL-158.33%vs.16.67%,P=0.045)(表3)。
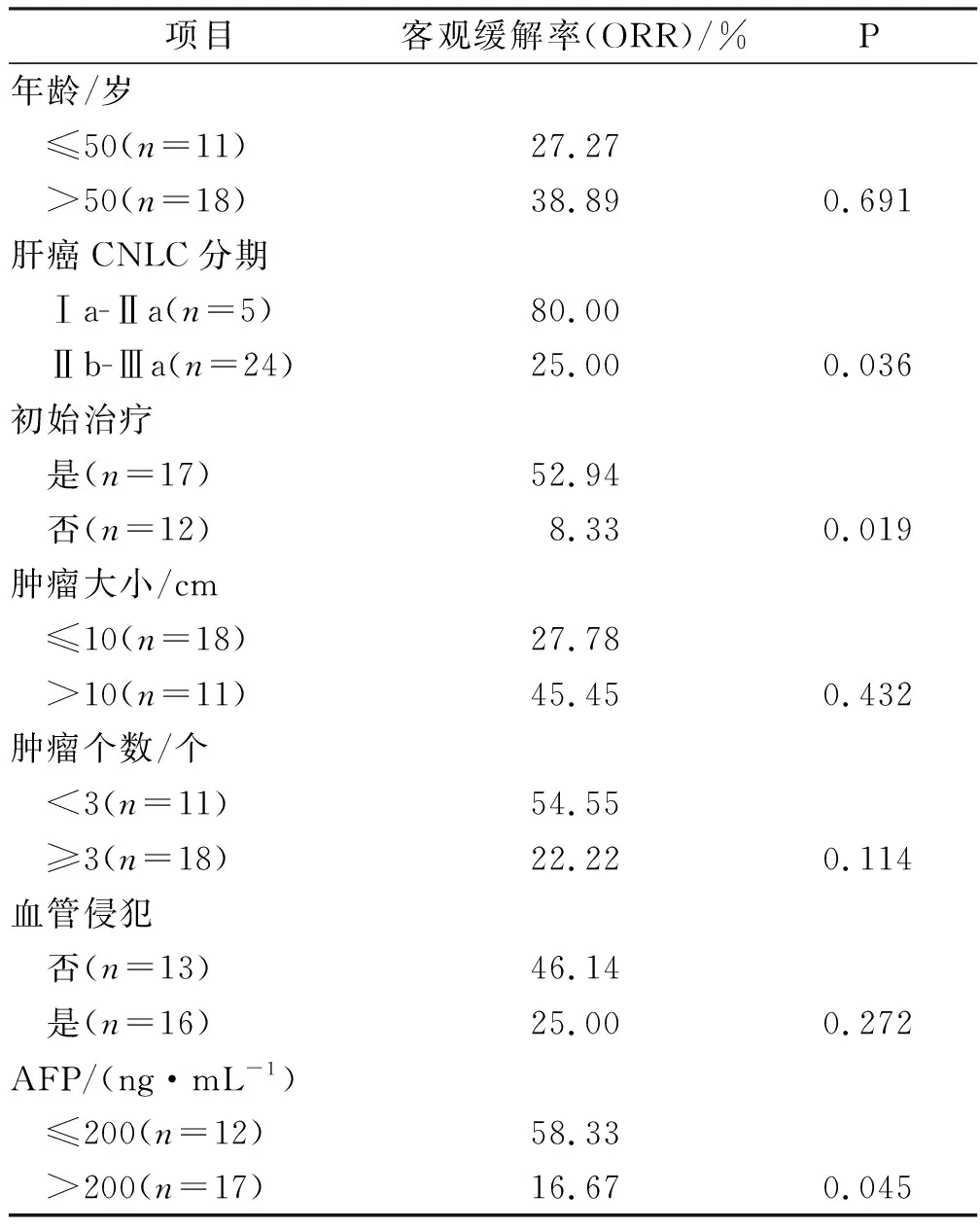
表3 患者治疗转归亚组分析Tab.3 Subgroup analysis of patients' outcomes
2.3安全性 HAIC治疗93个周期发生不良反应78次(83.87%),最常见不良反应为食欲下降(58.06%),全部为轻度;其次为肝损伤(47.31%%),86.36%肝损伤为1或2级;其他药物相关不良反应依次为血小板减少(36.56%)、腹痛(35.48%)等(表4)。
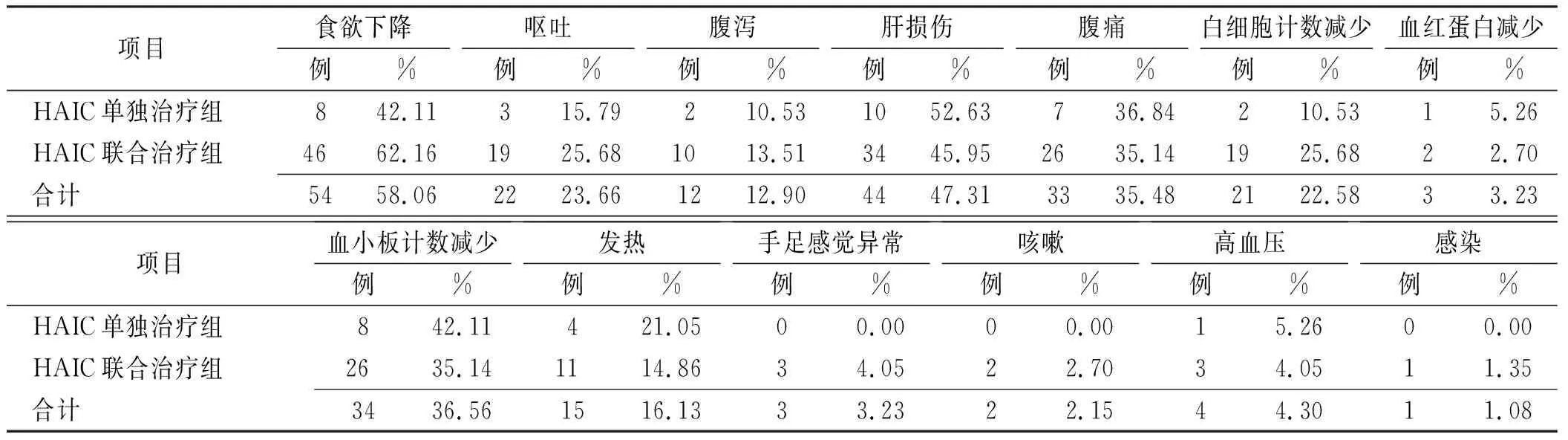
表4 HAIC相关不良反应Tab.4 HAIC-related adverse reactions
3或4级不良反应发生18次(19.35%),发生率最高者为血小板减少(6.45%)和肝损伤(6.45%)。两组3或4级不良反应发生率差异无统计学意义(表5)。
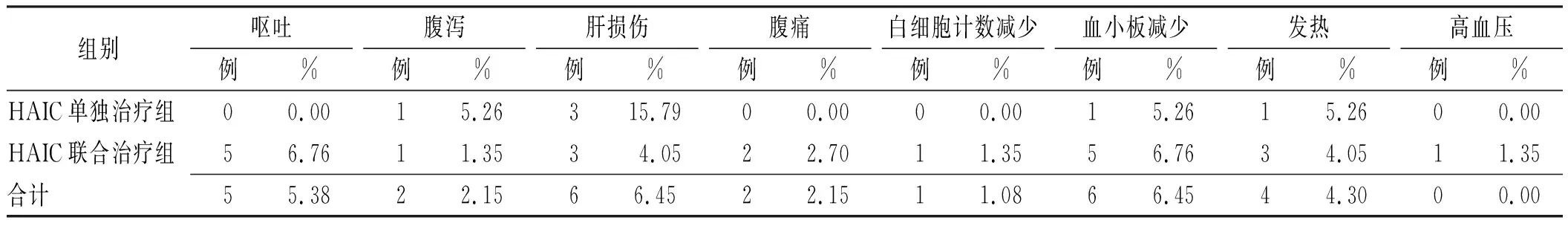
表5 HAIC相关严重不良反应Tab.5 HAIC-related severe adverse reactions
1例患者在首次置入动脉港开始灌注后诉疼痛难忍,经检查发现穿刺处红肿,按压可见液体渗出,考虑港体漏液,迅速暂停灌注。调整动脉港后再次启动灌注化疗未见漏液,治疗顺利。
3 讨论
HAIC具有肝癌组织浓度高、作用时间长、微创、安全等特点,以顺铂为基础的HAIC已被日本肝癌指南推荐为伴门静脉癌栓肝癌的标准治疗[6]。具有中国特色的FOLFOX方案HAIC,在不可切除肝癌患者中的有效性明显优于传统方案。本研究对接受FOLFOX方案的HAIC患者进行回顾性分析,29例患者OS15.9个月[95%CI=(11.4,20.3)],ORR 34.45%,DCR 89.66%,HAIC相关药物不良反应多为轻度不良反应,主要为1或2级食欲下降、肝损伤及血小板减少、腹痛。
3.1联合治疗存在协同作用 中山大学肿瘤防治中心开展的一项回顾性研究显示,180例接受FOLFOX方案HAIC治疗的晚期肝细胞癌患者,OS达到14.5个月,ORR29.4%[7]。本研究中29例接受FOLFOX方案HAIC治疗的肝癌患者OS达15.9个月,ORR34.45%。本研究OS及ORR略优于上述研究结果,可能与研究中68.97%患者接受HAIC联合TKI、PD-1单抗或TKI+PD-1单抗治疗有关。
免疫检查点抑制剂、抗血管生成药和化疗药物的存在协同抗肿瘤作用[8]。奥沙利铂可诱导免疫原性细胞死亡,逆转免疫治疗的耐药性[9]。TKI抗血管生成作用使肿瘤血管正常化并破坏肿瘤的缺氧微环境,从而降低化疗耐药性[10-12];同时可诱导抗肿瘤免疫,并增强免疫检查点抑制剂的疗效[13]。大量临床研究也发现类似结果。一项前瞻性、随机Ⅲ期研究结果表明,基于FOLFOX方案HAIC联合索拉非尼治疗OS达到13.37个月,ORR 40.80%,手术转化成功率12.8%[14],显著优于单独索拉非尼治疗。该中心还回顾性分析了FOLFOX方案HAIC联合仑伐替尼及PD-1单抗(HPL)与仑伐替尼联合PD-1单抗(PL)在晚期肝癌患者中的疗效,HPL组OS达到15.90个月,ORR 40.00%,显著优于PL组[15]。但HAIC联合其他治疗相比于HAIC单独治疗,是否能使不可切除肝癌患者获益的研究较少。因此本研究对HAIC单独治疗组与HAIC联合其他治疗组的疗效进行分析,结果显示两组间OS、ORR、DCR均差异无统计学意义(OS15.1个月vs.14.9个月,P=0.449;ORR33.33%vs. 35.00%,P=1.00;DCR 77.78%vs. 95.00%,P=0.220)。这可能与本研究中位随访时间为6.4个月有关。但HAIC联合其他治疗组的手术转化率达到10.34%,而HAIC单独治疗组没有患者达到手术转化。这提示HAIC联合其他治疗有望改善不可切除肝癌患者的手术转化率。
3.2HAIC治疗的获益人群 对患者进行亚组分析后发现,CNLC Ⅰa-Ⅱa期、初始治疗、AFP≤200 ng·mL-1患者接受HAIC为基础的抗癌治疗,其ORR显著高于其他患者,提示早中期肝癌及肿瘤负荷较轻患者接受HAIC为基础的抗癌治疗疗效更好;初始治疗患者较一线治疗失败后患者更能从以HAIC为基础的抗癌治疗中获益。关于HAIC优势人群的选择,目前研究结果差异较大。徐立等[16]认为单发肿瘤,或局限于肝脏一侧的多发肿瘤,无门静脉主干或下腔静脉癌栓,无肝外转移患者接受HAIC疗效更佳。而UESHIMA等[17]发现在无肝外转移的晚期肝癌患者中,有大血管侵犯患者接受HAIC疗效优于无大血管侵犯患者。
3.3经肝动脉港的HAIC治疗安全性高 有研究认为经动脉港灌注化疗可能导致感染和血栓的风险增加,并且由于无法根据肿瘤主要供血血管变化及时调整而影响治疗效果[2]。但本研究中,86.21%的患者接受经肝动脉港灌注化疗,仅1例患者在经动脉港灌注化疗后出现发热伴炎症指标升高,诊断为感染,无血栓栓塞性疾病发生;同时总体OS、ORR、DCR与既往研究具有可比性[5,7]。由于经肝动脉港灌注大大增加化疗的便利性,提高患者生活质量,可优先作为HAIC用药途径的一种选择。
本研究中HAIC相关药物不良反应主要为1或2级的食欲下降、肝损伤及血小板减少、腹痛,3或4级不良反应主要为血小板减少和肝损伤,与既往研究结果相似性[5,7]。虽然既往研究表明,HAIC治疗可能增加血小板减少、肝损伤的发生率,但这些不良反应是在预期中的,暂停治疗或调整剂量后可缓解。腹痛为HAIC治疗常见的不良反应,主要与奥沙利铂的使用有关,可通过减慢或停止输注缓解。
本研究也存在一定局限。首先,本研究是在单中心进行的回顾性研究,可能导致不可避免的选择偏差;其次,靶向药及免疫检查点抑制剂种类较多,可能影响治疗方案的一致性;第三,病例数量相对较少。这项研究后续应进一步扩展到多中心研究,以获得更高层次的证据。
综上所述,晚期肝细胞癌患者接受HAIC为基础抗癌治疗疗效佳,HAIC联合TKI或(和)PD-1治疗可能提高手术转化率,灌注方式可优先选择经肝动脉港灌注;且患者不良反应可接受,具有较高的临床应用价值。

