ω-3多不饱和脂肪酸防治心律失常临床研究进展
邹海,贺西淦,陈臻瑶,张忠伟,林琼华,申丽华,郑毅隽,朱彪
(1.复旦大学附属肿瘤医院危重症医学科,上海 200032;2.复旦大学肿瘤学系,上海 200032;3.复旦大学附属肿瘤医院肝胆外科,上海 200032;4.复旦大学附属肿瘤医院胸外科,上海 200040)
ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3PUFAs)在海洋生物油中以二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)形式存在,以α-亚麻酸(α-linolenic acid,ALA)形式存在于植物油[1]。据报道,2012年7.8%的美国成年人(1 880万人)在过去30 d内消费了鱼油膳食补充剂[2]。非处方ω-3PUFAs补充剂的主要来源是鱼油,主要由三酰甘油组成[1]。
这些补充剂经常含有其他必需营养素,包括维生素D、维生素E和混合生育酚等[3]。美国农业部最近对ω-3PUFAs补充剂的调查显示,每剂最常见的剂量是EPA180 mg、DHA 120 mg。自20世纪80年代末以来,观察性和干预性研究均表明,ω-3PUFAs摄入可能与降低恶性室性心律失常和心源性猝死(sudden cardiac death,SCD)的风险有关[4]。此外,动物研究证实,ω-3PUFAs对室性、房性心律失常有作用[5-6]。尽管心律失常后果很严重,但安全有效的抗心律失常药物开发仍然举步维艰。几种抗心律失常药物可能增加心肌梗死(myocardial infarction,MI)患者因心律失常死亡的风险[7-8],即使是“最佳”的药物治疗也未能完全抑制这些心律失常[9]。例如,在接受β-肾上腺素受体拮抗剂治疗的MI患者中,一年内死亡率为10%或更高,猝死约占死亡人数的三分之一[9]。在某些高危患者群体中,与目前的药物疗法相比,植入式心律转复除颤器(implantable cardioverter defibrillators,ICDs)已被证明可以降低心源死亡率,为SCD患者提供更好的保护[10-11]。然而,这些设备的使用和维护成本高昂,对患者生活质量产生了负面影响。鉴于ICDs和各种抗心律失常药物相关的不良结果,开发更有效的抗心律失常疗法迫在眉睫。然而,以往对ω-3PUFAs和心律失常的研究笔者很少见到。笔者在探索ω-3PUFAs对心律失常影响的研究基础上,总结ω-3PUFAs防治心律失常的研究及其进展。
1 ω-3PUFAs防治心律失常的相关机制
体外研究证明,ω-3PUFAs可增加动作电位阈值,降低心肌兴奋性,在心肌缺血导致的心律失常或受损细胞尤其明显。此外,动物实验证明,将ω-3PUFAs掺入膜磷脂会改变膜微结构域理化性质,并调节许多细胞功能,包括信号转导、蛋白质转运和离子通道动力学改变在内的许多细胞功能,具有潜在的抗炎和抗心律失常作用[12]。大多数单细胞电生理研究都揭示了其对离子电流的抑制,如快速钠电流[13-14]、超快速激活延迟外向钾电流[15-16]、快速激活延迟整流外向钾电流[17]和L型钙电流[18]。然而,据报道,ω-3PUFAs增强了缓慢激活延迟整流外向钾电流[19]和外向整流钾电流[20]。此外,ω-3PUFAs的进入与线粒体质子泄漏呈正相关[21],其通过脂质运输或饮食干预增加线粒体DHA含量,增强质子运动[22]。因ω-3PUFAs与调节基因表达的几种核受体和转录因子相互作用从而调节各种炎症途径[23-24]。ω-3PUFAs可以拮抗具有促炎作用的前列腺素E2的形成,并减少核因子的激活[25-26]。此外,ω-3PUFAs通过环氧合酶和脂氧合酶衍生的促炎症消退递质以及EPA和DHA代谢产生的单环氧化物发挥抗炎作用。ω-3PUFAs水平的适度增加可能足以诱导活性氧升高,激活随后的抗氧化反应,但不会激活细胞死亡途径[25]。实验动物模型表明ω-3PUFAs可能通过预防丝裂原激活的蛋白激酶激活、减少基质金属蛋白酶活性和连接蛋白再分布逆转心房颤动(房颤)介导的心房结构变化[27-28](图1)。
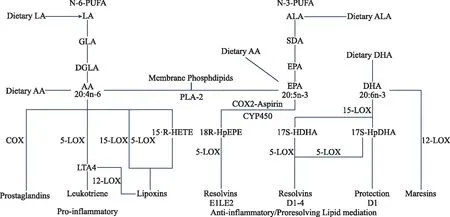
LA:亚油酸;PUFA:多不饱和脂肪酸;GLA:γ-亚麻酸;DGLA:二高γ-亚麻酸;AA:花生四烯酸;COX:环氧合酶;LOX:脂加氧酶;LTA4:白三烯A4;15-R-HETE:15R-羟基二十碳二烯酸;PLA-2:磷脂酶A2;ALA:α-亚麻酸;SDA:亚麻油酸;EPA:二十碳五烯酸;CYP450:细胞色素P450;DHA:二十二碳六烯酸。图1 PUFAs对炎症及脂质代谢作用机制
2 ω-3PUFAs防治心律失常的临床研究
2.1室性心律失常和心脏猝死 GISSI-Prevenzione试验是一项里程碑式的研究,该研究显示,每天服用ω-3PUFAs 1 g的患者在MI后的2年随访中,SCD减少45%[29]。由于SCD通常由室性心律失常引发,因此对SCD的影响可以理解为ω-3PUFA抗心律失常效应,可能的机制已在体外和体内试验被证实[30]。然而,最近有3项具有临床终点的干预试验(Alpha-Omega、OMEGA和SuFOL.OM3)结果并不乐观[31-32],尽管其中一项试验的亚组分析揭示了其对糖尿病患者的保护作用[33],但其他研究并不支持其减少SCD发生。观察研究表明,食用鱼类脂肪与降低SCD风险有关[28],同时细胞膜中低水平ω-3PUFAs与MI后立即心室颤动的风险增加有关[34]。心率变异性是SCD和室性心律失常的已知预测因子,在动物和人类研究中均表明心率变异被ω-3PUFAs正向调节[35]。根据心率变异性数据,ω-3PUFAs似乎能够降低心率,这可能降低心血管死亡率[36-37]。在患有缺血性心脏病(ischemic heart disease,IHD)植入ICD的患者中,CHRISTENSEN等[38]报告了ω-3PUFAs的血清含量与心律失常事件之间的负相关,表明其可能存在抗心律失常效应。就首次心室颤动、室性心动过速或死亡的时间而言,尽管在冠状动脉疾病亚组中可以观察到下降趋势,但对ICD患者的3项大型试验的荟萃分析[39]发现,鱼油没有令人信服的保护作用。在对3项研究中两项数据汇总的亚组分析中,之前患有室性心动过速但没有服用抗心律失常药物的患者在ω-3PUFAs组中表现出更高的室性心动过速/室颤风险趋势。该项研究提示,鱼油对近期MI的患者发生室性心动过速有保护作用,其原因可能是鱼油能预防由触发激动和动作电位延长为主要机制的患者发生心律失常。最近,GISSI心力衰竭试验的子研究[40]涵盖了566例植入ICD的心力衰竭患者,结果显示实验组发生室性心动过速/心室颤动比例有下降趋势,差异无统计学意义。对ICD放电数量进行分层分析时,也观察到类似趋势。总体而言,这些ICD研究中对ω-3PUFAs的反应异质性可以用不同的研究人群,以及心律失常(缺血性/非缺血性)的起源来解释。ω-3PUFAs已在3项小型研究中进行了测试,第一项研究包括植入ICD患者10例,研究规模小且为非盲,没有安慰剂组[41]。可诱发室性心动过速的7例患者中,有5例患者在静脉输注ω-3PUFAs后不再可诱导。在METCALF等进行的一项研究中[42],12例诱导性室性心动过速患者每天接受ω-3PUFAs0.9 g治疗,持续6周。治疗后,与14例对照患者相比,5例患者不再发生室性心动过速,但差异无统计学意义。最近,MADSEN等[43]进行了一项随机、安慰剂对照、交叉设计的研究,其中包括6例植入ICD患者,随机输注ω-3PUFAs3.9 g或安慰剂,在安慰剂组可诱发室性心动过速的5例患者中,2例患者经过ω-3PUFAs处理后不再发生,2例患者需要更强的刺激才能诱发室性心动过速。总体来说,尽管对植入ICD患者进行的研究规模小,但结果表明静脉注射和长期口服补充ω-3PUFAs可能降低室性心动过速的风险(表1)。
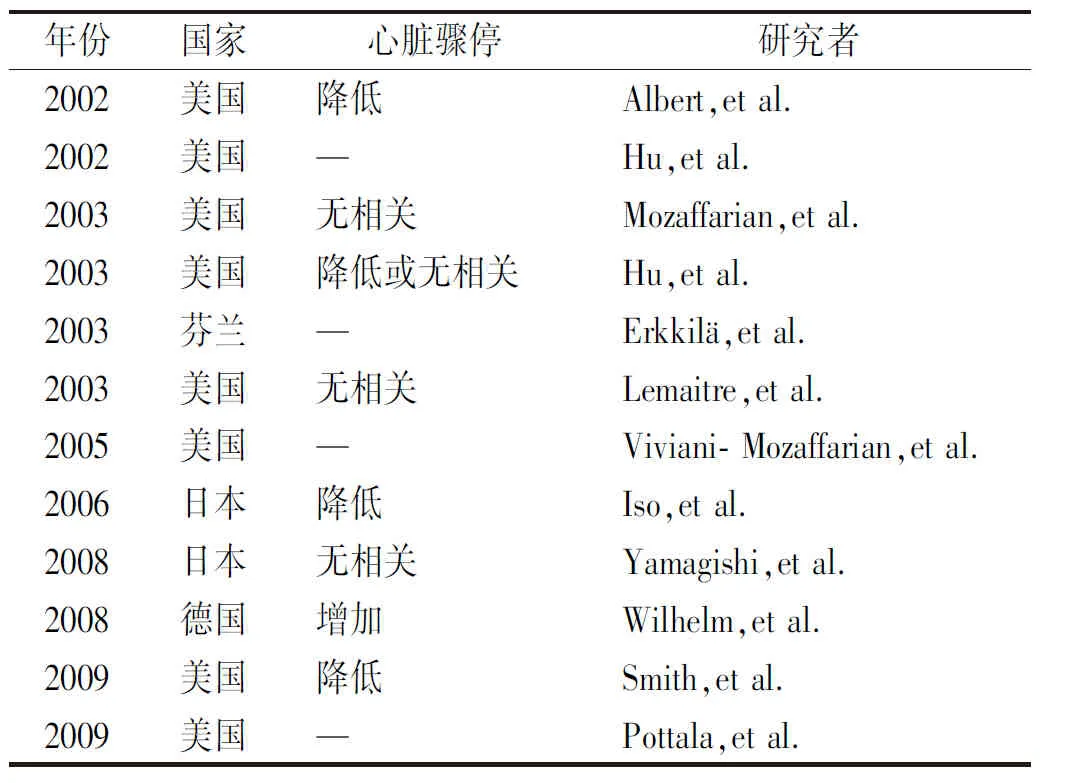
表1 ω-3PUFAs对心脏骤停的影响Tab.1 Effect of omega-3 polyunsaturated fatty acids on sudden cardiac arrest
2.2房颤 房颤是最常见的心律失常类型,当心房组织电生理异常时就会发生心律失常。房颤增加了卒中和心力衰竭发病率,其发生率随着人口的老龄化而增加[44-46]。根据2010年欧洲心脏病学会的指南,由于缺乏足够的证据,不建议将ω-3PUFAs用于预防房颤[47]。然而近年来,有报道称,ω-3PUFAs可以降低各种情况下的房颤发病率,如冠状动脉旁路移植[48-50]、心力衰竭[51],以及房颤复律[52]。
此外,ω-3PUFAs已被证明主要通过抑制房颤的快速局灶性异位放电来防止房颤的诱导和持续[27,53-54]。KUMAR等[53]报道,人类补充ω-3PUFAs可以降低对诱发性房颤的易感性。长期补充ω-3PUFAs的房颤患者表现出延长肺静脉、左心房有效不应期(effective refractory periods,ERPs),以及对肺静脉 (pulmonary veins,PVs)内起搏的敏感性降低[54]。DA等[27]还报道ω-3PUFAs治疗可预防快心率状态下心房电重构,能延长房颤的ERP。进一步研究表明,ω-3PUFAs治疗后ERP延长至少部分通过以浓度依赖性方式抑制人心房钾电流和电压门控钠电流而发生[15]。此外,MORENO等[55]发现ω-3PUFAs可以抑制ERP缩短活动的触发来发挥抗心律失常作用。
补充ω-3PUFAs可以降低心脏手术后各种情况下房颤发生率。ω-3PUFAs可以减少心房纤维化、肥大和炎症,并减少心房增大。ω-3PUFAs预处理可提高持续性房颤复律患者的心房排空速度,降低复律后的心房机械顿抑[56]。关于ω-3PUFAs预防心脏手术后房颤的有效性,相关研究提供了相互矛盾的结果[48,57]。也有报道ω-3PUFAs减少结构性心房重构,容易导致房颤发生发展[58]。尽管这些研究大多报道了ω-3PUFAs对术后房颤的影响[59-60],就心脏手术前的预处理而言,ω-3PUFAs难以充分渗入心肌肌膜[60]。DHA治疗在降低术后房颤发生率方面似乎比EPA治疗更有效[61]。一项荟萃分析显示,EPA/DHA比例为1/2可以产生积极结果,而其他使用较小比例的DHA对术后房颤预防没有显著影响[62]。进一步设计良好的研究需要在心脏手术前至少1个月给予足量ω-3PUFAs预处理,以及使用DHA含量高的制剂来得出更明确的结论。然而,在心脏手术前使用ω-3PUFAs进行充分预处理十分困难,因为通常需要手术的心脏疾病,其严重程度不允许在其诊断和手术之间有太多延迟。
ω-3PUFAs对心衰患者预防房颤发生的作用尚未得到充分研究。在GISSI-心衰试验中,慢性心衰患者在心衰推荐治疗的基础上,被分配到接受ω-3PUFAs 1 g或安慰剂治疗组[51]。尽管ω-3PUFAs基线水平和房颤发生存在反比关系,但这项研究显示,对于慢性心衰患者来说,按1 g·d-1剂量补充ω-3PUFAs并不能降低房颤发病率。这一发现的可能解释是,ω-3PUFAs对慢性心衰房颤发展的治疗可能受到肾上腺素能和肾素-血管紧张肽系统在促进心律失常心房重塑方面的主导作用的限制。需要进一步的研究来阐明ω-3PUFAs治疗在预防心衰患者房颤中的作用。MACCHIA等[63]报道了ω-3PUFAs能降低MI后1年内房颤的发生率,但其抑制MI后房颤发作的实际疗效和潜在机制仍不清楚(表2)。
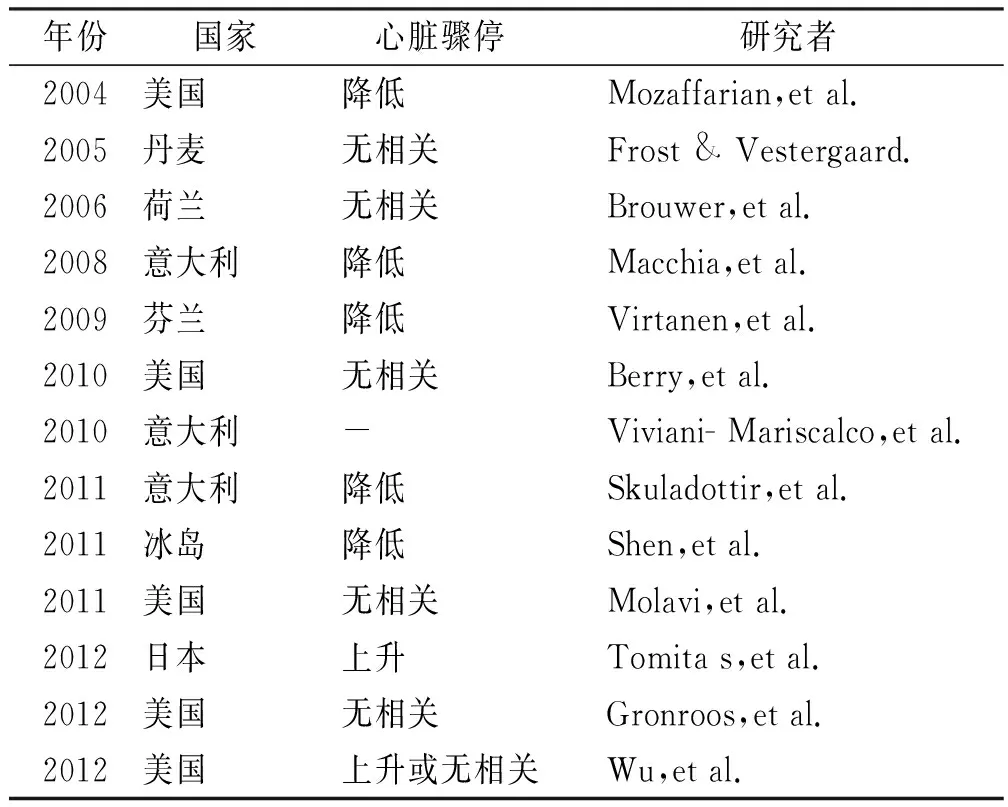
表2 ω-3PUFAs对心房颤动的影响Tab.2 Effect of omega-3 polyunsaturated fatty acids on atrial fibrillation
3 ω-3PUFAs防治心律失常的展望
尽管目前尚不能解释ω-3PUFAs改善心律失常的确切机制,但许多研究显示ω-3PUFAs对室性心律失常、SCD以及房颤等有一定治疗作用(例如,其可以减轻炎症和纤维化,影响自主神经张力和心率,延长心房和肺静脉细胞的不应期)。此外,虽然ω-3PUFAs是一种必需脂肪酸,是细胞膜的重要组成部分,但ω-3PUFAs在细胞膜和心房细胞膜中能够发挥保护作用的有效剂量可能较窄且只在特定条件下起效。实验数据表明,ω-3PUFAs与房颤发生风险之间存在U型曲线关系[64]。此外,ω-3PUFAs可能在房颤的早期阶段,尤其是在心房发生高级重构之前更有效。尽管ω-3PUFAs在减少术后房颤方面的应用仍有争议,但其可以缩短住院时间、重症监护室住院时间,减少术后并发症。
此外,ω-3PUFAs具有强大的电生理作用,可抑制各种离子通道和钙调节蛋白。然而,临时使用与离子通道直接结合,长期服用整合入细胞膜,通过改变细胞膜特性间接作用,所以具有截然不同的电生理作用。
尽管有强有力的流行病学证据表明ω-3PUFAs摄入量与心源性死亡率呈负相关,并且先前的临床预防试验结果非常令人鼓舞,但最近的研究未能证实这些早期研究,即未发现ω-3PUFAs与SCD相关。事实上,一些研究表明ω-3PUFAs升高了心绞痛患者的死亡率,并且在局部心肌缺血离体猪心脏和SCD犬模型中反而升高了恶性心律失常发生率。但ω-3PUFAs可以抑制心力衰竭患者和动物模型心肌细胞去极化后的延迟,并阻止触发活动。因此,ω-3PUFAs既可促进心律失常,也可抗心律失常,这取决于潜在的心律失常机制。
4 结束语
大多数数据支持ω-3PUFAs可以防止室性心律失常的观点,并且有越来越多的证据表明ω-3PUFAs对预防和治疗房颤有影响。然而,就ω-3PUFAs预防房颤、室性心律失常和SCD的疗效而言,上述相关研究的结果在某种程度上是相互矛盾的。这种差异可以部分归因于这些研究方法的局限性。因此,仍需要进一步进行大样本大规模、设计严谨的随机对照研究,以确定其疗效和确定哪些患者更有可能从ω-3PUFAs中受益,以及其最佳剂量和治疗时间。

