氟西汀联合舒肝解郁胶囊治疗抑郁症的效果及对患者心率变异性的影响
赵媛媛,吴 倩,刘 波,郭 飞,刘 聪,谢艳利,杨世昌,3*
(1. 新乡医学院第二附属医院,河南 新乡 453002;2. 大连医科大学,辽宁 大连 116044;3. 新乡医学院精神疾病中西医结合临床中心,河南 新乡 453002 *通信作者:杨世昌,E-mail:yangshch2000@163.com)
抑郁症是一种常见的精神疾病,根据世界卫生组织报告,全球约3.5亿抑郁症患者,每年自杀死亡人数高达100 万人,预计到2030 年,抑郁症将成为全球首位高负担疾病[1]。抑郁症主要表现为情绪低落、思维迟缓、兴趣缺乏等核心症状群以及入睡困难、觉醒次数增多、早醒、食欲减退、精力减退及多汗、心悸以及胃肠道不适等非特异性躯体症状。在我国,抑郁症患者常因躯体化问题就诊,伴躯体症状的抑郁症常被躯体症状所掩盖而更易被误诊[2]。Wang 等[3]研究表明,抑郁症是伴随着心脏自主神经系统功能紊乱、并存在一系列生理和病理改变的疾病。抑郁症患者的自主神经功能评价对临床诊断及治疗具有重要意义。目前,临床主要通过心率变异性(Heart rate Variability,HRV)分析,HRV 分析是目前国际上公认的一种无创性检测与评价心脏动态活动变化及其自主神经功能的常用方法[4-5],可以客观反映人体自主神经系统,即交感神经和迷走神经平衡与张力程度的重要指标[6-9]。
目前,抑郁症的治疗以药物治疗为主,临床应用较广泛的是SSRIs类和SNRI类药物。氟西汀常作为抑郁症治疗的一线用药[10-13],但其副作用较多[14]。近年来,部分学者尝试从中医药入手治疗抑郁症[15]。舒肝解郁胶囊是第一个被国家食品药品监督管理总局批准用于治疗轻中度抑郁症的中成药[16],其与5-HT1受体结合,上调5-HT1A受体表达,引起细胞内钙离子浓度的增加,诱导钙离子依赖性的5-HT 释放[17-18],进而发挥抗抑郁作用。本研究通过随机对照试验,探讨氟西汀联合舒肝解郁胶囊对抑郁症的临床疗效,比较氟西汀联合舒肝解郁胶囊与单用氟西汀的疗效以及对患者心率变异性的差异,为抑郁症的临床用药提供参考。
1 对象与方法
1.1 对象
选取2015 年12 月-2016 年6 月在新乡医学院第二附属医院门诊就诊和住院治疗的抑郁症患者为研究对象。入组标准:①年龄18~45岁;②西医诊断标准符合《精神障碍诊断与统计手册(第5 版)》(Diagnostic and Statistical Manual of Mental Disorders,fifth edition,DSM-5)抑郁症诊断标准,中医诊断符合《中医内科学》郁证肝郁脾虚型诊断标准,中医和西医诊断均由两名副主任医师以上职称的医师联合诊断;③汉密尔顿抑郁量表24 项版(Hamilton Depression Scale-24 item,HAMD-24)评分≥21 分;④血常规、尿常规自动分析、十八导联心电图、肝肾功能、胸部正侧位片检查结果均正常。排除标准:①患有脑器质性精神障碍者、严重躯体疾病或严重肝肾功能损害者;②继发于其他精神疾病或躯体疾病的抑郁症,双相情感障碍抑郁发作患者及伴有抑郁症状的精神分裂症患者,有严重自伤、自杀行为及企图者;③2 周内服用过解热镇痛药、β 受体阻滞剂、镇静催眠药、胆碱能和多巴胺类等可能影响自主神经功能药物的患者;④1 个月内接受过抗抑郁药物治疗的患者;⑤汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)评分≥29 分;⑥妊娠期和哺乳期患者;⑦对所用药物过敏者;⑧无人监护或不能按医嘱服药者。剔除标准:①资料不全,无法进行疗效和安全性评估的患者;②发生严重不良反应或因其他原因不能完成整个研究的患者。符合入组标准且不符合排除标准共64例,采用随机数字表法分为联合用药组(舒肝解郁胶囊联合氟西汀)和氟西汀组各32 例。本研究通过新乡医学院第二附属医院伦理委员会批准(伦理审批号:1702042),所有受试者均签署知情同意书。
1.2 治疗方法
两组患者均接受口服盐酸氟西汀分散片(PATHEON FRANCE/礼来苏州制药有限公司分装,批号:5169AA,规格20 mg/片)治疗,每日1 次,每次20 mg。治疗期间避免服用其他抗抑郁药物或影响心率变异性的药物。联合用药组在此基础上联用舒肝解郁胶囊(成都康弘药业集团股份有限公司,批号:20140909,规格0.36 g/粒),0.72 g/次,早晚各一次。两组药物治疗均持续6周。
1.3 评定工具
采用自编问卷收集患者的基本信息,包括年龄和性别。
于治疗前和治疗第2、4、6周末,采用HAMD-24[19]评定患者抑郁症状。大部分条目采用0~4 分5 级评分,少数条目采用0~2 分3 级评分。HAMD-24 包括睡眠障碍、迟缓、体重、日夜变化、焦虑/躯体化、认知障碍和绝望感7个因子。总评分越高表明抑郁症状越严重。本研究中,该量表Cronbach’sα系数为0.880,各因子Cronbach’sα系数均高于0.80。
于治疗前,采用HAMA[20-21]评定患者焦虑症状。HAMA 共14个条目,包括精神性焦虑和躯体性焦虑两个分量表。采用0~4分5级评分,总评分越高表明焦虑症状越严重。本研究中,该量表Cronbach’sα系数为0.90,两个分量表Cronbach’sα系数均高于0.80。
于治疗前和治疗第6 周末,采用加拿大Medeia公司精神压力分析系统进行HRV 分析。本研究主要选取时域指标和频域指标进行研究,时域指标包括24 小时平均正常RR 间期标准差(standard deviation of normal RR intervals,SDNN);频域指标包括标化高频功率(normal high frequency,nHF)、标化低频功率(normal low frequency,nLF)以及低频功率与高频功率之比(LF/HF)。
于治疗第2、4、6 周末,采用副反应量表(Treatment Emergent Symptom Scale,TESS)[22]评定不良反应发生情况。该量表共34 个条目,包括6 组症状:自主神经系统症状、实验室相关检查结果、行为毒性、植物神经系统、心血管系统及其他。根据症状严重程度,采用0~4 分5 级评分,评分越高表明不良反应越严重。
1.4 评定方法和质量控制
由新乡医学院第二附属医院两名接受过一致性培训的临床主治医师对患者进行一对一量表评定,每名患者评定耗时20~30 min。由于两组患者服用的药物类型和药物数量不同,无法对患者和操作者严格设置盲法,仅对结局评价者和统计分析者实施盲法。操作者、结局评定者及统计分析者相互独立。
1.5 疗效评定
以治疗第6 周末HAMD-24 总评分减分率判断临床疗效,减分率=[(治疗前评分-治疗后评分)/治疗前评分]×100%。减分率<25%为无效,25%≤减分率≤50%为好转,50%<减分率≤75%为显效,减分率>75%为痊愈。
1.6 统计方法
采用SPSS 21.0 进行统计分析。计数资料以[n(%)]表示,符合正态分布的计量资料以(±s)表示。两组治疗前后HAMD-24 评分和HRV 分析结果比较采用重复测量方差分析;两组疗效比较采用χ2检验;两组不良反应比较采用Fisher 确切概率检验。双尾检验,检验水准α=0.05。
2 结 果
2.1 基本资料
本研究共纳入64 例抑郁症患者,在研究过程中,联合用药组的1 例患者在治疗初始阶段因胸部正侧位片异常而剔除,1 例患者在治疗4 周时因依从性差而脱落;氟西汀组中,2 例患者在治疗4 周时因依从性差脱落。共60 例患者完成研究,两组各30 例。男性29 例(48.33%),女性31 例(51.67%)。两组性别、年龄、HAMA 评分、HAMD-24 评分以及HRV 分析指标差异均无统计学意义(P均>0.05)。见表1。
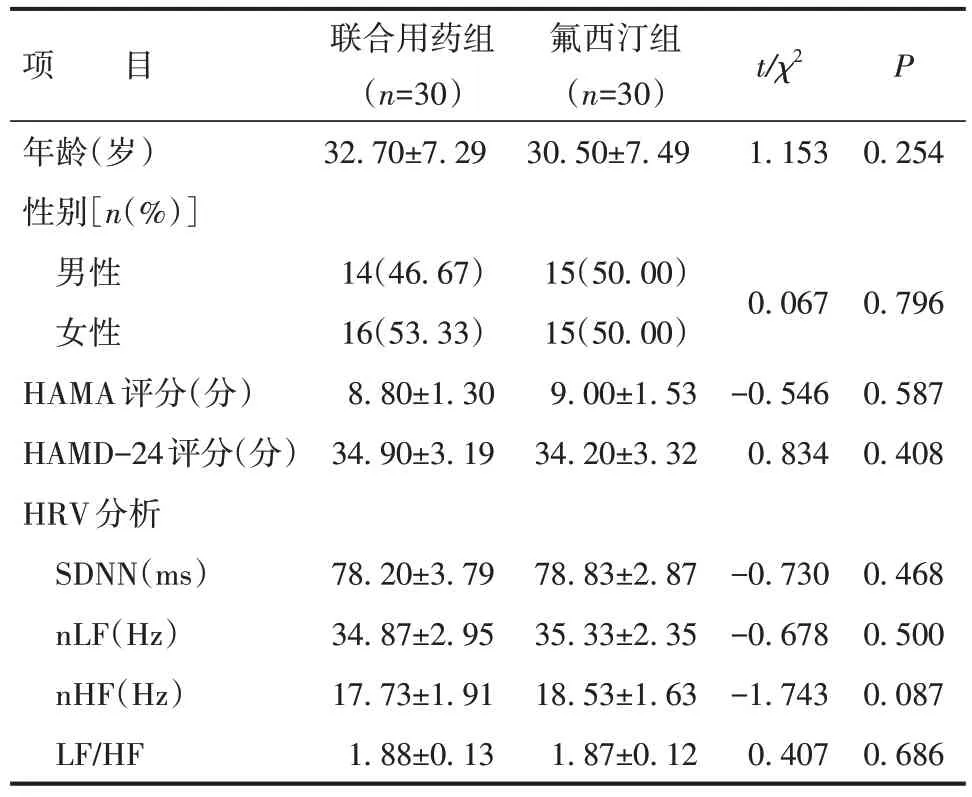
表1 两组基本资料比较Table 1 Comparison of baseline data between the two groups
2.2 两组治疗前后HAMD-24评分比较
治疗前和治疗第2、4、6 周末,两组HAMD-24评分时间效应有统计学意义(F=296.285,P<0.01),组别效应有统计学意义(F=2 629.137,P<0.01),时间与组别的交互效应有统计学意义(F=12.964,P<0.01)。
单独效应分析结果显示,治疗第2、4、6周末,联合用药组HAMD-24评分均低于氟西汀组(t=-2.677、-3.960、-4.432,P<0.05 或0.01),且治疗后两组HAMD-24 评分均低于治疗前,差异均有统计学意义(P<0.05或0.01)。见表2。
表2 两组治疗前后HAMD-24评分比较(±s,分)Table 2 Comparison of HAMD-24 score between the two groups before and after treatment
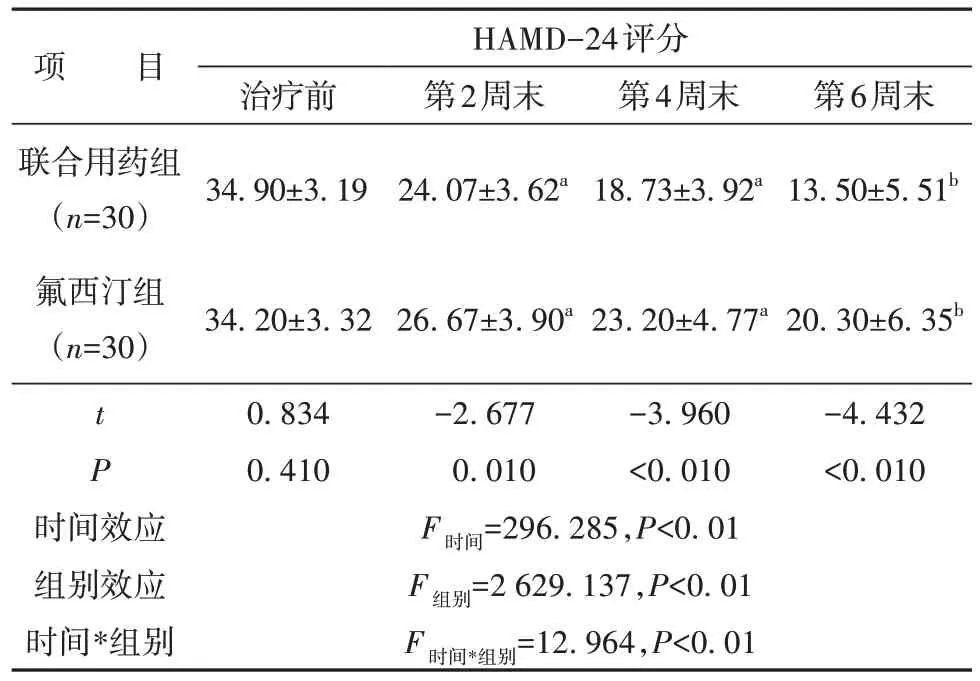
表2 两组治疗前后HAMD-24评分比较(±s,分)Table 2 Comparison of HAMD-24 score between the two groups before and after treatment
注:HAMD-24,汉密尔顿抑郁量表24 项版;与治疗前相比,aP<0.05,bP<0.01
项 目HAMD-24评分治疗前联合用药组(n=30)氟西汀组(n=30)34.90±3.19第2周末24.07±3.62a第4周末18.73±3.92a第6周末13.50±5.51b 34.20±3.32 26.67±3.90a 23.20±4.77a 20.30±6.35b t P 0.834 0.410-2.677 0.010-3.960<0.010-4.432<0.010时间效应组别效应时间*组别F时间=296.285,P<0.01 F组别=2 629.137,P<0.01 F时间*组别=12.964,P<0.01
2.3 两组治疗前后HRV分析结果比较
治疗前和治疗第6 周末,两组SDNN 的时间效应、组别效应以及时间与组别的交互效应均有统计学意义(F=333.130、4.153、6.123,P均<0.05 或0.01),两组nLF和nHF的时间效应均有统计学意义(F=240.732、178.232,P均<0.01)。
单独效应分析结果显示,与治疗前相比,治疗第6 周末,联合用药组SDNN、nLF 与nHF 均较高(t=-73.970、-31.878、-38.721,P均<0.05),而LF/HF较低(t=3.525,P<0.05);氟西汀组治疗第6 周末时SDNN、nLF、nHF 均高于治疗前(t=-12.172、-14.579、-13.328,P均<0.05),而LF/HF 与治疗前相比差异无统计学意义(t=0.815,P>0.05)。治疗第6 周末,联合用药组SDNN、nLF 与nHF 均高于氟西汀组(t=3.187、3.323、5.393,P均<0.01),而LF/HF 低于氟西汀组(t=-2.754,P<0.01)。见表3。
表3 两组治疗前后HRV分析结果比较(±s)Table 3 Comparison of HRV analysis scores between the two groups before and after treatment
注:SDNN,正常RR间期标准差;nLF,标化低频功率;nHF,标化高频功率;LF/HF,低频功率与高频功率之比;与治疗前相比,aP<0.05;联合用药组与氟西汀组相比,bP<0.05
LF/HF 1.88±0.13 1.77±0.10ab 1.87±0.12 1.84±0.11 1.622>0.050 1.047>0.050 1.048>0.050组 别联合用药组(n=30)氟西汀组(n=30)时 间治疗前治疗第6周末治疗前治疗第6周末时间效应F时间P组别效应F组别P时间*组别F时间*组别P SDNN(ms)78.20±3.79 85.37±3.85ab 78.83±2.87 82.63±2.70a 333.130<0.010 4.153<0.050 6.123<0.010 nLF(Hz)34.87±2.95 40.67±2.56ab 35.33±2.35 38.73±1.89a 240.732<0.010 0.689>0.050 2.270>0.050 nHF(Hz)17.73±1.91 23.03±1.71ab 18.53±1.63 20.87±1.38a 178.232<0.010 0.016>0.050 1.497>0.050
2.4 两组疗效比较
治疗第6周末,联合用药组痊愈8例(26.67%),显效17 例(56.67%),好转1 例(3.33%),无效4 例(13.33%)。氟西汀组痊愈3 例(10.00%),显效6 例(20.00%),好转12例(40.00%),无效9例(30.00%)。联合用药组总有效率高于氟西汀组,差异有统计学意义为(86.67% vs. 70.00%,χ2=18.764,P<0.01)。
2.5 两组不良反应比较
治疗第2 周末,联合用药组出现4 例口干(均为轻度),3例心动过速(1例中度、2例重度);氟西汀组出现5 例口干、出汗(均为轻度),2 例鼻塞(中度),1 例头晕(重度)。两组不良反应的例数差异无统计学意义(P>0.05)。
治疗第4 周末,联合用药组出现4 例口干(1 例轻度、1 例中度、2 例重度);氟西汀组出现3 例失眠、口干和出汗(其中轻度、中度、重度各1例)。两组不良反应的例数差异无统计学意义(P>0.05)。
治疗第6 周末,联合用药组出现1 例血压下降(轻度),2 例食欲减退(中度);氟西汀组出现4 例便秘、血压降低和心动过速(其中2 例轻度、1 例中度、1 例重度)。两组不良反应的例数差异无统计学意义(P>0.05)。见表4。
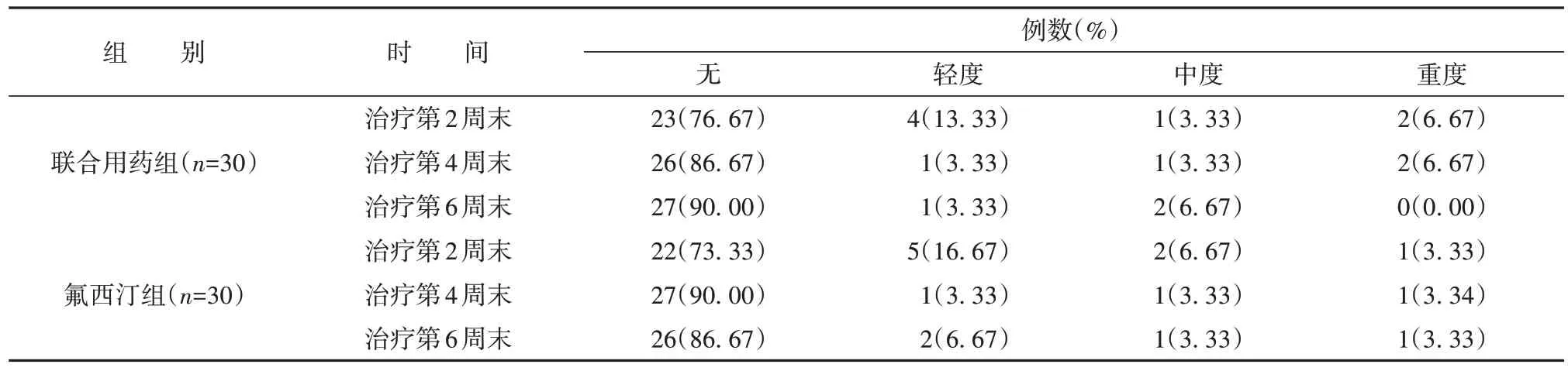
表4 两组不良反应发生情况比较Table 4 Comparison of the occurrence of adverse reactions between the two groups
3 讨 论
本研究结果显示,治疗第2、4、6周末,氟西汀组及联合用药组HAMD-24 评分均低于治疗前,联合用药组HAMD-24 评分均低于氟西汀组,差异均有统计学意义。提示氟西汀联合舒肝解郁胶囊以及单用氟西汀均有助于改善抑郁症患者的临床症状,且联合治疗效果更佳,与张美霞等[23]研究结果一致。治疗第2、4、6 周末,两组不良反应例数差异均无统计学意义,提示氟西汀联合舒肝解郁胶囊与单用氟西汀的安全性相当。治疗第6 周末,联合用药组在改善HRV 方面的效果均优于治疗前,提示氟西汀联合舒肝解郁胶囊对改善抑郁症患者心率变异性方面的效果可能优于单用氟西汀。本研究中,联合用药在改善患者心率变异性方面效果较好的原因可能是舒肝解郁胶囊可以促进自主神经系统对心血管的生理调节作用,从而维持或恢复副交感神经与交感神经的平衡[24],改善患者的心率变异性。既往研究也表明,中西医结合治疗抑郁症的临床疗效优于单用中成药或西药[25-27],患者的抑郁症状改善,其心率变异性也随之改善,与王优等[28]研究结果一致,即HRV减弱程度与抑郁症状严重程度密切相关。
本研究中,在患者抑郁症状的改善方面,氟西汀组治疗有效的原因可能是氟西汀通过选择性地抑制5-HT 转运体,阻断突触前膜对5-HT 的再摄取,从而产生抗抑郁作用[10-12]。而联合用药组效果较好的原因可能是在氟西汀作用的基础上,舒肝解郁胶囊通过激活瞬时受体电位通道,抑制5-HT、多巴胺、去甲肾上腺素等单胺类神经递质的再摄取,达到调节神经递质水平的作用,还可改善神经元突触可塑性,发挥抗抑郁作用[29]。氟西汀与舒肝解郁胶囊均通过提高神经突触间隙中5-HT 浓度,产生协同作用,从而更好地改善抑郁症状。舒肝解郁胶囊的主要成分为贯叶金丝桃和刺五加,贯叶金丝桃具有疏肝解郁、清热利湿的作用,刺五加具有益气健脾、镇静安神的作用,两者联合可发挥养心安神、疏肝解郁的功效,进而改善抑郁症状。
综上所述,氟西汀联合舒肝解郁胶囊与单用氟西汀均有助于改善抑郁症患者的抑郁症状和心率变异性,且安全性相当,但联合治疗效果更佳。本研究局限性:对盲法无法严格控制,样本量较小,且样本来源相对局限,所得结论仅能反映本区域内抑郁症患者的治疗效果。今后可开展多中心、大样本研究并进行分析,以获得更加可靠的证据支持。

