肠道菌群与儿童肥胖发病机制的研究进展
朱彤彤, 叶进
2017年,《新英格兰医学杂志》指出在195个国家中,中国和印度是肥胖儿童人数最多的国家[1]。2020年,《中国居民营养与慢性病状况报告》指出我国6岁以下、6~17岁儿童及青少年超重及肥胖率为10.4%和19%[2]。儿童肥胖与青春期发育提前、心血管疾病、睡眠呼吸暂停密切相关[3-5],其发病机制除遗传因素外,与营养不均衡、长期久坐、内分泌干扰物等有关[6-8]。近年来诸多研究阐述肠道菌群参与宿主炎症反应,调控进食行为和生物钟相关基因表达,影响能量稳态,从而导致肥胖,因此本文就当前肠道菌群与儿童肥胖发病机制的研究进展作一综述。
1 肠道菌群与儿童肥胖
1.1 生命早期肠道菌群的建立 生命早期是人体可塑性最强的阶段,也是生长发育的重要时期,肠道菌群在调节婴儿神经、免疫系统发育方面发挥关键作用[9]。据统计,人体肠道内含有3.9×1013个细菌,与人体细胞数目接近,编码的基因数是人类基因组的150倍[10-11]。目前科学界关于肠道菌群何时形成的观点尚不统一,Aagaard等[12]通过基因测序发现胎盘中存在微生物,在羊水、脐带血和胎粪中也陆续检测到细菌DNA,形成“子宫内定植”假说[13]。此后研究指出细菌源于测序过程中的交叉污染,为“子宫是无菌环境”的观点提供有力证据[14-15]。出生后,肠道菌群的建立主要与分娩及喂养方式、抗生素暴露有关,随着饮食结构的调整,3岁时儿童肠道菌群结构及丰度与成人相似,并趋于稳定[16]。
研究表明剖宫产、配方奶喂养及早期抗生素暴露增加儿童肥胖的发病风险[17-19]。剖宫产分娩的婴儿由于最先接触母亲皮肤,其肠道中葡萄球菌、链球菌、克雷伯菌等机会致病菌较多,拟杆菌和双歧杆菌定植延迟,菌群稳定性降低[20-21]。配方奶缺乏母乳中的人乳低聚糖、分泌型免疫球蛋白A等生物活性物质,婴儿肠道中毛螺菌科丰度较高,双歧杆菌属丰度较低[18]。抗生素破坏肠道生态平衡,导致肠道中粪杆菌属、克雷伯菌属丰度增高,动物实验表明抗生素早期暴露的小鼠脂肪含量和胰岛素抵抗指数较对照组增加[22]。
1.2 肥胖儿童肠道菌群结构特征分析 Turnbaugh等[23]将ob/ob小鼠的肠道菌群灌胃到无菌小鼠后发现无菌小鼠体脂增加,表明肥胖小鼠的肠道菌群能从饮食中获取更多能量。Ley等[24]检测发现肥胖者肠道中厚壁菌门增多,拟杆菌门减少,但该观点仍存在争议[25-27]。随着研究深入,肠道菌群与儿童肥胖的相关性逐渐受到重视,近3年诸多研究指出肥胖儿童肠道菌群与正常体质量儿童存在差异(表1)。考虑到种族、地区以及没有控制分娩及喂养方式等重要协变量的因素,这些研究并没有指出肥胖儿童所特有的菌群结构特征,但总体来说,肥胖儿童肠道中厚壁菌门(Tyzzerella 3、巨单胞菌属、瘤胃球菌属、真杆菌属)相对丰度增加,拟杆菌门丰度降低;条件致病菌(普雷沃菌属、韦荣菌科)丰度增加,益生菌(双歧杆菌属、乳酸杆菌属、阿克曼菌、产丁酸的普拉梭菌)丰度降低。
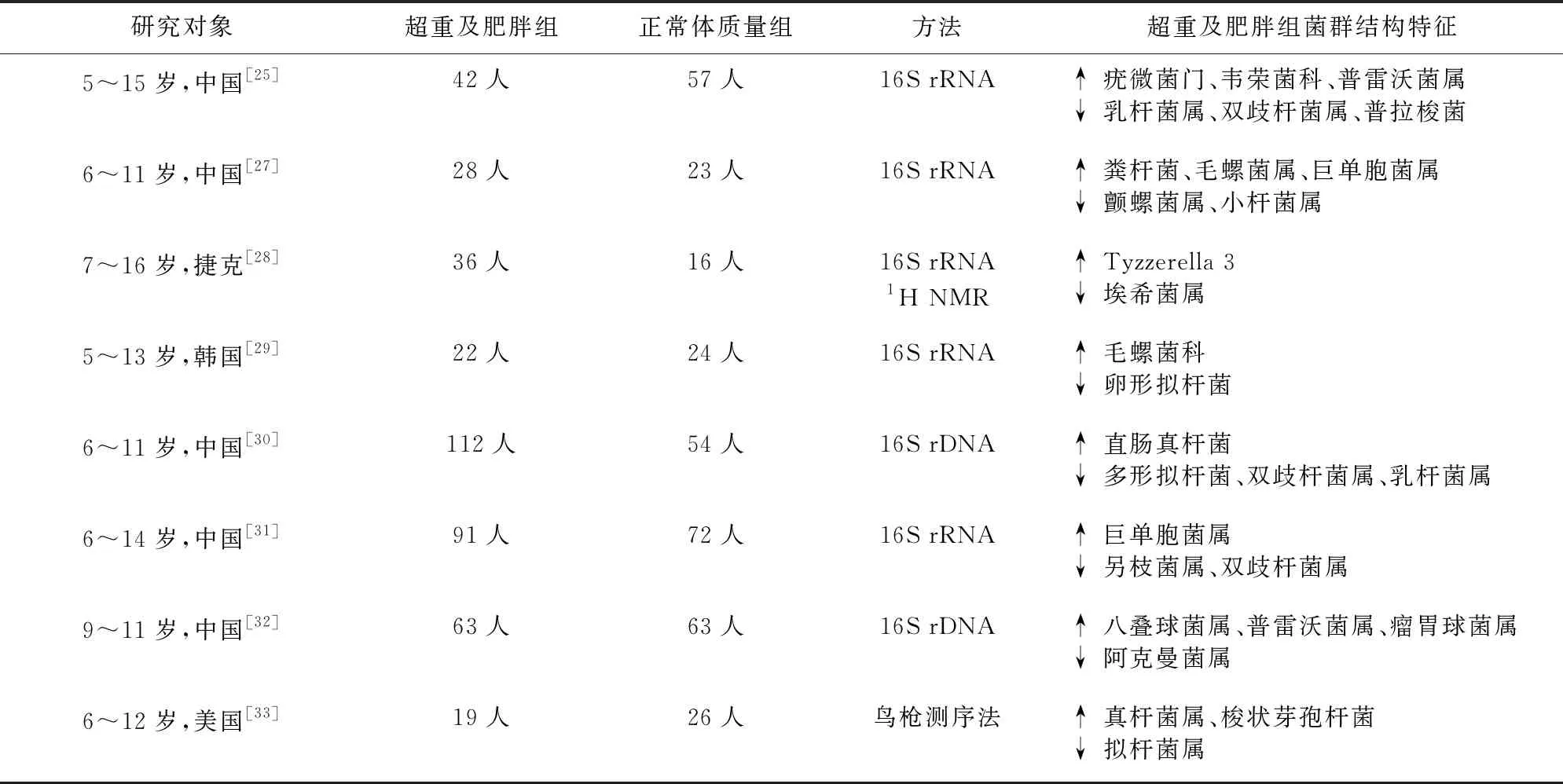
表1 肥胖儿童肠道菌群结构特征
2 肠道菌群与儿童肥胖的发病机制
2.1 诱导慢性炎症反应 肥胖是以脂肪组织过度沉积及脂质代谢紊乱为特征的代谢性疾病,脂肪组织是一个分泌器官,释放白细胞介素-6、瘦素、肿瘤坏死因子-α等,参与炎症反应、调节脂质代谢。上述研究指出肥胖儿童肠道中G-菌增多,而脂多糖(lipopolysaccharide,LPS)是G-菌细胞壁的主要成分,通过受损的肠道屏障进入血液。LPS与LPS结合蛋白和白细胞分化抗原14(cluster of differentiation 14,CD14)结合,激活Toll样受体4(Toll-like receptor 4,TLR4),通过髓样分化因子88(myeloid differentiation factor 88,Myd88)信号通路,引起多种炎症介质的释放,导致胰岛素抵抗[34]。此外,LPS诱导巨噬细胞向M1型极化,脂肪组织内巨噬细胞浸润增加,促进血管生成和细胞外基质重塑,引起脂质代谢紊乱[35]。最近一项研究发现lbp基因敲除的小鼠肠道内拟杆菌属和普氏菌属相对丰度升高,抑制炎症反应,维持肠道稳态[36]。
肠道屏障既保护人体免受病原体侵袭,又通过其选择性渗透作用吸收营养物质。机体长期慢性炎症时,肠道黏液过度分泌,耗竭杯状细胞,加剧肠道黏膜损害,引起肠道通透性增加,促进LPS易位,引发恶性循环[37]。由此可见,肥胖儿童肠道菌群失调以及肠道屏障功能受损,LPS进入血液循环增多,引起机体低水平的慢性炎症反应,导致肥胖的发生。
2.2 肠道菌群及其代谢产物调节能量稳态
2.2.1 短链脂肪酸 短链脂肪酸(short chain fatty acids,SCFAs)是肠道菌群发酵未消化碳水化合物的终产物,含有1~6个碳原子,主要包括乙酸、丙酸和丁酸,大部分被结肠细胞吸收,约5%通过粪便排出。SCFAs是机体重要的能量来源,乙酸参与胆固醇合成,丙酸是糖异生的重要底物,丁酸供应结肠细胞60%~70%的能量需求[38]。近年来诸多研究指出肥胖儿童血清或粪便中的SCFAs含量与正常体质量儿童存在差异,Gyarmati等[39]发现肥胖儿童粪便中丁酸、丙酸和异戊酸含量增加,与体脂分布的各项参数呈显著正相关[40];与之相反,Barczyńska等[41]指出肥胖儿童粪便中总SCFAs含量较低。此外,Jaimes等[28]发现肥胖儿童粪便中丁酸、阿拉伯单糖、半乳糖含量增加,表明肠道中多糖分解增加。由于样本量及量化方法的不同,且粪便中SCFAs含量并不能反映结肠中的实际浓度,故诸多研究结果存在差异,因此仍需深入研究SCFAs在机体代谢稳态调节中的作用。总之,肥胖儿童肠道菌群从饮食中摄取能量的能力增加,SCFAs生成增加,作为额外的能量参与宿主能量供应,促进肥胖的发生。
2.2.2 次级胆汁酸 胆固醇通过胆固醇7α羟化酶(recombinant cytochrome P450 7A1,CYP7A1)等催化形成初级胆汁酸,随后与牛磺酸或甘氨酸结合,转运至胆囊。餐后胆囊收缩,将结合胆汁酸释放至肠道,90%~95%通过门静脉被肝脏重吸收,其余部分排入粪便。肠道菌群对胆汁酸的去共轭、差向异构化、7α脱羟基和酯化作用可以显著改变其理化性质,进而影响肠道吸收[42]。胆盐水解酶(bile salt hydrolase,BSH)表达于乳杆菌属、双歧杆菌属、拟杆菌属等[43],将结合胆汁酸水解为游离胆汁酸,提高CYP7A1的表达,抑制小肠上皮细胞吸收关键蛋白NPC1L1的表达,降低机体对胆固醇的吸收[44-45]。研究指出与正常体质量儿童相比,肥胖儿童肠道中含BSH的肠菌减少,从而不利于胆固醇向胆汁酸转化,引起胆固醇升高[25]。
胆汁酸作为信号分子,与法尼醇受体(farnesoid X receptor,FXR)或G蛋白偶联受体(takeda G protein-coupled receptor 5,TGR5)结合,调节糖脂代谢。FXR诱导小异源二聚体伴侣,下调固醇调节元件结合蛋白,抑制甘油三酯合成,促进脂肪酸氧化,降低甘油三酯水平[46]。TGR5刺激肠L细胞分泌胰高血糖素肽-1(glucagon-like peptide-1,GLP-1),提高胰岛素敏感性[47]。Higgins等[48]研究发现肥胖儿童在接受口服脂肪耐量试验后,餐后胆汁酸降低,尤其是石胆酸和鹅脱氧胆酸。研究证实石胆酸是TGR5的激动剂,鹅脱氧胆酸是FXR的配体,两者含量的降低导致TGR5和FXR的激活受损,因此肥胖儿童胆汁酸代谢失衡,糖脂代谢紊乱。
2.3 调控摄食行为 在脊椎动物中,摄食行为受下丘脑稳态环路和中脑边缘多巴胺奖赏环路的调节。下丘脑稳态环路主要由弓状核促进食欲的神经肽Y/刺鼠相关蛋白和抑制食欲的前阿黑皮素原/可卡因-安非他明调节的转录肽组成,两类神经元互相制衡,调控宿主食欲[49]。肠-脑轴是肠道菌群通过肠神经系统和中枢神经系统形成双向交互的神经体液网络,肠道菌群通过分解吸收食物,刺激胃饥饿素、GLP-1等分泌,经肠迷走神经传递信号至下丘脑食欲调节中枢,参与食欲调控。中脑边缘多巴胺能奖赏环路主要由前额叶皮层、伏隔核、纹状体和海马体组成,多巴胺能神经元释放多巴胺,增加机体对食物的渴望。研究证实肥胖者脑干的中介中心性较低,调节饱腹感信号的稳态环路受到破坏[50],同时,Pujol等[51]通过静息态脑功能磁共振成像发现肥胖儿童的眶额皮质与杏仁核区域出现功能性结构改变,大脑奖励系统的功能连通性减弱。此外,肥胖儿童长期摄入高热量饮食后,突触后多巴胺2型受体降调节,促使摄入更多食物以获取满足感,加剧肥胖[52]。
2.4 调节生物钟相关基因表达 昼夜节律是生物体与自然环境周期性变化保持同步的内部节律模式,受光线、进食、温度等影响,哺乳动物的昼夜节律遵循一个约24 h的转录-翻译反馈环。下丘脑视交叉上核作为“起搏点”能够调控睡眠-觉醒周期,并通过神经体液信号协调肠道、肝脏等代谢器官的外周生物钟,将生物钟与代谢过程关联起来,调节机体稳态[53]。
近年来多项研究指出肠道菌群的丰度和功能具有昼夜节律,超过20%的肠菌操作性分类单元(operational taxonomic units,OTUs)在24 h内表现出节律性振荡,并受进食时间和成分的影响以及中央生物钟的调控[54]。Altaha等[55]研究发现Bmal1SCNfl/-小鼠肠菌物种丰富度的节律性消失,尤其是与SCFAs生成相关的菌群,表明生物钟与肠道菌群互作调控宿主能量代谢。一方面,肠道菌群诱导组蛋白去乙酰化酶3的表达,激活雌激素相关受体α,诱导脂肪酸跨膜转运基因CD36的转录[56]。另一方面,肠道菌群的鞭毛蛋白和LPS激活树突状细胞的TLRs,通过MyD88信号通路促进白细胞介素-23释放,诱导3型天然淋巴细胞(group 3 innate lymphoid cells,ILC3s)分泌白细胞介素-22,导致肠上皮细胞的转录因子STAT3磷酸化,而后与时钟基因REV-erbα启动子结合,导致Nfil13表达增加,促进肠道上皮细胞吸收脂质[57]。以上结果表明肠道菌群可通过生物钟基因表达,影响脂代谢,诱导肥胖的发生。
2.5 脾主运化与肠道菌群 肠道菌群及其代谢产物参与食物消化吸收和代谢,与“脾气散精,居中央灌四旁”的中医理论相通。脾为气血生化之源,运输水谷精微,化生气血濡养全身,有助于机体生长发育。小儿形气未充,脾常不足,若嗜食肥甘厚味,导致脾胃受损,运化无力,水液失于输布,聚于体内化生痰湿,留滞皮肉发为肥胖。湿阻气机,升降失调,大肠传导功能失常,肠道黏膜免疫失调,肠道菌群稳态失衡。此外,肠道菌群抵抗病原菌入侵,调节机体免疫,与“脾为之卫”,脾气旺盛则不易受外邪侵袭的理论具有相似之处[58]。因此脾主运化功能与肠道菌群在消化吸收、抵御外邪方面密切相关,脾失健运,痰湿内生,肠道菌群失调,糖脂代谢紊乱,免疫功能受损,促进肥胖发生。
综上所述,肠道菌群通过调节炎症反应、增加能量摄取、引起胆汁酸信号通路激活受损、调控宿主进食和生物钟相关基因的表达,参与肥胖的发生和发展。采取顺产分娩、母乳喂养、避免抗生素早期暴露、调整膳食结构、规律作息有助于防治儿童肥胖的发生。中医药治疗儿童肥胖有其独特优势,通过健脾兼以化痰、利湿,调节津液输布和气机升降,结合针灸、艾灸等辅助疗法,提高肥胖患儿的临床疗效,减少并发症的出现,因此深入探索中药与肠道菌群的内在联系有助于为防治儿童肥胖提供新的思路。

