埋藏式心脏转复除颤器植入术后化脓性心包炎一例
葛力萁 李菲 李承宗 胡晓芹 韦慧 张权 张超群
患者男性,67 岁。因反复胸痛3 周,加重1 天入院。3周前曾因胸痛1天入院,体格检查双肺呼吸音清,未闻异常心音、心包及胸膜摩擦音;胸腹主动脉CT 血管造影示胸腹主动脉粥样硬化改变伴局部溃疡形成,胸腔及心包少量积液;CT 肺动脉造影示右肺中叶肺动脉分支内栓子形成(图1 A、B),诊断急性肺栓塞,给予抗凝治疗,自觉症状好转后出院。既往有陈旧性心肌梗死病史15年;50天前因“持续性室性心动过速、低血压休克”行埋藏式心脏转复除颤器(ICD)植入。
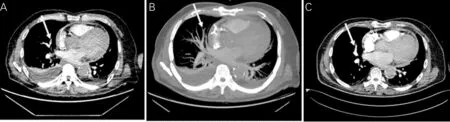
图1 患者CT 肺动脉造影
入院后查肺血管CTA 提示同3周前相比,右肺中叶肺动脉分支内栓子基本消失,两肺内病灶及胸腔积液较前吸收好转;心包积液较前增多、密度稍增高(图1C)。入院后起搏器程控示起搏阈值、阻抗、感知正常,参数同前次入院无明显变化;血常规未见明显异常,C-反应蛋白(CRP)9 mg/L。入院后予以抗凝、降脂、控制心室率、利尿等治疗。入院一周后复查主动脉全长CT 血管造影示胸腹主动脉粥样硬化性改变;主动脉弓及胸主动脉局部溃疡形成;心脏起搏器植入术后改变;较入院时两肺部分炎性灶有吸收,两侧胸腔积液及心包积液稍增多。考虑心脏损伤后综合征(PCIS)可能,入院后第8天予以激素治疗(醋酸泼尼片30 mg,每天一次)。患者胸痛症状减轻,白细胞及CRP 下降后又逐渐增高。入院后16天患者感胸闷、憋喘症状加重,复查心包积液量增多。立即行心包穿刺及胸腔穿刺。均抽出脓性液体,3次心包积液、2次胸腔积液培养均为肠炎沙门菌,1次血培养示肠炎沙门菌,确诊肠炎沙门菌引起的化脓性心包炎、脓胸。经心包冲洗,抗生素、小剂量激素应用等治疗,患者症状迅速减轻,抗感染治疗出院。随访6个月,未再发作胸痛、胸闷,复查血常规、CRP、心脏彩超未示异常。
讨论 多种疾病均可导致心包积液,该患者ICD 植入术后出现胸痛、心包积液,首先需考虑电极穿孔可能,但多次程控相关参数未见异常,CT 等影像学检查未见电极穿孔,排除电极穿孔可能。患者首次胸痛时肺动脉CTA 提示肺动脉栓塞,当时考虑胸痛与肺动脉栓塞有关,予抗凝治疗,胸痛有所缓解但未消失,回顾分析患者肺动脉栓塞仅累及肺动脉分支,无肺梗塞,单纯用肺动脉栓塞难以解释胸痛症状。
PCIS是指心脏受到各种损伤后出现的以心包、胸膜和肺实质炎症为主要表现的一组综合征。有作者提出PCIS诊断可根据2个主要标准及1个次要诊断标准,主要标准为发热、胸痛、心包和(或)胸膜摩擦音;次要标准为血沉增快、CRP增高、血白细胞增多、心脏损伤后1周以上[1]。在行心脏器械装置植入的患者中,PCIS发病比较罕见,但存在心脏扩大或右房电极的患者比较常见[2]。该患者无发热,但存在胸闷、胸膜摩擦音、CRP轻度增高、血白细胞增多、心脏损伤后1周以上,在排除电极穿孔后考虑为PCIS可能。予以激素治疗,虽治疗过程患者胸痛减轻,但是胸闷、憋喘症状加重,心包积液增多,最终经心包穿刺确诊化脓性心包炎。
化脓性心包炎是一种急性、暴发性疾病,文献报道几乎所有病人都有发热,但胸痛并不常见[3]。患者无发热,胸痛明显,不符合典型化脓性心包炎特点。心肌炎和心包炎是罕见的肠炎沙门氏菌病表现,只有少数病例报道[4]。肠炎沙门氏菌感染有时会引起自限性胃肠炎,但也会导致侵袭性感染[5]。肠炎沙门氏菌可被小肠淋巴组织中的单核细胞摄取,导致细菌经淋巴系统或血液系统传播。在无症状潜伏期,这种细胞内细菌在淋巴结、肝脏、脾脏和骨髓的网状内皮细胞和巨噬细胞中复制。细菌达到一定阈值,将会释放入血产生菌血症,随后,菌血症中的细菌将种植于其他器官,导致肠外感染[6]。心脏的发病与肠炎沙门氏菌细菌的摄入量、粘附受损内皮细胞的能力、宿主的免疫能力、以及宿主之前的暴露情况等因素有关。本例患者同时出现化脓性心包炎和胸膜炎,其发病前有反复室性心动过速、低血压休克病史,考虑低血压时出现肠粘膜缺血损伤、导致肠炎沙门氏菌突破屏障进入血液导致菌血症,并在心包及胸膜定植,最终导致局部感染。本例患者缺少典型症状,导致延误诊断。提示对心包积液患者,尤其是既往有血流动力学障碍病史患者,即使无典型细菌感染临床表现也不能排除化脓性心包炎可能,有条件应尽早心包穿刺明确诊断。
目前治疗化脓性心包炎主要以心包引流术的基础上加用持续心包灌洗。该患者经过治疗恢复良好,最终痊愈出院。文献报道化脓性心包炎有进展为缩窄性心包炎可能,本例患者治疗期间已应用小剂量激素抑制炎症反应,半年后复查心脏彩超心功能较前改善,未见进展为缩窄性心包炎,远期是否会进展为缩窄性心包炎尚需进一步随访观察。

