治疗革兰氏阳性菌感染重症患者替考拉宁安全浓度范围的探讨
郑灵招,林小青,温悦,黄本润,2,欧阳华,2*(.厦门大学附属中山医院药学部,福建 厦门 36004;2.福建医科大学药学院,福州 350000)
替考拉宁是目前临床上治疗多重耐药金黄色葡萄球菌和肠球菌感染性疾病的首选药物之一,研究发现[1-2]个体间药动学差异显著影响替考拉宁血药浓度,重症感染患者在特殊疾病状态下给予常规剂量下很难达到合适的治疗浓度,如果用量过小会导致治疗失败,而用量过大会产生一定的器官毒性。对于非复杂感染患者的替考拉宁谷浓度(Cmin)需达到 10 mg·L-1以上才能达疗效[3],中度革兰氏阳性菌感染Cmin需维持在10~20 mg·L-1,严重感染(包括心内膜炎)Cmin需维持在20~60 mg·L-1[4]。也有研究[5]推荐对于重症患者替考拉宁Cmin推荐15~30 mg·L-1。另外替考拉宁不良反应的发生率与血药浓度相关[6],但替考拉宁安全浓度范围的上限尚未有充分证据确定,研究报道结果也不一致。Nakamura等[1]认为在替考拉宁Cmin>28 mg·L-1时与肝功能的发展有关,Wood等[7]报道在替考拉宁Cmin>60 mg·L-1时与血小板减少和肾毒性发生风险增加相关,但尚无足够安全性数据证明。目前安全浓度范围探讨以国外文献居多,国内相关报道较少,涉及样本量也较少[8],确定革兰氏阳性菌感染重症患者使用替考拉宁的最佳安全浓度范围是亟待解决的重点问题。
本研究通过监测患者替考拉宁Cmin,分析Cmin与疗效和安全性的相关性,通过浓度分组及绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)探讨患者最佳安全有效的浓度范围,为患者个体化用药提供理论依据。
1 材料与方法
1.1 研究对象
回顾性收集2019年1月—2020年12月厦门大学附属中山医院静脉使用替考拉宁患者的临床数据。
入选标准:① 年龄≥18岁;② 静脉使用替考拉宁;③ 用药疗程≥3 d;④ 确诊或拟诊革兰氏阳性菌感染的重症患者;⑤ 同意对替考拉宁进行血药浓度监测的患者;⑥ 患者对本类药物无过敏反应。排除标准:① 无法获取血样或未获得血药浓度结果;② 病例资料不全的患者;③ 治疗期间缺乏疗效学判断的患者;④ 孕妇、精神病患者和残疾人患者。
1.2 血样采集
根据患者给药方案,采集患者替考拉宁第5~7剂给药前30 min的血样(抽取3~4 mL静脉血于含EDTA抗凝剂的60号采血管中),经样品前处理后,使用 HPLC 进行检测,若无法立即检测,则血样离心后取上清液(即血浆)置于-20℃保存。
1.3 资料的收集
收集的临床资料包括性别、年龄、身高、体重、体质量指数(BMI)、住院时间、用药疗程、用药方案(负荷剂量与维持剂量)、前3 d的平均给药剂量(MID)、血常规、相关炎症指标和肝肾功能指标等。
1.4 替考拉宁浓度分组与药敏试验方法
不同感染类型替考拉宁推荐的有效浓度范围不同,常见质量浓度范围为>10 mg·L-1、>15 mg·L-1或>20 mg·L-1等,为进一步探究最佳有效浓度水平,本研究以5 mg·L-1为一单位,将质量浓度进行分成6组(<10 mg·L-1,10~15 mg·L-1,15~20 mg·L-1,20~25 mg·L-1,25~30 mg·L-1,≥30 mg·L-1)(10~15 mg·L-1表示10≤Cmin<15 mg·L-1,余组类同)。
替考拉宁药敏使用K-B法药敏纸片(英国OXOID公司产品),结果按美国临床实验室标准化委员会(CLSI)2016 年标准判断,替考拉宁对葡萄球菌及肠球菌 K-B法抑菌圈直径≤10 mm为耐药(R),11~13 mm为中介(I),≥14 mm 为敏感(S)。
1.5 疗效评价
根据临床疗效评价标准[9],分为:① 痊愈;② 显效;③ 进步;④ 无效。痊愈、显效判定为治疗有效,并据此计算有效率。根据细菌学疗效评价[9-10],分为:① 清除;② 细菌交替;③ 部分清除;④ 未清除和假定未清除。本研究的细菌学疗效针对革兰氏阳性菌进行评判,以细菌清除+细菌交替作为细菌学疗效有效的结果判定。
1.6 安全性评价
不良反应根据嘉禾电子病例系统的临床判定和国家药品不良反应(Adverse Drug Reaction,ADR)中心对 ADR 关联性评价进行筛选,将不良事件与药品的关联性评价分为肯定有关、很可能有关、可能有关、可能无关和肯定无关。前三者视作为与药品可能有关,评价为药物的不良反应。
肾毒性:根据RIFLE标准进行急性肾损伤分类[11-12],肾毒性定义为血肌酐增加超过0.5 mg·d-1或比原水平增加50%。肝毒性:根据《药源性肝损害严重程度评价》[13]定义肝毒性,① 谷丙转氨酶(ALT)≥ 5×ULN(参考值上限);② 碱性磷酸酶(ALP)≥2×ULN [伴随谷氨酰转移酶(GGT)升高且排除骨骼疾病引起ALP水平升高];③ALT≥3×ULN同时总胆红素(TBil)≥2×ULN。当患者药物治疗前肝脏生化异常时,ULN为药源性肝损伤发病前获得的平均基线值。药源性血液异常:血小板计数(PLT)减少为PLT<100×109·L-1,白细胞(WBC)减少为WBC<4×109·L-1;中性粒细胞(NEUT)减少为NEUT<2.0×109·L-1。
1.7 统计学方法
使用 SPSS 26.0 统计软件,正态分布采用t检验偏态分布采用非参数检验,计数资料采用χ2检验或Fisher精确检验,所有检验均为双侧,P<0.05 被认为差异具有统计学意义。应用Medcalc 18.2.1统计软件绘制受试者工作曲线(ROC曲线),采用Kaplan-Meier 曲线探索不同浓度范围发生肝肾毒性的风险。
2 结果
2.1 患者一般信息及临床资料
根据纳排标准共纳入247例患者,其中男性156例,女性91例;平均年龄为(68.45±16.29)岁;平均体质量指数(BMI)(22.21±2.54)kg·m-2;平均住院天数为(24.49±15.45)d;替考拉宁平均用药时间为(9.12±4.83)d;其他生化检查见表1;合并用药(除抗菌药物其他根据合并药物排名前5展示)与血药浓度相关性见表2。
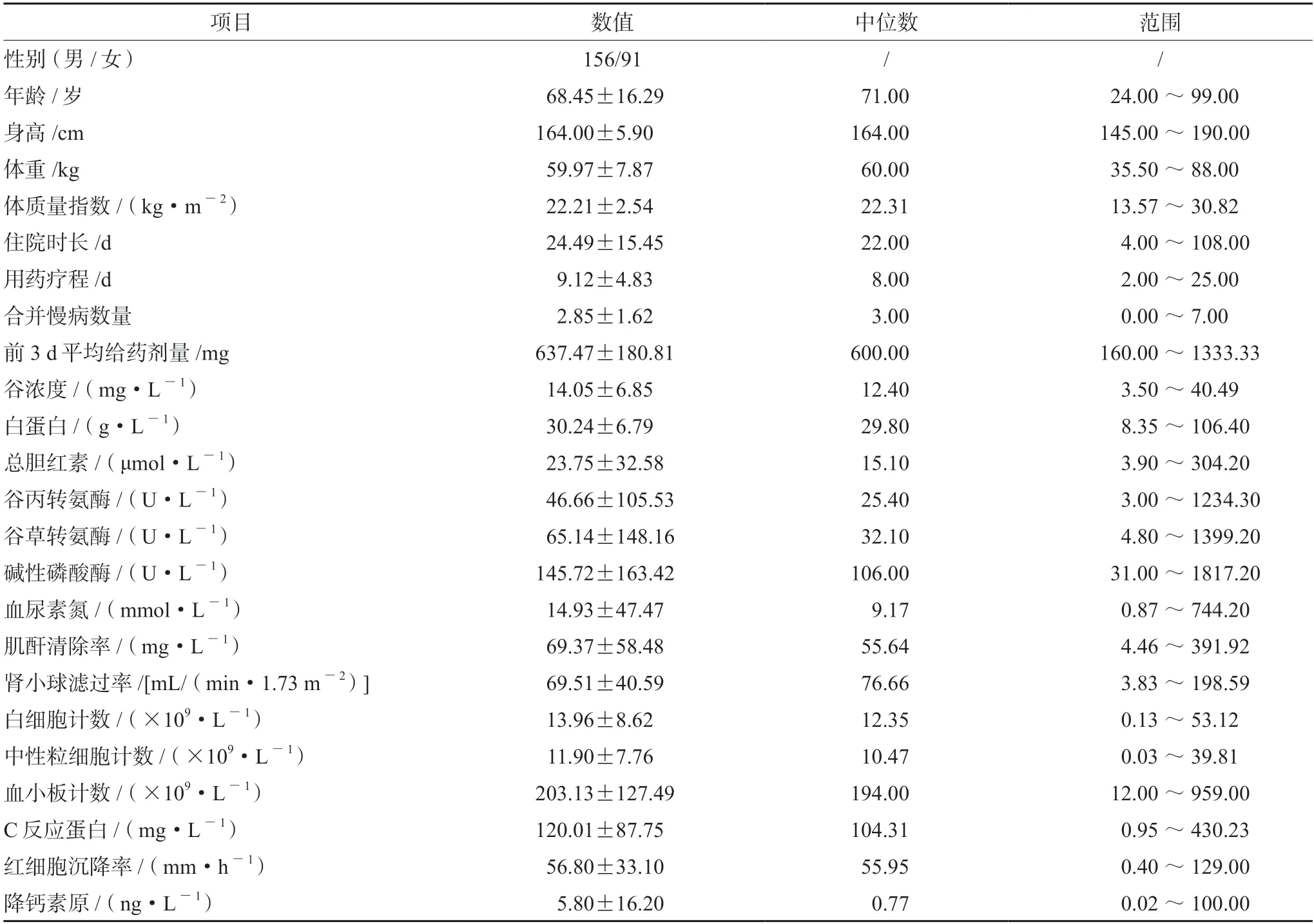
表1 患者一般情况与实验室检查Tab 1 Basic information and laboratory examination
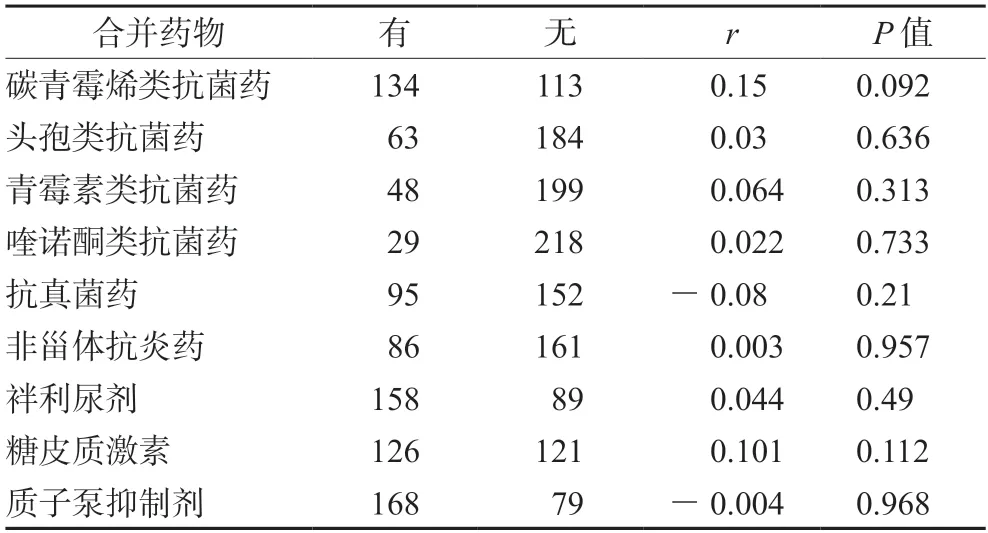
表2 合并用药与血药浓度相关性分析Tab 2 Analysis of the correlation between combined drug use and blood concentration
2.2 用药方案
患者用药方案中以负荷剂量400 mg q12h×3次,维持剂量400 mg qd 的方案最常见,有103例(41.70%);负荷剂量600 mg q12h×3次,维持剂量600 mg qd的方案,有33例(13.36%);未予以负荷剂量的患者有10例(4.05%),见表3。
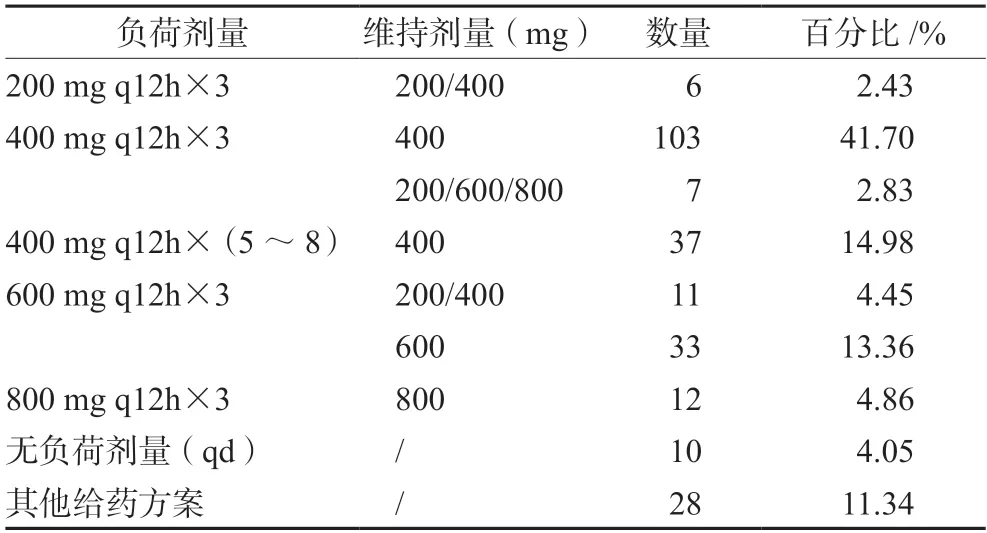
表3 患者用药方案信息Tab 3 Medication program information
2.3 微生物检测结果
247例患者中,检出53株金黄色葡萄球菌;51株凝固酶阴性葡萄球菌;42株粪肠球菌;27株屎肠球菌;其中药敏检测数为164株(66.40%),替考拉宁耐药菌共6株,中介菌13株,敏感菌145株,见表4。
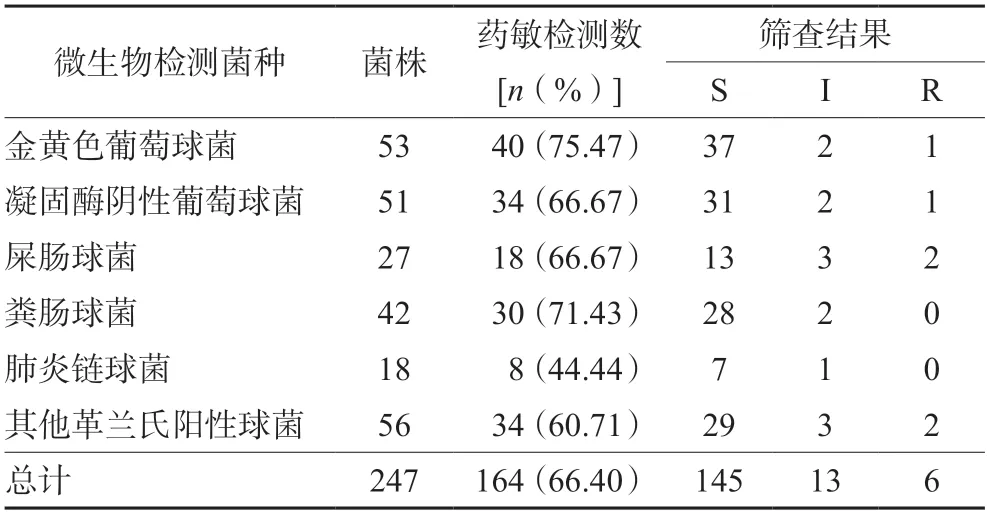
表4 部分革兰氏阳性球菌检查结果Tab 4 Partial gram-positive cocci test results
2.4 替考拉宁不同浓度组分布情况
247例患者中69例(27.94%)患者替考拉宁Cmin<10 mg·L-1,171例(69.23%)患者Cmin在10~30 mg·L-1内,Cmin≥30 mg·L-1的患者仅7例(2.83%),替考拉宁平均Cmin为(14.05±6.85)mg·L-1,其中最低浓度为3.5 mg·L-1,最高浓度为40.49 mg·L-1。不同浓度范围组间的临床有效率(χ2=7.27,P=0.007)和细菌学有效率(χ2=25.95,P<0.001)差异均有统计学意义,见表5。
2.5 替考拉宁不同浓度组间有效率对比
在临床有效率中,Cmin<10 mg·L-1组与其他五组差异都有统计学意义(P<0.05),Cmin10~15 mg·L-1组的临床有效率与Cmin15~20 mg·L-1组差异也有统计学意义(P=0.009),其余组间差异皆无统计学意义,见图1A;在细菌学有效率中,除了Cmin≥30 mg·L-1组与Cmin<10 mg·L-1组有效率差异无统计学意义,其余四组均与Cmin<10 mg·L-1组差异都有统计学意义(P<0.05),见图1B。
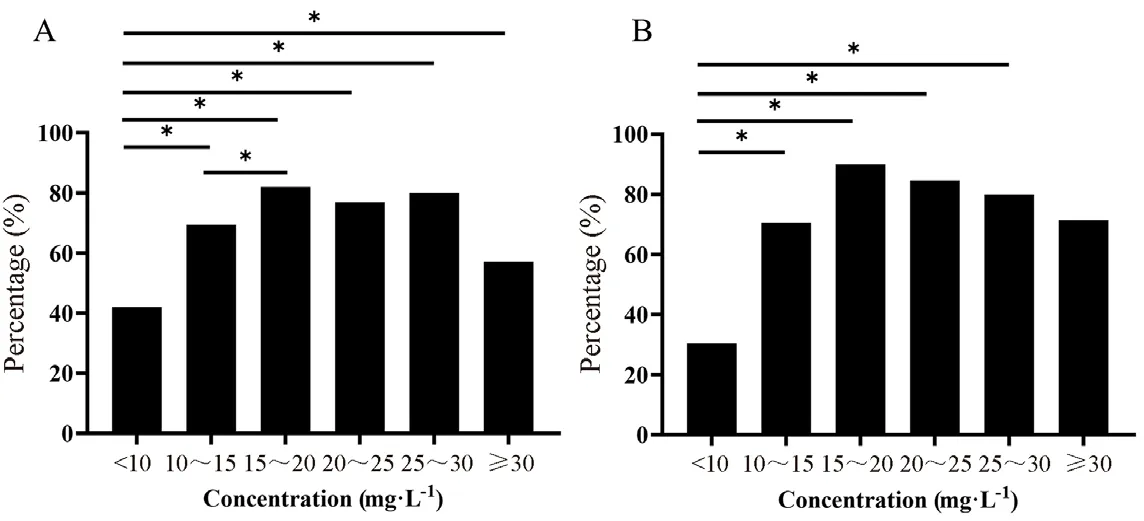
图1 不同血药浓度组间临床有效率(A)和细菌学有效率(B)的对比(*P<0.05)Fig 1 Clinical effective rate(A)and bacteriological efficiency(B)between groups of different blood concentrations(*P<0.05)
2.6 替考拉宁最佳有效浓度
通过卡方分析发现替考拉宁Cmin≥15 mg·L-1患者有效率(临床有效率86.02%;细菌学有效率77.42%)均显著高于Cmin<15 mg·L-1的患者(χ2=14.69,P<0.001;χ2=9.84,P=0.002),Cmin≥15 mg·L-1的临床有效率与Cmin≥10 mg·L-1差异有统计学意义(χ2=4.71,P=0.030),见表6。
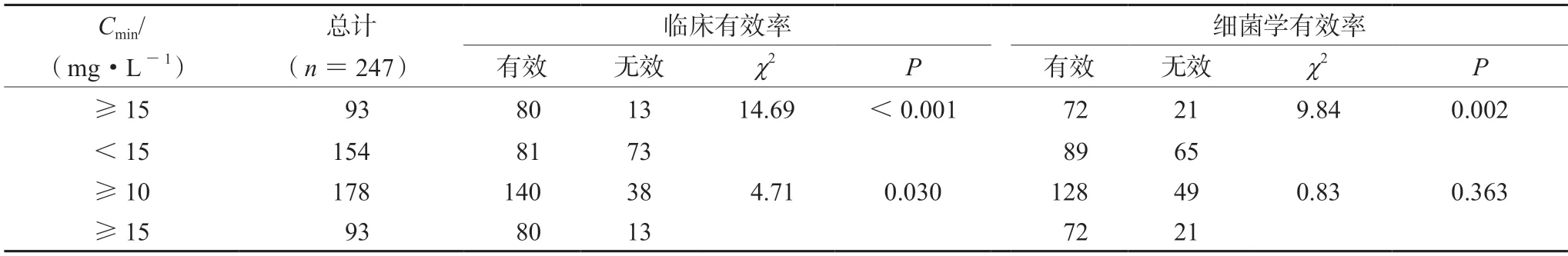
表6 不同浓度组的有效率对比Tab 6 Comparison of effective rates of different concentration groups
2.7 血药浓度与安全性的关系
2.7.1 替考拉宁血药浓度与不良反应相关性 发生肝毒性的有18例(7.29%);发生肾毒性的有20例(8.10%);血药浓度与肾毒性及肝毒性显著相关(P<0.001),而与WBC减少、PLT减少和NEUT减少无显著相关性(P>0.05),见表7。

表7 不同浓度组的不良反应分布[n(%)]Tab 7 Distribution of adverse reactions in different concentration groups [n(%)]
2.7.2 替考拉宁发生肝、肾毒性的临界值 将肝、肾毒性的发生情况与血药浓度通过ROC曲线分析,结果显示,当替考拉宁Cmin≥27.70 mg·L-1时,患者更易发生肝毒性(AUC=0.852,P<0.001),敏感度为81.25%,特异性为79.22%;当替考拉宁Cmin≥30.53 mg·L-1时,患者更易发生肾毒性(AUC=0.749,P=0.001),敏感度为63.20%,特异性为87.70%,见图2。

图2 血药浓度与肾毒性(A)及肝毒性(B)的相关性的ROC曲线图Fig 2 ROC curves of the correlation between blood drug concentration and nephrotoxicity(A)and hepatotoxicity(B)
2.7.3 替考拉宁不同浓度范围的安全性比较 将替考拉宁不同浓度范围组间的肝、肾毒性发生率进行分析,结果发现<10 mg·L-1、10~15 mg·L-1、15~20 mg·L-1及20~25 mg·L-1组的肝、肾毒性发生率与25~30 mg·L-1及≥30 mg·L-1组差异都有统计学意义(P<0.05),25~30 mg·L-1与≥30 mg·L-1组间肝、肾毒性的发生率差异无统计学意义(P>0.05),表明当替考拉宁达25 mg·L-1及其以上浓度时,患者发生肝、肾毒性发生率显著高于其他低浓度组,见图3。基于此将患者分为<25 mg·L-1与≥25 mg·L-1组,采用Kaplan-Meier 风险函数继以分析验证<25 mg·L-1组安全性是否更佳,结果发现<25 mg·L-1组发生肝、肾毒性的风险显著低于≥25 mg·L-1组(肝:χ2=59.95,P<0.001;肾:χ2=47.05,P<0.001),见图4。另外将肝、肾毒性的发生情况与发生时间进行分析,发现肝毒性中位发生时间为第9日,肾毒性中位发生时间为第7日。

图3 不同浓度组间肾毒性(A)和肝毒性(B)发生率比较Fig 3 Incidence of nephrotoxicity(A)and hepatotoxicity(B)among different concentration groups
3 讨论
由于重症患者病理情况复杂,个体差异较大,替考拉宁的临床使用很难到达目标浓度,故监测替考拉宁血药浓度以维持适当的Cmin对保证临床治疗效果至关重要[14-15]。相关研究显示[16-17],金黄色葡萄球菌、凝固酶阴性葡萄球菌和粪肠球菌对替考拉宁的耐药率均较低,与本文结果相近,由此可知明确感染病原菌有助于挑选合适的抗菌药品,对及时控制感染意义重大。
本研究中不同浓度范围组间的临床有效率和细菌学有效率差异均有统计学意义,为保证替考拉宁的临床疗效,《替考拉宁临床应用剂量专家共识》中[18]对多数革兰氏阳性菌感染患者推荐为Cmin>10 mg·L-1,本研究通过组内卡方分析发现Cmin≥15 mg·L-1组的临床有效率显著高于Cmin<15 mg·L-1和Cmin≥10 mg·L-1组,虽然针对Cmin≥15 mg·L-1组和Cmin≥10 mg·L-1组对替考拉宁重症患者疗效的对比研究非常有限,但国外已有研究认为对于耐甲氧西林金黄色葡萄球菌(MRSA)患者替考拉宁有效浓度应推荐到15 mg·L-1,且认为替考拉宁初始Cmin≥15 mg·L-1是临床治疗成功的独立因素[19],也有研究认为重症患者需要将Cmin维持在20~30 mg·L-1[20],而本研究发现替考拉宁有效率在一定范围内随着浓度的升高而升高,在15~20 mg·L-1时临床有效率和细菌学有效率最高(90.00%与82.00%),但随着浓度的继续升高,疗效并不会进一步显著提高,甚至有下降趋势,但并无统计学意义,可能与高浓度组患者数量较少有关,因此临床上可提高给药负荷剂量使替考拉宁尽早达更佳的有效浓度范围,从而提高药物临床治疗有效率,同时也需精准调整维持剂量,避免毒性的发生和经济上的浪费。
本研究中收集的替考拉宁不良反应主要涉及患者肝毒性(7.29%)、肾毒性(8.10%)、PLT减少(13.77%)、WBC减少(7.29%)和NEUT减少(4.05%),并发现替考拉宁血药浓度与WBC减少、PLT减少和NEUT减少无显著相关性而与肝、肾毒性的发生显著相关(P<0.001)。从图2A中可知当替考拉宁Cmin≥30.53 mg·L-1时,患者可能更易发生肾毒性(AUC=0.749),Wilson[21]认为如果替考拉宁谷浓度大于40 mg·L-1,则会增加发生器官毒性的风险,Zhou等[15]则表明替考拉宁血药浓度低于30 mg·L-1时对于感染革兰氏阳性细菌的患者才是安全的,但与Yoon等[22]认为的Cmin>60 mg·L-1才发生肾毒性的浓度范围相比较低,可能原因是本研究仅有2.83%的患者血药浓度≥30 mg·L-1,最高浓度为40.49 mg·L-1,无法评估Cmin>60 mg·L-1的毒性情况。从图2B中可知当替考拉宁Cmin≥27.70 mg·L-1时,患者更易发生肝毒性(AUC=0.852),与Nakamura等[23]发现替考拉宁Cmin≥28.0 mg·L-1是肝毒性发生的危险因素的结果一致。
为确定安全的浓度范围,本研究将血药浓度分为6组进行分组对比,发现达到25 mg·L-1及其以上浓度时,患者发生肝、肾毒性发生率显著高于其他低浓度组。基于此将患者分为<25 mg·L-1与≥25 mg·L-1组,采用Kaplan-Meier风险函数分析发现<25 mg·L-1组发生肝、肾毒性的风险显著低于≥25 mg·L-1组,与《中国国家处方集分析》[24]分析中推荐浓度范围(10~25 mg·L-1)的上限一致。也有研究[4,25]认为替考拉宁Cmin<30 mg·L-1对感染革兰氏阳性菌的患者是安全的,结果高于本研究探索的安全浓度上限,原因可能是不同研究间不良反应的评判存在一定主观性的观察偏移,不同研究谷浓度范围和分布不同,且肝肾毒性的评定方法可能存在一定差异。同时本研究还发现肝毒性的中位发生时间为第9日,肾毒性的中位发生时间为第7日,提示我们临床应用替考拉宁时需谨慎地降低安全浓度范围,并在用药过程的第9日关注肝功能变化,第7日关注肾功能水平,同时定期监测替考拉宁血药浓度,以便及时调整替考拉宁剂量在一定程度上减少不良事件的发生保证药物使用的安全性。
本研究存在一定的限制:① 主要针对感染革兰氏阳性菌的重症患者使用替考拉宁的疗效和安全性进行分析,但未对患者感染类型和疾病进行分类;② 临床患者复杂的生理病理状态和复杂的用药,安全性的评估可能会出现一定的观察偏移,仍需进一步加大样本量验证。

