桑叶联合二甲双胍对2型糖尿病小鼠的糖脂代谢、炎症及肠道微生物的影响
陆东裕,赵燕琳,金鹏,王倩,杜岩,汤道权*(.徐州医科大学附属医院睢宁分院药剂科,江苏 睢宁 00;.徐州医科大学江苏省新药研究与临床药学重点实验室,江苏 徐州 004)
近年来,随着人们饮食及生活方式的改变,糖尿病的发病率逐年升高。据国际糖尿病联盟统计,2021年全球约有5.37亿人患有糖尿病,预计到2030年患糖尿病人数将增长到6.43亿。2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病患者总数的90%以上,致病因素包括肥胖、缺乏锻炼、高能量饮食和遗传因素等,同时会引发心血管疾病、糖尿病肾病、糖尿病足、视网膜病变等一系列并发症,给患者及其家庭带来了巨大的压力,给社会造成了极大的经济负担。
二甲双胍(metformin,MET)为临床上用于治疗糖尿病的主要口服降糖药物,其主要通过减少肝脏葡萄糖的输出和改善外周胰岛素抵抗而降低血糖,是T2DM患者控制高血糖的一线用药和药物联合中的基本用药。长期服用MET可引起胃肠道反应、维生素B12水平下降及药物抵抗,其对脂质代谢紊乱及炎症的治疗作用也有待确认,且无法阻止并发症的发生。因此,MET与中药联合对T2DM及其并发症的延缓或阻滞作用,已引起广泛的注意。
桑叶是桑科植物桑的干燥叶,具有疏散风热、清肺润燥、清肝明目的功效。《本草纲目》中首次记载了桑叶茶可用于“消渴症”的治疗。现代药理学研究同样证实,桑叶可改善链脲佐菌素(streptozotocin,STZ)及高脂饮食诱导的糖尿病大鼠及小鼠体内的血糖水平异常;降低糖尿病患者的血糖水平、改善其糖脂代谢异常[1-3]。
研究证实,桑叶茶和MET联用可有效改善肺热津伤证T2DM患者中医证候评分及胰岛素抵抗,抑制白细胞介素-6(interleukin-6,IL-6)水平,该联合用药效果可能与桑叶能延迟MET的体内消除时间有关[4]。大量研究表明,糖尿病与肠道菌群的种类与数量存在一定的关系[5]。因此,本文在前期实验的基础上,以STZ联合高脂高糖(high fat and high sucrose,HFHS)饮食诱导的T2DM小鼠为对象,观察桑叶水提物(mulberry leaf water extract,MLE)联合MET对T2DM小鼠糖脂代谢、炎症及肠道菌群的影响,以期从肠道微环境的角度揭示桑叶联合MET改善T2DM的作用机制,并为临床上两者联合应用治疗T2DM提供实验依据。
1 仪器与材料
1.1 试药
桑叶购自徐州广济连锁药店有限公司,经徐州医科大学季帅副教授鉴定为桑科植物桑(Morus albaL.)的干燥叶;MLE为本实验室自制[1];MET(纯度≥ 98.5%;批号:A-32611906092)(江苏万邦生化医药股份有限公司);STZ(纯度≥98%;批号:WXBD1402V)(美国Sigma公司);Trizol总RNA提取试剂、PrimeScript RT Master Mix及TB Green Premix Ex Taq Ⅱ试剂盒(日本Takara公司);鼠源IL-6、IL-1β、IL-10、肿瘤坏死因子-α(TNF-α)及β-actin上下游引物(上海生工生物工程股份有限公司);三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)及谷草转氨酶(AST)试剂盒(南京建成生物工程研究所);胰岛素、C-肽、脂多糖(LPS)试剂盒(上海岚派有限公司);粪便DNA分离及纯化试剂盒、DEAE琼脂糖凝胶(德国默克公司);高保真热启动酶试剂盒(美国KAPA Biosystems公司);Ultra DNA Library Prep Kit for Illumina(英国New England Biolabs公司);其他试剂均为分析纯。
1.2 仪器
手持组织匀浆器(美国Biospec公司);EA-11型血糖测试仪(长沙三诺生物传感股份有限公司);NanoDrop 1000核酸浓度测定仪(美国Thermo 公司);PCR仪(美国AB公司);酶标仪(Elx808,美国Bio Tek公司);RT-PCR仪(瑞士Roche公司)。
1.3 实验动物
4周龄雄性C57BL/6J小鼠,体重(20±2)g(上海斯莱克实验动物有限责任公司),动物生产许可证号:SCXK(沪)2008-0016。饲养于徐州医科大学SPF级动物房,自由摄食和饮水,每2日更换一次饮水瓶,每3日更换一次垫料,室温保持在(22±2)℃,相对湿度(55±10)%,12 h/12 h间隔照明。
2 方法
2.1 动物分组、造模及给药
C57BL/6J雄性小鼠适应性饲养7 d后,随机分为正常组和模型组,正常组给予普通饲料,模型组给予HFHS饲料(含60%脂肪、20%蛋白质、20%碳水化合物),4周后测空腹血糖(FBG)。造模前所有小鼠均禁食不禁水12 h,模型组小鼠按90 mg·kg-1腹腔注射STZ的柠檬酸盐缓冲液(0.1 mmol·L-1,pH 4.5),正常组注射同等体积的柠檬酸盐缓冲液。STZ诱导7 d后,禁食过夜测血糖,FBG>11.1 mmol·L-1的小鼠认为T2DM小鼠造模成功。T2DM小鼠按FBG水平随机分为模型组(HFHS)、MLE组(MLE)、MET组(MET)、MLE联合MET组(CMT)。MLE组按2 g/(kg·d)(以生药含量计算)灌胃给予MLE;MET组按200 mg/(kg·d)灌胃给予MET;CMT组同时给予2 g/(kg·d)MLE及200 mg/(kg·d)MET;另取正常小鼠设为正常对照组(NC),NC组及HFHS组均同法给予等体积溶媒,连续8周。实验周期内NC组给予普通饲料,其他组均给予HFHS饲料,每周记录一次体重,各组小鼠均自由饮水。第12周进行胰岛素耐受试验(ITT),第13周收集小鼠粪便并进行口服葡萄糖耐量试验(OGTT)[1]。干预结束后处死小鼠,收集血液、肝脏、附睾脂肪,用于测定生化指标及计算肝脏及附睾脂肪指数(脏器重量/体重×100%)。
2.2 血液、肝脏、附睾脂肪、粪便的采集与处理
摘除小鼠眼球取血,室温放置30 min后,3000 r·min-1离心15 min,收集血清并分装,-80℃保存,用于后续的检测。小鼠取血处死后,迅速摘取肝脏及附睾脂肪,用预冷的生理盐水冲洗、滤纸擦干并称重,于液氮中速冷后置-80℃保存,用于后续RT-PCR实验。在无菌条件下收集到新鲜粪便样本后,液氮速冻30 s,保存至-80℃冰箱。
2.3 血液生化指标的测定
按照试剂盒的操作步骤测定各组小鼠血清中TG、TC、HDL-C、LDL-C、ALT和AST含量。采用血糖仪测定血清中FBG浓度;按照试剂盒的操作步骤,采用ELISA法测定小鼠血清中胰岛素、C-肽及LPS的浓度。用胰岛素抵抗稳态模型(homeostatic model assessment for insulin resistance,HOMA-IR)计算胰岛素抵抗指数,HOMA-IR=空腹血糖水平(FPG,mmol·L-1)×空腹胰岛素水平(FINS,μU·mL-1)/22.5。
2.4 RT-PCR检测肝脏中炎症因子mRNA的水平
各基因的上下游引物见表1。实验结束后取小鼠肝脏组织,依试剂盒法提取总RNA、进行逆转录反应获得cDNA。以上述cDNA为模板,将鼠来源的β-Actin、TNF-α、IL-1β、IL-6、IL-10上下游引物稀释到10 μmol·L-1,使用TB Green Premix Ex Taq Ⅱ试剂盒法进行RT-PCR 反应,以β-Actin基因为内参,校正每个样本目的基因的Ct值,以2-△△Ct值计算基因相对表达水平。
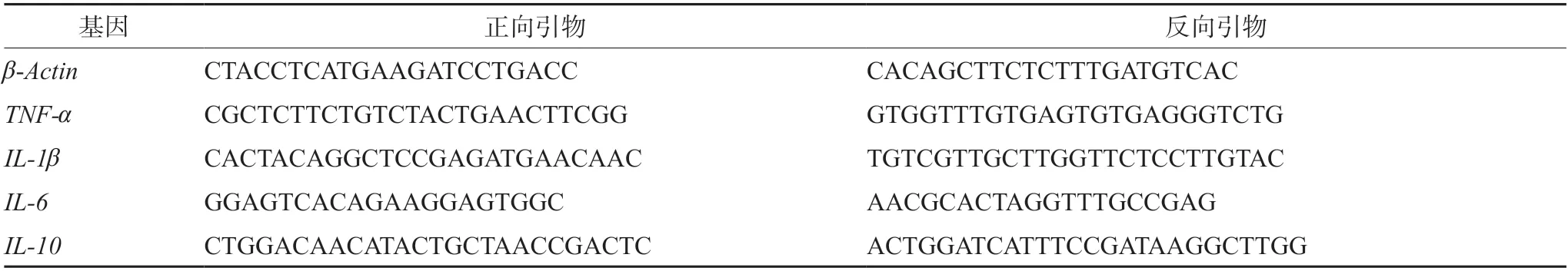
表1 引物序列Tab 1 Primer sequences used in the experiment
2.5 肠道菌群分析
取小鼠新鲜粪便,按试剂盒操作要求提取粪便细菌DNA;采用核酸浓度测定仪测定DNA浓度及纯度;利用1%琼脂糖凝胶电泳检测DNA质量后,合格的DNA采用16S rDNA片段V3和V4区通用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行扩增;采用2%琼脂糖凝胶电泳回收PCR产物,经纯化后根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库,并进行测序。测得的原始数据经拼接、过滤后的有效数据,使用QIIME2软件进行过滤,获得最终的扩增序列变体(amplicon sequence variants,ASV)以及特征表。随后,使用QIIME2软件将得到的ASV与数据库比对及α多样性分析。结合环境因素进行Spearman相关性分析。
2.6 统计学处理
采用SPSS 26.0和GraphPad Prism 8软件进行数据和绘图处理。数据以均数±标准差(±s),两组比较采用t检验,多组比较采用单因素方差分析,假设检验水准按α=0.05判定,P<0.05为差异有统计学意义。
3 结果
3.1 对体重、FBG周期性变化及脏器指数的影响
由图1A~1D结果可知,给药周期内,MET、MLE及两者联合用药,均不显著改变T2DM小鼠体重增加。MET及MLE单独给药均不能显著改善T2DM小鼠的脏器指数改变,但两者联合用药可明显降低T2DM小鼠的肝脏指数(P<0.05)。MET组、MLE组及CMT组小鼠的FBG水平从第6周开始下降,但差异无统计学意义,而实验结束后上述干预组的小鼠FBG水平均显著低于HFHS组(P<0.01),但联合用药与单独用药之间无显著性差异。
由图1E~1H中可见,MET、MLE及两者联合,均可显著降低T2DM小鼠的FBG、空腹胰岛素、HOMA-IR指数及C-肽(P<0.05或0.01),且联合用药组和单独给药组之间无明显差异。OGTT及ITT的结果见图1I~1J,由图1可知,MLE单独用药及与MET联合用药,均可提高T2DM小鼠的口服葡萄糖耐受性及腹腔注射胰岛素耐受性(P<0.05或0.01),而MET单独给药则不能对抗HFHS饮食导致的葡萄糖及胰岛素耐受。
3.2 对血脂、炎症及肝功能的影响
由图2A~2D可知,MLE单用及联合用药,均可显著降低T2DM小鼠血清中TG、TC及LDL-C的水平(P<0.05或0.01),MET单用仅可降低T2DM小鼠血清中LDL-C的水平(P<0.05),且联合用药组与单独用药之间无明显差异;而MET、MLE及两者联合,对T2DM小鼠血清中HDL-C均无明显影响。
由图2E~2G可知,MLE单用及联合用药,均显著降低T2DM小鼠血清中LPS、ALT及AST水平(P<0.05或0.01);MET单用仅可降低T2DM小鼠血清中LPS水平(P<0.05);且联合用药和单独用药之间无显著性差异。
由图2H~2K可见,MLE单用可明显降低T2DM小鼠肝脏中TNF-α和IL-1β的mRNA的表达,升高IL-10mRNA的表达(P<0.05),但对IL-6mRNA表达无显著影响;MET单用可明显降低T2DM小鼠肝脏中TNF-α和IL-1β的mRNA的表达(P<0.05或0.01),但对IL-6及IL-10mRNA表达无明显影响;而两者联合用药仅可降低T2DM小鼠肝脏中TNF-α和IL-6的mRNA表达(P<0.05)。
3.3 对肠道微生物的影响
3.3.1α多样性分析α多样性分析用于反映各样本的微生物群落丰富度和多样性。常用的α多样性分析包括Chao1、Pielou_e、Shannon和Simpson。其中Chao1用来估计样本群落中包含的物种总数;Pielou_e是均匀度指数;Shannon指样本中的分类总数及其占比;Simpson表征群落内物种分布的多样性和均匀度。这些多样性指数越大,代表群落多样性越高,物种分布越均匀。由表2可知,NC组小鼠肠道微生物群落内物种分布较均匀,HFHS组小鼠粪便中微生物的物种均匀度较NC组减少。与HFHS组相比,MET组无明显变化;MLE组小鼠粪便样本中物种数目减少(P<0.01);CMT组小鼠粪便中微生物的物种总数、均匀度、分类总数及其占比均减少(P<0.05)。
表2 小鼠粪便中肠道微生物多样性(n=8,±s)Tab 2 Alpha diversity indexes in fecal sample of mice (n=8,±s)
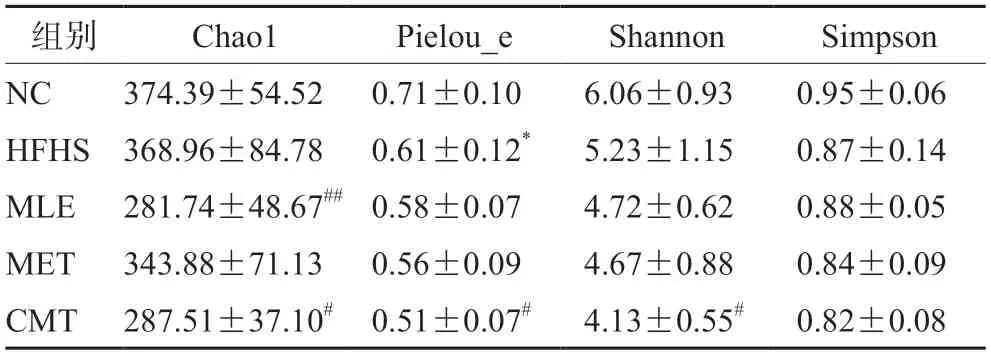
表2 小鼠粪便中肠道微生物多样性(n=8,±s)Tab 2 Alpha diversity indexes in fecal sample of mice (n=8,±s)
注:与NC组相比,*P<0.05;与HFHS组相比,#P<0.05,##P<0.01。Note:vs the NC group,*P<0.05;vs the HFHS group,#P<0.05,##P<0.01.
组别Chao1Pielou_eShannonSimpson NC374.39±54.520.71±0.106.06±0.930.95±0.06 HFHS368.96±84.780.61±0.12*5.23±1.150.87±0.14 MLE281.74±48.67##0.58±0.074.72±0.620.88±0.05 MET343.88±71.130.56±0.094.67±0.880.84±0.09 CMT287.51±37.10#0.51±0.07#4.13±0.55#0.82±0.08
3.3.2 菌群群落结构分析 根据物种注释结果,选取各样本和各组在门及属水平上相对丰度排名前10的物种,生成物种相对丰度柱形图,结果如图3所示。门水平上,各组粪便样本中主要的门分类水平有:拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、脱硫杆菌门(Desulfobacterota)、疣微菌门(Verrucomicrobiota)和放线菌门(Actinobacteriota)为主要优势菌门。属水平上,按所占比例依次为Muribaculaceae、栖粪杆菌属(Faecalibaculum)、阿克曼菌(Akkermansia)、乳杆菌属(Lactobacillus)等。
图3 各组小鼠肠道微生物物种分布图Fig 3 Microbial species distribution of mouse gut microbiota
3.3.3 组间物种差异分析 利用MetaStat方法对两组间的物种丰度数据进行t检验得到P值,并根据P值筛选出具有组间显著性差异的物种,门、属水平的组间显著性分析结果见图4。门水平上,MET可明显降低T2DM小鼠粪便中Bacteroidota的相对丰度、升高Proteobacteria的相对丰度(P<0.05);MLE可明显降低Desulfobacterota的相对丰度(P<0.05);而两者联合不仅明显影响上述三个细菌的丰度,还可明显逆转单用MET或MLE不能改变的Cyanobacteria、Deferribacterota、Firmicutes三种细菌的丰度改变(P<0.05或0.01),且对Bacteroidota、Firmicutes相对丰度的改善作用明显好于单用MET或MLE(P<0.05或0.01)。属水平上,MET干预可明显降低T2DM小鼠粪便中Anaerovorax、Citrobacter、Clostridioides、Clostridium_methylpentosum、Gastranaerophilales、Peptococcus及Tuzzerella的相对丰度,升高Akkermansia及Parvibacter的相对丰度(P<0.05或0.01);MLE干预可明显降低T2DM小鼠粪便中Acetatifactor、Anaerovorax、Bilophila、Citrobacter、Clostridium_methylpentosum、Colidextribacter、Eisenbergiella、Eubacterium_xylanophilum、GCA-900066575、Intestinimonas、Lachnospiraceae_FCS020、Lachnospiraceae_NK4A136、Oscillibacter、Peptococcus、Tuzzerella的相对丰度(P<0.05或0.01);而两者联合不仅可明显改善T2DM小鼠粪便中上述细菌的相对丰度,还可影响Clostridia_vadinBB60、Eubacterium_siraeum、Harryflintia、Mucispirillum、Romboutsia等细菌的丰度改变,且对Akkermansia、Bilophila、Clostridioides、Colidextribacter、Eubacterium_siraeum、Gastranaerophilales、GCA-900066575、Intestinimonas、Lachnospiraceae_FCS020、Lachnospiraceae_NK4A136、Parvibacter、Peptococcus、Romboutsia、Tuzzerella的改善作用明显好于单用MET或MLE(P<0.05或0.01)。
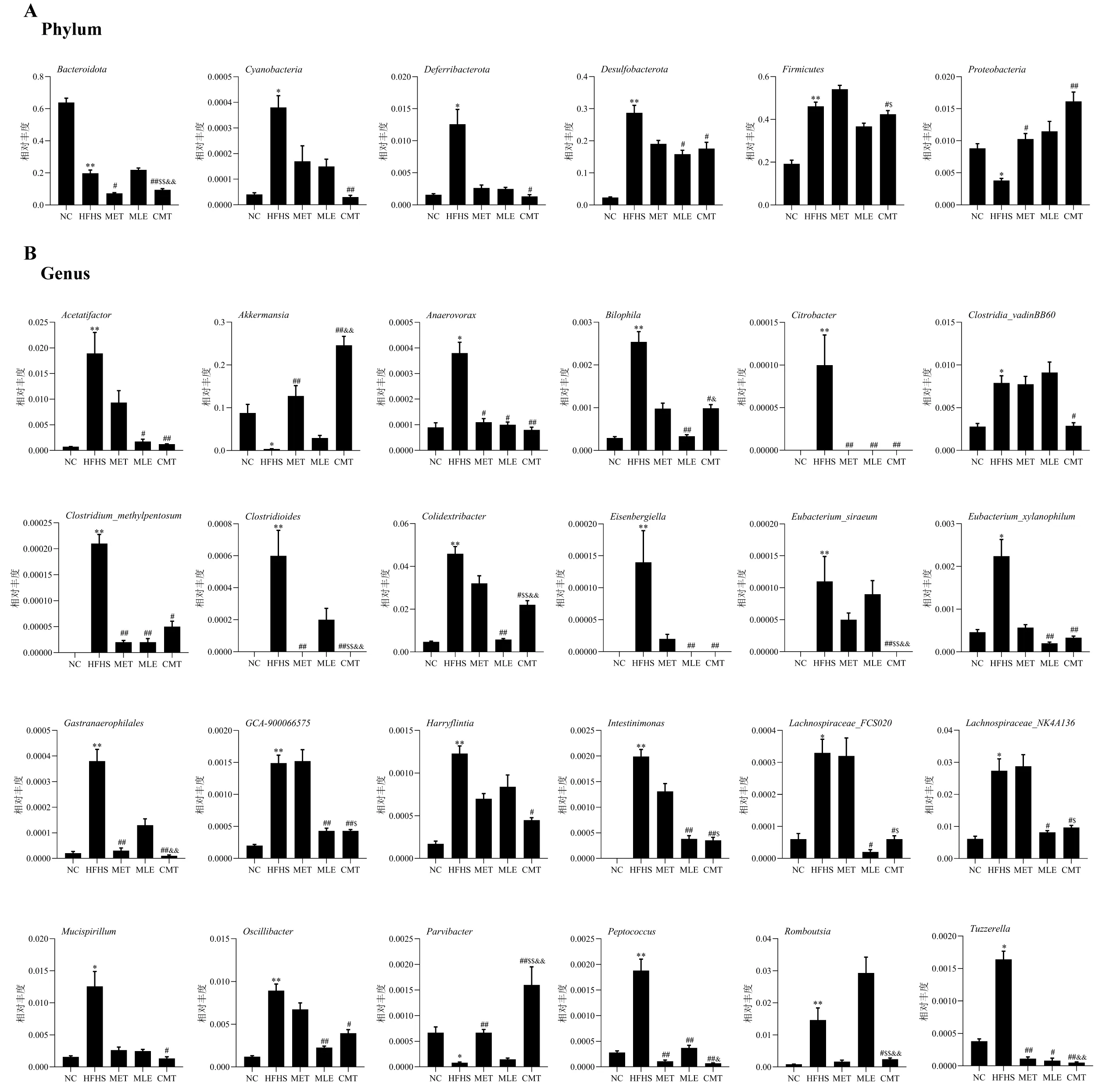
图4 小鼠肠道中门水平(A)及属水平(B)上的差异微生物Fig 4 Differential microbiota at the phylum(A)and genus(B)level in the gut of mice
3.3.4 相关性分析 为了确定肠道微生物群的改变与宿主表型之间是否存在潜在关联,本研究采用Spearman相关性分析探究属水平的差异细菌与生化参数之间的相关性,结果如图5所示。Acetatifactor、Anaerovorax、Bilophila、Clostridia_vadinBB60、Clostridium_methylpentosum、Clostridioides、Colidextribacter、Gastranaerophilales、GCA-900066575、Harryflintia、Intestinimonas、Oscillibacter、Peptococcus与FBG显著正相关;Romboutsia与C-肽显著正相关;Clostridia_vadinBB60、Gastranaerophilales、Romboutsia与TC显著正相关;Colidextribacter、GCA-900066575、Harryflintia、Intestinimonas、Oscillibacter与TG显著正相关;Clostridioides、Mucispirillum、Romboutsia与LDL-C显著正相关,而Parvibacter与LDL-C显著负相关;Anaerovorax、Clostridium_methylpentosum、GCA-900066575、Harryflintia、Intestinimonas、Oscillibacter、Peptococcus与HDL-C显著正相关;Clostridium_methylpentosum与体重显著负相关;Acetatifactor、Bilophila、Colidextribacter、Gastranaerophilales、Intestinimonas、Oscillibacter与IL-1β正相关;Clostridium_methylpentosum、Eubacterium_xylanophilum、GCA-900066575、Intestinimonas与IL-6正相关;Colidextribacter、Lachnospiraceae_NK4A136、Oscillibacter与IL-10正相关;Anaerovorax、Clostridium_methylpentosum、Colidextribacter、Eubacterium_xylanophilum、GCA-900066575、Intestinimonas、Oscillibacter与TNF-α正相关。

图5 属水平上的差异微生物与生化指标之间Spearman相关性分析热图Fig 5 Heatmap of Spearman correlation analysis between differential gut microbiota at genera level and biochemical indexes
4 讨论与结论
T2DM已成为危害人类健康的重要社会问题,作为一线基础降糖药使用的MET,其对T2DM所伴随的慢性炎症、血脂代谢紊乱、肝功能损伤及其他并发病的防治作用尚未得到有效临床验证[4],而桑叶含有生物碱、黄酮及酚酸类等成分[5-6],对T2DM的血糖、血脂、氧化应激、炎症等方面发挥多环节的调节作用[1-3,7]。据此,本研究从药效互补或协同角度,对MLE和MET的联合治疗作用进行了评价,并从肠道微生物角度探讨其潜在机制。
T2DM的典型病理特征包括血糖升高、胰岛β细胞功能受损、胰岛素抵抗、免疫功能低下等。持续高水平血糖可促进葡萄糖向脂肪转化,进而引起脂质代谢紊乱及血清TG、TC、LDL-C水平的升高及HDL-C水平的降低,而高脂饮食诱发的肥胖或超重又可引发慢性低度炎症,进而导致胰岛素抵抗或T2DM。本研究发现MLE单用可降低T2DM小鼠血清中FBG、INS、C-肽、TG、TC、LDL-C的水平,改善T2DM小鼠的胰岛素抵抗及对葡萄糖及胰岛素的耐受能力,但对T2DM小鼠的体重、脏器指数及HDL-C血清水平无明显影响;单用MET仅可改善T2DM小鼠血清中FBG、INS、C-肽、LDL-C的水平及胰岛素抵抗;两者合用不仅呈现出MLE及MET之间的互补效果,改善T2DM小鼠的上述指标,还可改善两者单用均不能影响的T2DM小鼠的肝脏指数。炎症可引发胰岛素抵抗,并推动T2DM的发生发展,而高脂饮食所致脂肪堆积可提升促炎因子的水平,诱发炎症及肝功能受损。LPS为革兰氏阴性菌的细胞壁降解产物,可激活Toll样受体4(TLR4)-髓样分化因子(MyD88)-核因子κB(NF-κB)或者TLR4-MyD88-c-Jun氨基末端激酶(JNK)信号通路,导致TNF-α、IL-1β、IL-6释放增加。本研究发现,MLE单用可明显降低T2DM小鼠血清LPS、AST、ALT水平及肝脏中TNF-α、IL-1β的表达,但对IL-6及IL-10的表达无影响;MET单用仅可降低T2DM小鼠血清LPS水平及肝脏TNF-α及IL-1β的表达;而两者联用,不仅呈现出了MLE与MET之间的互补作用,且可改善两者均不能影响的IL-6的表达。上述结果提示,MLE与MET之间存在一定程度的互补和协同作用,可全面改善T2DM小鼠的炎症、肝脏损伤、糖脂代谢异常。
越来越多的证据表明,肠道菌群失调所致细菌毒素、短链脂肪酸、胆汁酸、内源性大麻素类似物、碳水化合物、氨基酸等代谢产物水平变化与肥胖及T2DM的炎症、胰岛素抵抗、脂质代谢紊乱等密切相关[8]。肥胖及T2DM宿主的粪便中,通常呈现较高丰度的Firmicutes、Proteobacteria、Cyanobacteria及较低丰度的Bacteroidetes,而MET或桑叶干预可逆转上述细菌的丰度[9-10];本研究同样发现T2DM小鼠粪便中Firmicutes、Cyanobacteria的丰度显著增加,而Bacteroidetes的丰度显著降低;但本研究还发现,T2DM小鼠粪便中Proteobacteria的丰度显著降低,MET可进一步降低T2DM小鼠粪便中Bacteroidetes丰度的、增加Proteobacteria的丰度,MLE并不能显著改善上述细菌门的丰度,推测可能与模型、MLE及MET用量不同有关;而MLE及MET的联合使用可明显对抗T2DM小鼠粪便中Firmicutes、Proteobacteria、Cyanobacteria的丰度增加及Bacteroidetes的丰度降低。另外,本研究尚发现,T2DM小鼠粪便中Deferribacterota及Desulfobacterota的丰度显著增加,而MLE仅可降低Desulfobacterota的丰度,与MET联合则可同时逆转这两个细菌门的丰度增加。
从属水平看,既往研究表明,Acetatifactor及Bilophila与胆汁酸代谢异常密切相关,而Mucispirillum与炎症密切相关,在肥胖或T2DM宿主粪便中呈现较高水平[11];Parvibacter与血清LDL-C水平成负相关,Akkermansia与肠道通透性成负相关,均为有益菌,在肥胖宿主粪便中呈现较低丰度[12];另外,Anaerovorax、Citrobacter、Colidextribacter、Clostridioides、Eisenbergiella、Eubacterium_siraeum、Gastranaerophilales、Intestinimonas、Lachnospiraceae_NK4A136、Oscillibacter、Peptococcus及Tuzzerella[4,10,13-18]在肥胖或T2DM宿主肠道中均呈现较高丰度,与本研究结果相同。然而,既往研究表明Clostridia_vadinBB60与FBG显著负相关,Clostridium_methylpentosum及Eubacterium_xylanophilum为产短链脂肪酸菌,Romboutsia及Lachnospiraceae_FCS020为有益菌,在肥胖或T2DM宿主体内均呈现较低丰度[19],而本研究的结果正好相反,推测这种矛盾的结果可能与模型动物、饮食不同有关。此外,本研究还发现GCA-900066575及Harryflintia在T2DM小鼠粪便中呈现较高的丰度。药物干预改变疾病状态下细菌丰度,是其发挥作用的潜在机制之一。与以前研究一致的是[1,10,12],本研究同样发现MET可明显改善T2DM小鼠粪便中Gastranaerophilales、Peptococcus、Akkermansia的丰度,而MLE可明显改善Oscillibacter的丰度。本研究还发现,MET可明显改善T2DM小鼠粪便中Anaerovorax、Citrobacter、Clostridium_methylpentosum、Clostridioides、Parvibacter及Tuzzerella的丰度;MLE可明显改善T2DM小鼠粪便中Acetatifactor、Anaerovorax、Bilophila、Citrobacter、Clostridium_methylpentosum、Colidextribacter、Eisenbergiella、Eubacterium_xylanophilum、GCA-900066575、Intestinimonas、Lachnospiraceae_FCS020、Lachnospiraceae_NK4A136、Peptococcus及Tuzzerella的丰度;而两者联合不仅可明显改善T2DM小鼠粪便中上述所有菌属的丰度,且可明显改善两者均不能影响的Clostridia_vadinBB60、Eubacterium_siraeum、Harryflintia、Mucispirillum及Romboutsia等细菌的丰度。
综上所述,本研究发现MLE联合MET可明显改善T2DM小鼠体内的炎症及糖脂代谢紊乱,这种改善作用与其调控肠道菌群失调密切相关,且MLE与MET之间呈现一定程度上的互补及协同作用。

