NAD(H)调控线粒体功能在疾病中的作用
程子捷,呼庆勋(上海大学医学院,上海 200444)
线粒体是细胞内的重要细胞器,对维持细胞结构与功能具有多重作用。作为细胞的能量供应车间,线粒体利用多种能量物质合成生命活动所需的三磷酸腺苷(ATP);作为生物合成中心,核酸等生物大分子的合成前体在线粒体内生成;此外,线粒体内存在多种酶参与细胞信号传导和细胞凋亡等过程,并在调控细胞生长和细胞周期中发挥重要作用[1]。
烟酰胺腺嘌呤二核苷酸NAD(H)是一种存在于活细胞中的辅酶,在生物体内常以氧化态NAD+和还原态NADH的形式存在;在细胞内的一系列生物过程中,两者可以相互转化。研究表明,NAD(H)不仅是线粒体中必不可少的氧化还原辅助因子,也作为关键信号分子,在发生营养摄入改变或细胞损伤等环境变化时调控细胞功能,包括影响线粒体功能、DNA 损伤修复、细胞凋亡、细胞衰老、信号转导等多个方面[2-3]。越来越多的证据表明,细胞内NAD(H)代谢异常会影响线粒体结构与功能,从而诱发多种疾病。本文综述NAD(H)在细胞内的合成、消耗、转化与检测过程,并阐述NAD(H)通过调控线粒体功能影响疾病发生与发展的分子机制,旨在为疾病预防和诊疗提供新的研究思路。
1 NAD(H)的合成与转化
1.1 NAD(H)的合成
NAD(H)几乎存在于生物体内所有活细胞中,主要有三种合成路径,分别为犬尿酸途径(De Novo synthesis)、Preiss-Handler途径和补救途径(Repair)(见图1)。

图1 NAD(H)的生物合成途径Fig 1 Biosynthetic pathway of NAD(H)
在犬尿酸途径中,色氨酸(Trp)经多步反应转化为烟酸单核苷酸(NAMN),NAMN最终经一系列酶的催化生成NAD(H)[3-5]。
在Preiss-Handler途径生成中,烟酸(NA)经烟酸转磷酸核糖基酶(NAPRT)催化作用生成NAMN。NAMN最终经一系列酶的催化生成NAD(H)[3-5]。
在哺乳动物中,第三种NAD(H)合成路径——通过“补救途径”从烟酰胺(NAM)、NA、烟酰胺核苷(NR)和烟酰胺单核苷酸(NMN)中回收是维持胞内NAD(H)正常水平最重要的合成途径[3]。NAM既是NAD(H)消耗酶如NAD(H)依赖的蛋白去乙酰化酶sirtuins(SIRTs)、聚ADP-核糖聚合酶(PARPs)、CD38等的副产物,也可能来源于外界食物摄取[4]。在补救途径中,首先NAM经烟酰胺转磷酸核糖基酶(NAMPT)和烟酰胺单核苷酸腺苷转移酶(NMNAT)催化生成NAD(H)[6]。其中NMNAT3主要分布在线粒体中,对线粒体呼吸产生重要影响[7-8]。
1.2 NAD(H)的消耗
在生物体中,NAD(H)合成与降解之间存在动态平衡。与氧化还原反应不同,在细胞内存在多种酶,包括SIRTs、PARPs、NAD(H)糖水解酶与环ADP-核糖(cADPR)合成酶CD38、CD157和SARM1(sterile alpha and TIR motif containing 1)等,能够在发挥自身生理功能的同时,将NAD(H)分解为NAM[9]。
目前已发现SIRTs家族中存在七种亚型,分别命名为SIRT1~SIRT7,其中SIRT3~SIRT5主要分布在线粒体;作为NAD(H)依赖的蛋白去乙酰化酶,SIRTs与特定蛋白相结合并发生去乙酰化,并将辅助底物NAD(H)转化为NAM,从而调节生物体内关键信号通路[10-12]。PARP1-PARP3能够将NAD(H)作为单ADPR或聚ADPR靶蛋白的共底物,介导NAD(H)分解产生副产物NAM和ADPR,并在DNA损伤修复、转录调控、细胞凋亡等过程中发挥作用[9,13]。
CD38和CD157是多功能的胞外酶,具有糖水解酶和ADP-核糖环化酶的活性,将NAD(H)分解为NAM和cADPR[14-15];此外,二聚化SARM1能够产生相似催化作用,将NAD(H)水解为ADPR和NAM,并产生少量的cADPR[16]。
1.3 NAD(H)的生物转化
1.3.1 NAD+与NADH的相互转化 葡萄糖是人体内的主要能量来源,进入胞质后在多种酶的催化下经有氧糖酵解生成丙酮酸,在此过程中伴随着NAD+和NADH的转化及ATP生成[17]。此后,丙酮酸在胞质内生成乳酸,或进入线粒体后经氧化脱羧生成乙酰辅酶A,从而参与三羧酸循环(TCA循环);在此过程中生成大量ATP,同时NAD+转化为NADH[18]。最终,NADH经电子传递链(ETC)再次氧化为NAD+,维持细胞内NADH与NAD+的动态平衡;随着质子从线粒体内膜向外层转移,所形成的跨膜氢离子梯度提供势能,驱动氧化磷酸化(OXPHOS)反应合成ATP,这一过程由五种结构复杂的酶协同催化完成[9,18](见图2)。
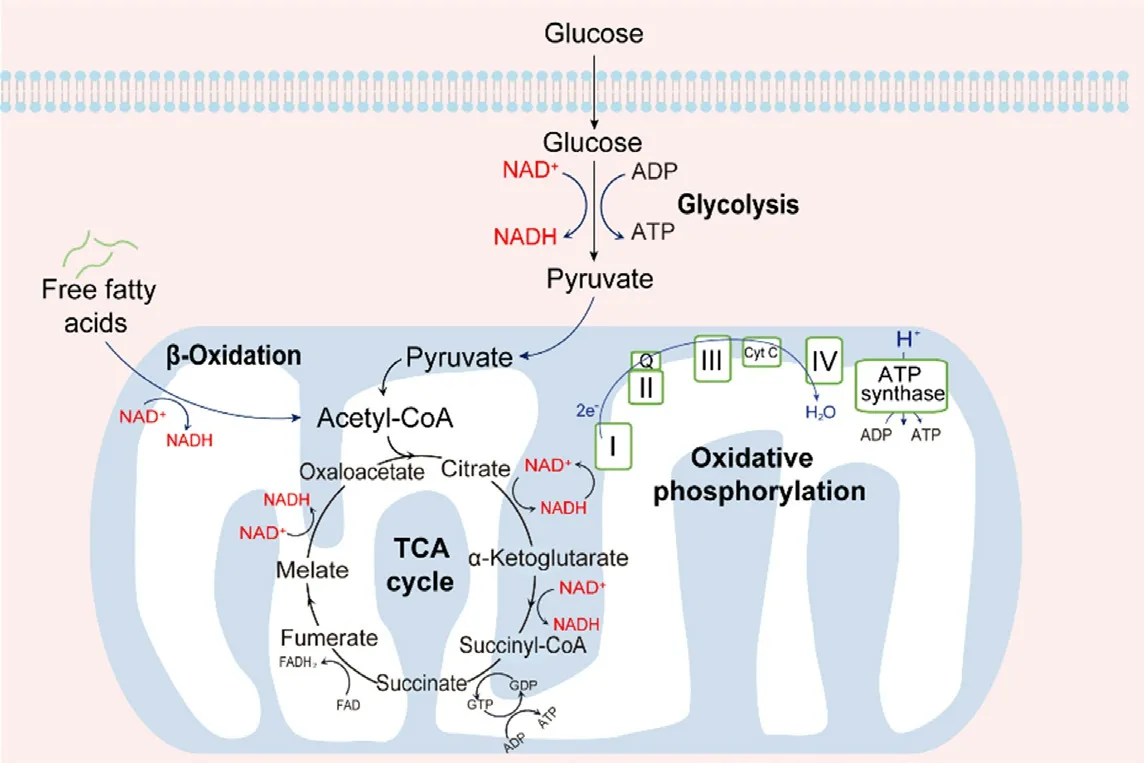
图2 NAD(H)的生物转化途径Fig 2 Biological conversion of NAD(H)
有研究表明,约有70%的NAD(H)存在于线粒体中;脂质载体蛋白(SLCs)是生物体内重要的转运家族,其中SLC25A51通过调控线粒体代谢和ETC中复合物Ⅰ的功能,进而影响线粒体消耗氧气和产生ATP以及将NAD+转运到线粒体基质中的能力[19]。由于细胞内的大多数生理活动都依赖ATP提供能量,因此探究NAD(H)对线粒体能量代谢和器官功能的影响具有重要意义。
1.3.2 NAD+与NADP+的相互转化 除了NAD+与NADH的相互转化,细胞内约有10%的NAD+可以被烟酰胺核苷酸转氢酶(NNT)和NAD+激酶(NADKs)磷酸化为NADP+[3]。NADPH是NADP+的还原形式,线粒体内NADPH可在ME3将丙酮酸转化为苹果酸的过程中和IDH2催化异柠檬酸转化为α-酮戊二酸的过程中产生[20]。这些烟酰胺核苷酸在氧化形式(NAD+和NADP+)和还原形式(NADH和NADPH)之间不断相互转化,作为生物合成途径中的重要辅助因子而发挥作用[8]。
2 NAD(H)的测定
NAD(H)的分布与代谢具有组织特异性,因此检测NAD(H)的合成与消耗途径,以及其在不同类型的细胞、组织、生理状态和疾病中的差异具有重要意义。
引入14C标记的NR等NAD(H)前体后,测定NAD(H)标记可以量化NAD(H)的合成和消耗通量[21]。液相色谱-质谱联用技术对NAD(H)的定量标记也具有广泛应用前景,在研究中曾用于检测人体活检样本[22]。近年来,也有研究构建出靶向线粒体的生物传感器,通过实时成像并检测活细胞内线粒体和细胞质中的NAD+/NADH比率,为探究NAD(H)调控不同细胞、组织和器官中的线粒体功能提供了可能[23]。
3 NAD(H)在相关疾病中的调控作用
3.1 NAD(H)调控线粒体功能在神经系统变性疾病中的作用
神经元细胞代谢功能障碍是阿尔茨海默病(AD)、帕金森综合征(PD)和亨廷顿病(HD)等神经系统变性疾病发生的原因之一,大量研究证实NAD(H)代谢参与神经系统变性疾病的发生与发展过程,线粒体能量稳态的丧失是影响神经系统变性疾病的发病和进展的重要因素[24-25]。
3.1.1 AD 在AD模型中可以广泛观察到线粒体游离NAD(H)水平降低,有学者认为这一特征与年龄依赖性的NAMPT基因表达缺失和代谢变化相关[25-26],也可能与糖酵解通量受损所导致的胞质NADH产生减少和线粒体碳通量供应减少相关[27]。在载脂蛋白E4(ApoE4)表达的神经元中,NAD+/NADH比值降低引起线粒体氧化磷酸化受损,ECT中线粒体复合物Ⅳ的活性降低,最终导致ATP生成能力降低,加速AD疾病进程[28]。因此,维持适当的NAD(H)水平能够维持线粒体完整性和神经元细胞活力。
除底物水平外,NAD(H)代谢还可以通过其他途径影响线粒体功能。NAD(H)通过调节氧化磷酸化和SIRT3~SIRT5活性在线粒体中发挥重要作用,并通过SIRT1-PGC-1α轴介导线粒体内的生物合成[25]。在AD患者中,神经元SIRT3通过在K320位点去乙酰化p53,阻止线粒体p53诱导的细胞死亡和线粒体功能障碍,从而调节线粒体活性氧(ROS)水平与耗氧量[29]。Sorrentino等[30]研究发现通过诱导应激相关的激活转录因子-1(ATFS-1),NR等NAD+前体能够有效激活线粒体非折叠蛋白反应(UPRmt)和线粒体自噬途径,从而降低AD模型中的Aβ蛋白的聚集与毒性,维持线粒体蛋白平衡。
3.1.2 PD PD患者在临床上常表现为肌肉震颤、肌强直和运动功能减退,线粒体功能障碍是关键致病标志之一。Tapias等[31]研究发现氧化还原失衡和黑质纹状体多巴胺(DA)神经变性是导致ETC复合物Ⅰ持续抑制和线粒体功能障碍的主要原因。
Schondorf等[32]研究发现NAD(H)代谢增强可以显著改善神经元的线粒体功能。在鱼藤酮诱导的PD细胞模型中,上调NAD(H)介导的SIRT3通路能够通过保护线粒体膜电位而提高细胞存活率,减轻细胞内超氧化物歧化酶(SOD)和谷胱甘肽(GSH)水平并减少ROS产生[33]。Park等[34]研究发现线粒体SIRT3受AMPKα-CREB信号通路影响与PD患者α-突触核蛋白(α-syn)聚集和DA神经元变性成负相关,从而减少α-syn所诱导的线粒体ROS。
此外,也有研究发现PINK1基因是可导致PD的致病性变异基因之一,PINK1和Parkin通过PARIS/PGC-1α轴调控线粒体生物合成并维持线粒体功能[35-36]。NAD(H)介导的SIRT3途径可以通过结合PINK1和E3泛素蛋白连接酶Parkin(PARK2)使其去乙酰化,以促进线粒体自噬[37]。3.1.3 HD HD是一种常染色体显性遗传性神经系统变性疾病,患者会出现运动、认知等方面的障碍;细胞代谢与线粒体功能障碍也是HD细胞中的重要特征[38]。在来源于HD患者的iPSC(HD-iPSC)细胞中,存在线粒体呼吸减弱,ATP/ADP降低,PGC-1α和复合物Ⅲ亚基表达和活性减弱等特征[39];这可能与4号染色体短臂上亨廷顿蛋白Htt突变体降低了SIRT3的去乙酰化酶作用相关,进而导致NAD(H)水平下降[29]。
目前,通过NAD(H)代谢途径调控SIRTs介导的各项生理活动具有很大的潜力,纠正氧化还原紊乱也被认为是预防或治疗神经系统变性疾病的一种潜在策略。例如,通过长期给予吩噻嗪治疗可使NADH/NAD+比例正常化,从而维持线粒体完整性并保护黑质纹状体多巴胺系统,改善大鼠的PD样行为缺陷[31]。Zhang等[40]发现使用鸢尾素也可以通过整合素受体上调下游Akt信号通路和ERK1/2信号通路,提高线粒体复合物Ⅰ活性和mtDNA拷贝数,促进NAD+再生和ATP合成。
3.2 NAD(H)调控线粒体功能在衰老中的作用
衰老是机体内不可逆的生理过程,在生长发育达到成熟期后,人体内各组织、器官发生退行性变化导致生理功能降低和紊乱。由于合成与降解失衡,多种组织中的NAD(H)水平随年龄增长而下降[4,41]。有研究表明,在年老或患病的动物中恢复NAD(H)水平可能通过多种作用途径延长寿命[6,42]。
在衰老过程中,NAD(H)水平下降通过SIRTs和PARPs调节p53、NF-κB、PGC-1α和HIF-1α等信号通路,导致氧化损伤、昼夜节律异常、代谢紊乱和线粒体功能障碍[3,43]。有研究发现,在老年小鼠中PARPs异常激活能够抑制SIRT1活性,并导致线粒体功能障碍;使用PARPs抑制剂和NAD(H)前体可以缓解这一过程[3]。在秀丽隐杆线虫中,NAD(H)水平升高后通过SIRT2.1影响有丝分裂蛋白失衡,并通过UPRmt激活应激信号、FOXO转录因子DAF-16的核易位和激活延长寿命[42]。提高NAD(H)水平可以通过SIRTs途径恢复老年小鼠的线粒体功能[3],因此,调控线粒体NAD(H)代谢在衰老和长寿中起重要作用。
3.3 NAD(H)调控线粒体功能在心血管疾病中的作用
3.3.1 缺血再灌注 在心肌细胞中,线粒体氧化磷酸化是细胞内ATP产生的主要途径。当血流量减少时会产生有害的细胞过程,而再灌注也导致许多独立于凋亡和坏死组织损伤的信号通路的激活,例如介导线粒体损伤增加ROS的产生,胞质诱导的线粒体Ca2+超载,NADH/FAD氧化还原比率降低,以及线粒体通透性转换孔(mPTP)的形成和开放等,最终导致细胞死亡[44]。
SIRT4是一种线粒体定位的sirtuin,在心脏中大量存在,其作用与调控细胞能量代谢和应激反应相关。与SIRT1和SIRT3不同,目前对SIRT4的生理机制研究相对有所欠缺。在心肌细胞缺血再灌注(IR)后,体外和体内模型中均可检测到SIRT4下调,SIRT4过表达后心肌梗死面积和血清肌酸激酶(CK)水平降低;因此通过NAD(H)途径激活SIRT4可能通过维持线粒体功能以及减少心肌细胞凋亡,从而保护IR损伤的心脏[11]。
还有研究发现,SIRT4过表达能够通过抑制AKT/mTOR途径依赖性自噬,抑制阿霉素给药后引起的心肌细胞凋亡,从而起到心脏保护作用[15,45]。因此,继续探索心肌细胞中SIRT4作用机制具有广泛的研究价值,为心脏保护药物的研发提供了新的思路。
3.3.2 糖尿病心肌病(DCM) 目前,2型糖尿病的发病率正在逐渐上升,DCM是2型糖尿病的主要并发症之一。DCM心功能障碍与代谢异常有关,表现为NAD+/NADH比率降低、脂肪酸摄取率提高和线粒体ETC缺陷[46]。
一系列研究表明,上调SIRT3也在改善DCM线粒体功能中起关键作用。在db/db小鼠心脏组织中,外源性给予硫化氢(H2S)能够恢复心肌细胞中NAD+/NADH比率,提高SIRT3的表达和活性,降低了线粒体乙酰化水平,从而增强了线粒体ETC活性并提高ATP生成水平[12]。鹰嘴豆黄酮粗提物(CCFE)也通过PARPs和SIRT3途径,改善NAD+/NADH氧化还原失衡和线粒体复合物Ⅰ的功能障碍;同时降低血清中的过氧化氢(H2O2)和丙二醛(MDA)水平,并上调谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)[47]。
3.3.3 心力衰竭(HF) HF与主动脉硬化、心肌和微血管重构相关,HF的患病风险随着年龄的增长而飙升[48]。有研究者在HF模型中发现一种独特的蛋白质乙酰化模式,即在射血分数保留的心力衰竭(HFpEF)小鼠心脏中观察到蛋白质赖氨酸乙酰化(LysAc)升高[49]。研究表明,这一特征与NAD+/NADH比率降低、线粒体功能受损和TCA代谢物减少相关;通过补充NR可使NAD+/NADH比率正常化,乙酰化水平降低,从而改善线粒体功能和HFpEF表型[49]。
此外,研究发现这种NAD(H)氧化还原失衡所引起的线粒体蛋白超乙酰化修饰主要通过两种不同的机制促进心脏的病理性重构:首先,线粒体苹果酸-天冬氨酸穿梭蛋白的高乙酰化抑制线粒体中NAD(H)的氧化和运输,导致细胞质中氧化还原的不平衡;其次,寡霉素敏感赋予蛋白的乙酰化修饰增加了其与亲环蛋白D的结合,增强了线粒体通透性过渡孔的敏感性[50]。
3.3.4 肥厚性心肌病(HCM) 人类HCM是一种常见的遗传性心肌病,以舒张功能受损和左心室不对称肥厚为主要特征。研究表明,HCM线粒体功能障碍与心肌细胞结构破坏有关,可以通过改善NAD(H)驱动的线粒体呼吸来纠正[51]。
在HCM中还可以观察到能量代谢紊乱,表现为ATP生成减少和涉及ATP合成的线粒体基因表达降低,如催化TCA循环的大多数基因(CS、IDH2、OGDH、SUCLA2、FH和MDH1)和参与线粒体能量代谢的关键基因的下调,包括ANT1(腺嘌呤核苷酸转位酶1型)、CKM2(肌酸激酶2)等[52]。通过电子显微镜可以观察到受损的线粒体比例增加,嵴密度降低,线粒体内膜肿胀及嵴密度降低[52]。
因此,线粒体能量代谢结构和功能的损伤可能是HCM功能恶化的一个重要机制,线粒体也有望成为改善或预防HCM中心脏重构的新药物靶点。
3.4 NAD(H)调控线粒体功能在肿瘤中的作用
随着肿瘤研究不断深入,研究者们发现线粒体是肿瘤细胞增殖、存活和转移的代谢枢纽,线粒体中的各种代谢途径也能影响肿瘤的代谢和进展。例如,缺氧是大多数肿瘤微环境的显著标志;肿瘤细胞线粒体呼吸缺陷导致NAD(H)增加,AKT信号通路激活,从而使肿瘤细胞在缺氧条件下获得耐药性和生存优势[53]。
分布在线粒体上依赖NAD(H)的SIRTs与细胞自噬密切相关,根据诱导或抑制自噬的策略不同,可以对不同种类或分期的肿瘤细胞产生不同影响[15,54]。例如在肿瘤细胞中,缺氧诱导的自噬可以减少氧化损伤,促进肿瘤细胞存活[53]。而SIRT4可以通过抑制谷氨酰胺代谢激活p53蛋白的磷酸化,同时腺苷酸活化蛋白激酶α(AMPK)也参与了SIRT4介导的自噬和p53磷酸化的调控,从而抑制胰腺肿瘤的发生[55];因此线粒体NAD(H)介导的SIRT4/AMPKα/p53/自噬轴在人类胰腺导管腺癌中可能具有临床意义。
信号转导及转录激活因子3(STAT3)是一种参与炎症和肿瘤发生的转录因子,其结构部分定位于线粒体;有研究表明,STAT3在三阴性乳腺癌中起着重要的促癌作用,当STAT3缺失时复合物Ⅰ活性降低,导致NAD(H)再生受损,从而抑制抗氧化基因的表达[56]。
广泛研究证实,调控NAD(H)代谢途径是抑制肿瘤细胞增殖和转移,促进细胞凋亡的有效方法。Zhang等[57]研究发现在前列腺癌细胞中敲低ACACA基因(编码乙酰辅酶A羧化酶α形式的基因),能够提高NAD+/NADH比率和ROS水平,减少线粒体ATP生成,从而减小肿瘤体积与重量。肿瘤干细胞高度依赖氧化磷酸化获得能量,因此靶向氧化磷酸化或相关基因、相关酶的抑制剂被认为可以有效杀灭肿瘤干细胞[53,58]。例如,小分子化合物DX2-201通过抑制氧化磷酸化并直接结合线粒体复合物Ⅰ的NDUFS7亚基,可以实现对胰腺癌的有效治疗[59]。
综上所述,探究线粒体NAD(H)在肿瘤代谢和进展中的作用,有利于了解肿瘤发生机制并开发新的治疗策略。
3.5 NAD(H)调控线粒体功能在肝脏疾病中的影响
在肝组织中,端粒功能障碍和p53通过p53依赖性抑制过氧化物酶体增殖物激活受体γ辅激活物-1α/β(PGC-1α/β)机制下调线粒体SIRTs;补充NAD(H)后可逆转肝组织中p53、FOXO1、PGC-1α、SOD2和CPS1等SIRTs靶点的超乙酰化,从而稳定端粒并改善肝纤维化[60]。此外,依赖NAD(H)的SIRT3能够通过肝细胞中AMPK-UNC51样激酶1(ULK1)途径,促进脂滴自噬降解,促进脂滴在去酪氨酸微管上分散,抑制硬脂酰辅酶A去饱和酶1(SCD1)表达从而抑制脂肪生成,使长链酰基辅酶A脱氢酶(LCAD)去乙酰化,增强线粒体脂肪酸氧化,从而改善肝细胞中的脂肪毒性,在非酒精性脂肪肝病中发挥保护作用[61]。
此外,Katsyuba等[62]发现ACMSD主要表达于肾脏和肝脏,表明ACMSD是肝肾细胞NAD(H)水平、SIRTs活性和线粒体稳态的关键调节剂。在NR诱导肝细胞NAD(H)合成的过程中,烟酰胺核苷激酶1(NRK1)是限速酶;Sambeat等[63]发现NRK1缺乏会导致糖异生潜能降低和PARP1活性受损,因此更容易受到饮食诱导的肝脏DNA损伤。因此,调控NAD(H)代谢途径的关键酶和信号通路也可以作为肝脏疾病防治的潜在靶点。
4 总结与展望
综上所述,NAD(H)通过调节生物体内的氧化还原平衡、基因表达、细胞能量代谢和SIRTs等NAD(H)依赖酶的活性来影响线粒体的结构与功能,从而在疾病的发生发展中发挥重要调节作用。已有研究应用NAD(H)增强剂调节线粒体功能,旨在治疗NAD(H)缺乏的相关疾病或延长生物体寿命。例如,给予NAD(H)前体NR可以使AD小鼠神经细胞线粒体SIRT3活性增加,从而改善认知功能[13]。
但目前,研究者对NAD(H)在体内的药代动力学仍知之甚少,也仍需通过更多研究确定不同NAD(H)前体的特定效应分子。因此在临床治疗中有必要针对不同的人类疾病和人群特征对NAD(H)增强剂的疗效、治疗剂量和给药途径进行优化,从而提高治疗效果。同时,NAD(H)介导的线粒体代谢研究也需要不断深入,通过探究NAD(H)在不同疾病状态下调控线粒体功能的复杂机制和潜在的药物治疗靶点,为以NAD(H)为核心的疾病预防和诊疗研究提供新的思路。

