莪术醇片剂的制备及大鼠在体肠吸收研究
李林峻,刘国翔,刘张驰,王炎,张玮,王娟,2*(.桂林医学院药学院生药学重点实验室,广西 桂林 5499;2.桂林医学院药学院基础医学院,广西 桂林 5499)
莪术醇为姜科植物莪术中的特征性成分[1],现代药理学研究证实莪术醇对多种癌症具有抑制作用[2],例如卵巢癌[3]、结直肠癌[4]、鼻咽癌[5]、胃癌[6]和乳腺癌[7]等,这表明莪术醇在癌症治疗中具有巨大潜力。一方面,莪术醇作为倍半萜类化合物[1],在水中的溶解率低[8],这导致其存在吸收不完全或生物利用度差等问题,从而限制了莪术醇的临床应用;另一方面,虽然目前有含莪术成分的中成药上市,但针对莪术醇单体,尚无相关剂型上市。因此开发莪术醇新剂型,对推进莪术醇的临床应用及相关研究具有重要意义。针对以上问题,目前已有研究将莪术醇制备成脂质体[9]、固体分散体[10]、纳米混悬剂[11]等剂型,但尚未见将莪术醇制备为片剂的相关报道。
片剂是由药物成分和相关辅料混合均匀后压合而成的片状剂型,是活性药物成分成药的首选和最常用的药物剂型。相较于其他药物剂型,例如脂质体、固体分散体等,片剂具有制备简单、成本低和便于携带等优点[12],并且制剂所用的亲水性高分子辅料在胃液中形成胶体使药物较为均匀地分散在胃液中[13],一定程度上解决了莪术醇吸收不完全或生物利用度差的问题。本课题组通过湿法制粒压片法将莪术醇制备成片剂剂型,通过对莪术醇片剂性能和体外累计溶出的考察以及大鼠在体肠循环的实验,初步建立莪术醇片剂的制备工艺并探索了其在大鼠小肠中的吸收速率,以期为莪术醇片剂向工业化生产的转化提供参考。
1 材料
1.1 仪器
高效液相Waters e2695(沃特世科技有限公司);YC-5单冲压片机(广州金本机械设备有限公司);片剂四用测定仪、智能药物溶出度仪(上海黄海药检仪器有限公司);NanoQuant酶标仪(瑞士帝肯);pH计(梅特勒-托利多仪器有限公司);千分之一电子天平(岛津企业管理有限公司);RO反渗透净水器(台湾力宵泵业有限公司);超纯水机(广西南宁市博美生物科技有限公司)。
1.2 试药
莪术醇(纯度:99%,自制);一水合乳糖(安徽山河药用辅料股份有限公司);玉米淀粉、羟丙基甲基纤维素、滑石粉(上海阿拉丁生化科技股份有限公司);聚维酮、硬脂酸镁(安徽山河药用辅料股份有限公司);盐酸、磷酸二氢钠、氢氧化钠、冰醋酸、乙醇(西陇科学股份有限公司);乙酸钠(成都市科龙化工试剂厂);十二烷基硫酸钠(北京索莱宝科技有限公司);乙腈(安徽天地高纯溶剂有限公司)。
1.3 动物
SPF级SD大鼠6只,雄性,体重(200±20)g [湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2019-0004,动物使用证号:SYXK(桂)2020-0005]。
2 方法与结果
2.1 莪术醇片剂体外累计溶出度分析方法的建立
2.1.1 色谱条件 色谱柱为ODS柱(Atlantis d C18,4.6 mm×250 mm,5 μm);流动相为水-乙腈(30∶70);流速为1.0 mL·min-1;检测波长为210 nm;柱温为30℃;进样量为20 μL。
2.1.2 方法学考察 精密称取莪术醇对照品20 mg,于1 mL无水乙醇中溶解得到20 mg·mL-1的莪术醇对照品母液,精密吸取0、0.625、1.25、2.5和5 μL的莪术醇对照品溶液于1 mL无水乙醇中混匀,得到质量溶度分别为0、0.125、0.025、0.05和0.1 mg·mL-1的对照品溶液。以峰面积(A)对质量浓度(C)进行线性回归,得回归方程A=1.756×104C+1.178×104(R²=0.9989),莪术醇在0~0.1 mg·mL-1时与峰面积线性关系良好;供试品中其他成分对目标峰没有干扰,见图1。说明该方法专属性良好;平行配制6份对照品溶液进行重复性测试,RSD=0.85%,表明该方法重复性较好。

图1 莪术醇体外溶出的HPLC图Fig 1 HPLC chromatography of in vitro dissolution of curcumol
2.2 莪术醇XRD分析
取莪术醇对照品研磨后进行XRD分析,检测条件为步长0.02°,扫描范围5°~90°,电压40 kV,电流40 mA。结果显示,本实验室纯化的莪术醇在8.238°、14.280°、16.516°和21.897°处有较为明显的衍射峰,说明其以晶体形式存在,后续实验都使用该晶型的莪术醇。
2.3 莪术醇粒径分析
使用研钵对莪术醇晶体进行研磨,采用筛分法对莪术醇的粒径进行分析,选择孔径分别为25、45、75、88和125 μm的筛网,按照孔径从小到大依次摞起,最下面为筛底,手动震动若干小时后,记录每层筛网中莪术醇粉末的质量,并由此求得莪术醇粒径的累计分布函数。经过分析,莪术醇晶体研磨后的粒径主要集中在45 μm,质量分数为57.66%,σg=0.707,表示粒径比较集中。R2=0.991,表示对数正态拟合的相关性较好。
2.4 莪术醇片剂的制备
将处方中各组分及辅料过筛备用。称取处方量的主药、填充剂及崩解剂混匀,加入黏合剂制软材。过筛制湿颗粒,干燥,整粒。加入处方量的填充剂及润滑剂混匀,压片,即得。
2.5 处方单因素考察
2.5.1 黏合剂和润滑剂种类的考察 选择聚维酮和羟丙甲纤维素为黏合剂筛选对象,硬脂酸镁和滑石粉为润滑剂筛选对象。分别以聚维酮&硬脂酸镁、聚维酮&滑石粉、羟丙甲纤维素&硬脂酸镁以及羟丙甲纤维素&滑石粉作为黏合剂或润滑剂制备得到片剂,以片剂性能(外观、片重差异、硬度和脆碎度)以及体外累计溶出度为考察指标,初步确定制剂所用的黏合剂及润滑剂种类,结果见表1。当润滑剂选用滑石粉时,得到的片剂有裂片现象,推测以润滑剂为滑石粉时片剂压合效果不好导致,所以初步确定处方润滑剂选用硬脂酸镁。由聚维酮&硬脂酸镁所制得的片剂脆碎度较高,且有破碎现象,推测选用黏合剂为聚维酮时片剂黏合效果不好导致,所以初步确定处方中黏合剂选用羟丙甲纤维素。

表1 不同黏合剂和润滑剂对莪术醇片的影响Tab 1 Effect of different adhesives and lubricants on curcumol tablets
2.5.2 主药和黏合剂用量考察 考察不同比例的主药和黏合剂对片剂性能和体外累计溶出度的影响,初步确定最适的主药和黏合剂用量,结果见表2和图2。改变主药的含量对片剂性能的影响并不大,片剂的片重差异、硬度和脆碎度等指标都符合标准。进一步检测片剂累计溶出度,发现主药含量会影响体外累计溶出度,只有主药含量为13.3%时,其60 min的体外累计溶出度达到了80%以上,所以最终确定主药含量为13.3%(见图2A)。
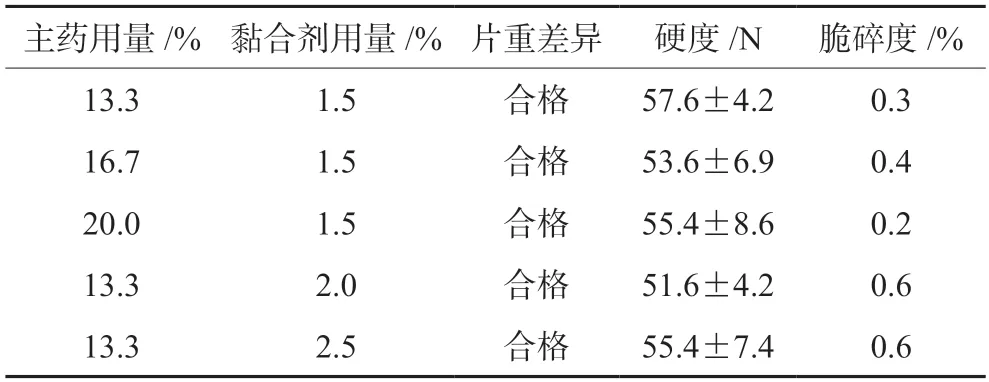
表2 主药和黏合剂不同用量对莪术醇片的影响Tab 2 Effect of different dosages of main drug and adhesive on curcumol tablets
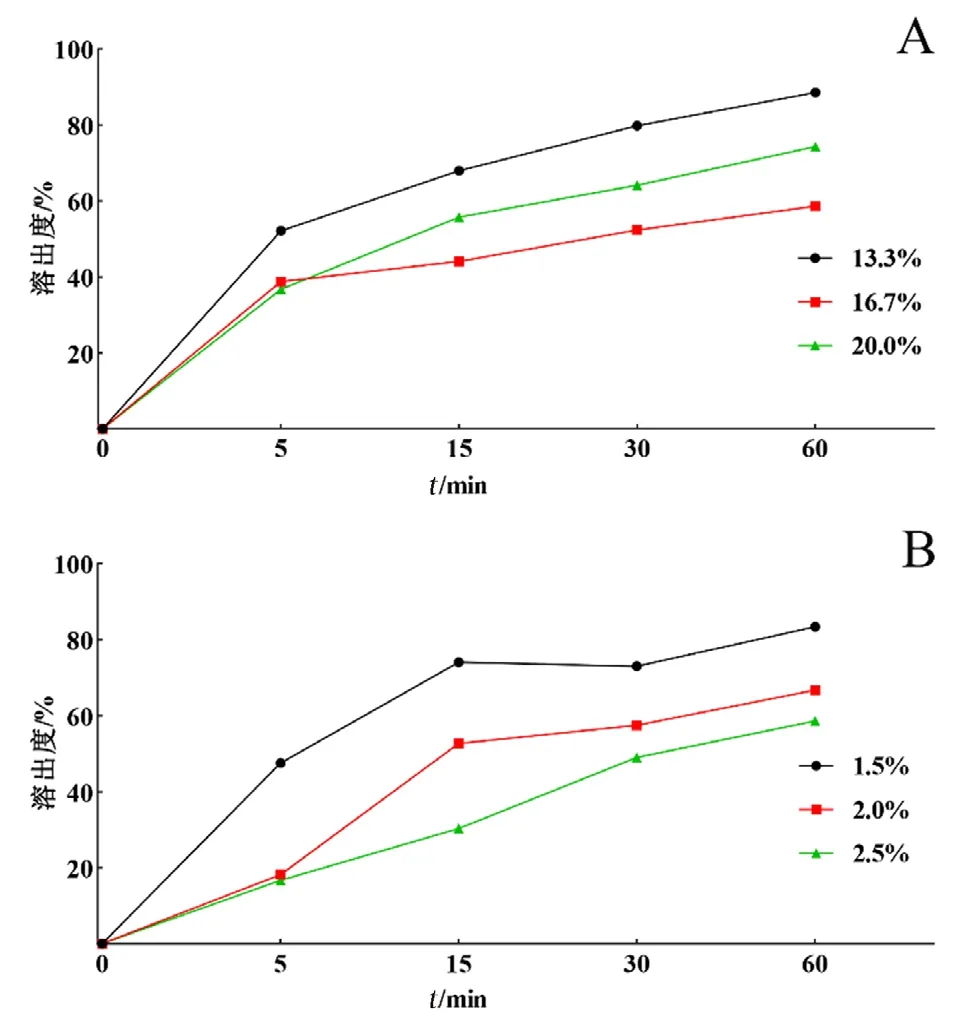
图2 主药(A)与黏合剂(B)用量对莪术醇片的影响Fig 2 Effect of different dosages of main drug(A)and adhesive(B)on curcumol tablets
由表2可知,黏合剂用量改变,虽然片剂的重量、硬度和脆碎度等有差异,但总体均符合标准。图2B片剂溶出度结果表明,黏合剂含量的不同能显著影响片剂的体外累计溶出度,2.0%和2.5%含量的黏合剂制备出来的片剂,其在60 min时的体外累计溶出度仅为60%左右,相比较下,1.5%含量的黏合剂时其在60 min时的体外累计溶出度达到了80%以上,溶出效果较好。所以选择1.5%黏合剂为最适用量。
2.6 体外累计溶出度评价
取自制的莪术醇片剂,参照《中国药典》溶出度与释放度测定法,选择第二法桨法体外累计溶出度的测定。分别以2 mg·mL-1十二烷基硫酸钠(SDS)的水溶液900 mL,2 mg·mL-1SDS的pH 6.8磷酸缓冲液900 mL,2 mg·mL-1SDS的pH 4.5乙酸缓冲液900 mL和2 mg·mL-1SDS的0.1 mol·mL-1盐酸溶液900 mL作为溶出介质,转速为100 r·min-1,不同时间点取溶液2 mL,同时补充同温的溶出介质2 mL,经0.45 μm滤膜过滤,利用HPLC进行测定。计算莪术醇在不同溶出介质中的累计释放百分率,结果见图3,莪术醇片剂在不同溶出介质中60 min内溶出率达到80%,溶出率均符合要求。
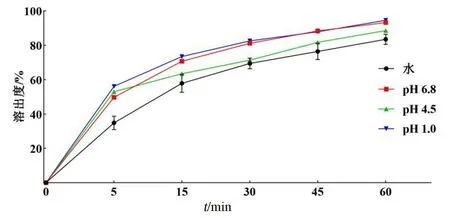
图3 莪术醇片在不同溶出介质中的溶出曲线Fig 3 Dissolution curves of curcumol tablets in different dissolution media
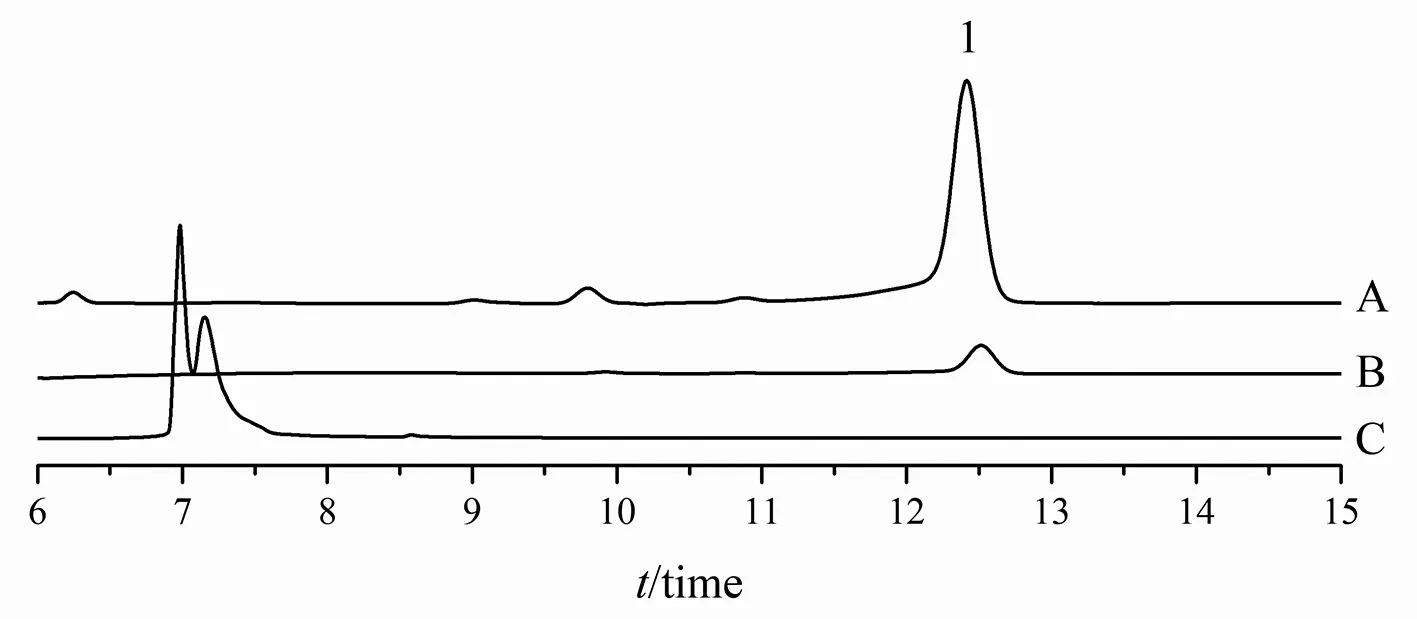
图4 莪术醇肠灌注液的HPLC图Fig 4 HPLC chromatography of curcumol intestinal perfusion
2.7 大鼠在体肠循环实验
2.7.1 酚红浓度的测定 精密称定酚红25 mg于250 mL量瓶中,用蒸馏水定容,作为储备液备用。依次取母液1、2、3、4、5、6 mL于10 mL量瓶中用蒸馏水定容,分别取上述溶液0.5 mL加0.2 mol·L-1的NaOH 5 mL混匀,得到标准溶液。利用酶标仪在555 nm的波长下测定吸光度(A)。以A对酚红质量浓度(C)进行线性回归,得回归方程A=53.02C+0.0356(R2=0.9994),结果表明酚红在0.0009~0.0054 mg·mL-1与A有较好的线性关系。
2.7.2 方法学考察 精密量取20 mg·mL-1的莪术醇对照品溶液适量,用乙醇稀释成0~0.1 mg·mL-1的系列溶液,以峰面积(A)对质量浓度(C)进行线性回归,得回归方程A=6383.3C+6909.7;供试品中其他成分对目标峰没有干扰,见图 4;6份样品测得重复性RSD为1.3%,表明方法重复性良好。
2.7.3 大鼠在体肠循环 配制K-R肠循环液:称取NaCl 7.8 g、KCl 0.35 g、CaCl21.37 g、NaHCO31.37 g、NaH2PO30.32 g、MgCl220.02 g、葡萄糖1.4 g,加水定容至1000 mL。K-R酚红试剂:精密称取酚红20 mg,用K-R肠循环液定容至1000 mL。供试液:精密称取适量莪术醇原料药和莪术醇片剂,用K-R酚红试剂溶解,配制成含莪术醇20 mg·mL-1的供试液。
大鼠在体肠循环实验准备工作:将健康的SD雄性大鼠禁食12 h,可自由饮水;将配制好的K-R酚红试液、供试液和生理盐水放置于37℃的恒温水浴锅内备用;矫正流动泵流速,使其达到2.5 mL·min-1或5 mL·min-1。取实验用SD大鼠称重,以4 mL·kg-1的剂量腹腔注射10%的水合氯醛,麻醉后固定于手术台板上,腹部剃毛,沿腹中线切开约3 cm的切口。找到十二指肠上端和回肠下端,两端各开一个小口,用准备好的生理盐水冲洗肠道内异物。将橡胶管插入肠道两端并连接流动泵和K-R酚红试液形成闭合回路,开启流动泵,以5 mL·min-1的流速平衡10 min。将K-R试液换成100 mL的供试液,以5 mL·min-1的流速循环5 min,接着取样2 mL,记为0 h,并补充同体积等温度的K-R酚红试液,此后每15 min取样2 mL并补充同体积等温度的K-R酚红试液,循环2 h,处死大鼠。利用酶标仪和HPLC检测样品中酚红和莪术醇的含量,以剩余药量的对数对相应时间作图,由直线的斜率求出吸收速率常数(Ka),并计算吸收半衰期(t1/2)和表观吸收系数(Papp),结果见表3。与莪术醇原料药相比,莪术醇片剂的Ka值和Papp值高于莪术醇原料药,t1/2值低于莪术醇原料药,采用SPSS 26统计软件,对莪术醇片剂及原料药在小肠的吸收速率常数Ka进行配对样本t检验分析,P<0.05表示差异有统计学意义,说明莪术醇成片后在大鼠小肠内的吸收速率得到改善。

表3 莪术醇原料药和片剂的大鼠在体肠循环比较(n=3)Tab 3 In situ circulation between curcumol raw material and its tablets in vivo (n=3)
3 讨论
本实验将单体莪术醇制备成片剂,通过单因素考察初步优化处方辅料种类以及主药和辅料用量,并以片剂性能、体外累计溶出度为考察指标,评价不同处方的差异。最终得到主药莪术醇2 g、黏合剂羟丙甲纤维素0.225 g、崩解剂玉米淀粉1.5 g、润滑剂硬脂酸镁0.225 g、填充剂一水合乳糖11.05 g为最佳处方,莪术醇片质量暂定为每片300 mg,制得莪术醇片50片。玉米淀粉作为经典的崩解剂,适用于溶解性低的药物制备成片剂[14],低溶解性药物在遇水崩解过程中不会产生浓度差,可使玉米淀粉迅速吸水膨胀发生崩解,由于生产中已经确定崩解剂玉米淀粉的最佳含量为10%[15],因此本实验中固定了崩解剂玉米淀粉的用量,并在筛选过程中随时调整填充剂一水合乳糖的用量以保证处方总量不变。关于体外累计溶出度的考察,溶出介质的选择十分关键,直接影响药物溶出。实验所用的4种溶出介质分别模拟人体内的胃液和肠液,且人体内的胃肠液中存在大量相关蛋白质,为天然的表面活性剂[16],所以我们向4种溶出介质中加入表面活性剂SDS以达到模拟人体内环境的目的[17]。莪术醇微溶于水,为亲脂性化合物,但当pH降低时,溶解度呈现增大的趋势[18],所以在处方筛选时,测定体外累计溶出度时选用0.2 mg·mL-1SDS的水溶液作为溶出介质,以此评价莪术醇片剂的体外溶出百分率。
动物实验部分采用大鼠在体肠循环法评价莪术醇原料药和莪术醇片剂在肠道中的吸收情况。在该实验中,由于肠道吸收会对溶液体积产生影响,因此用酚红作为参照对溶液体积进行矫正,并加入Ca2+以减少肠道对酚红的吸收[19]。结果显示莪术醇片剂在大鼠体内吸收更快,这可能与辅料的影响有关。该方法保证了体内各个器官和系统的完整性,尽可能地模拟了口服药物后胃肠道的生物环境,可为莪术醇片剂进一步的临床试验提供参考。
本实验证明莪术醇片剂质量符合规定标准,具有可行性和实用性。这不仅扩大了莪术醇的应用范围,而且提供了莪术醇相关研究的部分数据支撑,为莪术醇的应用和开发提供新途径和新思路。

