基于细胞水平评价白及多糖对黑色素生成的抑制作用
蒋勇炫,何毅帆,李征,韩盈盈,刘路阳,李晶洁
(1.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563000;2.遵义医科大学 药学院,贵州 遵义 563000;3.遵义医科大学 口腔疾病研究重点实验室,贵州 遵义 563000;4. 贵州易口白科技有限公司,贵州 贵阳 550081)
白及Bletillastriata(Thunb.)Reiehb.f.为兰科多年生草本植物,又称“白芨”,主要分布于贵州、四川、湖南等地,干燥块茎为其用药部位[1]。现代药理研究表明,白及具有抗肿瘤、抗氧化、抗菌和促进伤口愈合等作用[2]。但据中医古籍记载白及可治面黑、皯疱及祛斑,古人也常用块茎研成粉末外敷来达到美容效果。迄今为止,已知白及有效成分中包括联苄类[3-4]、菲类[5]、多糖[6]及黄酮类[7]等化合物,主要有效成分为白及多糖(Betillastriatapolysaccharide,BSP)。黑色素的合成涉及一系列复杂的酶促和化学催化反应,主要与酪氨酸酶(tyrosinase, TYR)、酪氨酸酶相关蛋白1(tyrosinase-related protein 1, TRP-1)和酪氨酸酶相关蛋白2(tyrosinase-related protein 2, TRP-2)的催化作用密切相关。长时间的紫外线照射也会促进黑素细胞增殖、打破氧化还原稳态,使得角质形成细胞中自由基滞留而诱导黑色素生成增加[8],因此通过调控酪氨酸酶活性和清除自由基可减少黑色素的生成。根据刘佳琪等[9]研究表明,白及多糖可能通过抑制TYR的活性和蛋白表达及小眼畸形相关转录因子(microphthalmia-associated transcription factor, MITF)的蛋白表达,起到抑制黑色素生成的作用,对于TRP-1、TRP-2两种催化酶尚缺乏深入研究。本文着眼于研究白及多糖对黑色素生成的抑制作用及相关机制,并对其抗氧化性能进行检测,以期为白及相关产品的开发利用提供理论依据。
1 材料与方法
1.1 材料 小鼠B16-F10黑色素瘤细胞购自上海盖宁生物科技有限公司;白及多糖购自成都植标化纯生物技术有限公司;左旋多巴(L-Dopa)购自北京索莱宝科技有限公司;α-促黑素细胞激素(α-MSH)购自美国MCE公司;熊果苷(Artubin)、维生素C(VC)均购自上海麦克林生化科技有限公司;酪氨酸酶相关蛋白1、2(TRP-1, TRP-2)一抗均购自艾博抗(上海)贸易有限公司;GAPDH一抗购自美国SANTA公司;CCK-8法细胞增殖毒性试剂盒购自东仁化学科技(上海)有限公司;DPPH自由基清除能力试剂盒、抑制与产生超氧阴离子自由基测定试剂盒、羟自由基测定试剂盒均购自南京建成生物工程研究所。
1.2 方法
1.2.1 细胞培养及分组 小鼠黑色素瘤细胞B16-F10在含10%胎牛血清的RPMI-1640培养基中,于37 ℃、5.0% CO2的培养箱中培养,待细胞生长至80%~90%时用0.25%胰酶消化铺板,用于后续实验。
细胞活性和黑色素含量测定实验分组:将B16-F10细胞分为对照组(Control组)、不同浓度白及多糖组(0.1、0.2、0.5、1.0 mg/mL白及多糖)。酪氨酸酶活性测定实验和Western blot实验分组:将B16-F10细胞分为对照组、模型组(α-MSH组)、阳性药物组(Artubin组)和白及多糖低、中、高剂量组(BSP-L、M、H组,0.1、0.5、1.0 mg/mL)。白及多糖抗氧化性检测实验分组:0.1、0.2、0.5、1.0 mg/mL白及多糖组,且以同浓度VC作为阳性对照。
1.2.2 CCK-8法检测细胞活性 将B16-F10细胞接种于96孔板,24 h后吸去培养基,各组加入100 μL含受试药物(0.1、0.2、0.5、1.0 mg/mL白及多糖)的培养基,对照组只加培养基。培养24、48、72 h后,每孔加入10 μL CCK-8试剂和90 μL培养基,放入培养箱内继续培养1.5 h,450 nm测定吸光度值。
1.2.3 黑色素含量测定 采用NaOH裂解法检测B16-F10细胞中黑色素含量。将B16-F10细胞接种于6孔板,培养24 h后,每孔加入2 mL含受试药物(0.1、0.2、0.5、1.0 mg/mL白及多糖)的培养基,设置6个复孔。24 h后用PBS溶液洗3次,0.25%胰酶消化,10 000 r/min离心10 min,收集细胞,弃掉上清液,加入1 mL 1 mol/L NaOH溶液,80 ℃水浴10 min,405 nm测定吸光度值。
1.2.4 酪氨酸酶活性测定 参考甘育鸿[10]的方法测定B16-F10细胞TYR活性。将B16-F10细胞接种于6孔板,除对照组外均加入含有2 μg/mL α-MSH的培养基预处理,之后给药组加入含有不同浓度的白及多糖或熊果苷的培养基,对照组只加培养基,设置3个复孔。培养24 h后,弃掉培养基,用PBS溶液洗3次,每孔加入100 μL含有1% Triton X-100的PBS溶液,-20 ℃冰箱裂解25 min,收集细胞。在4 ℃条件下,12 000 r/min离心10 min,分别取上清液30 μL和500 μg/mL L-Dopa溶液100 μL 加入96孔板中,37 ℃孵育30 min,450 nm测定吸光度值,以1.0 mg/mL熊果苷作为阳性对照。酪氨酸酶活性(%)=实验组A450/对照组A450×100%。
1.2.5 黑色素形成相关蛋白表达检测 采用蛋白免疫印迹法(Western blot)检测B16-F10细胞中TRP-1和TRP-2的蛋白表达量。将B16-F10细胞接种于6 cm培养皿,除对照组外,其余组分别加入含2 μg/mL α-MSH的培养基,之后给药组分别加入含不同浓度白及多糖的培养基,阳性药组加入含1.0 mg/mL熊果苷的培养基。24 h后裂解细胞,在4 ℃条件下,12 000 r/min离心10 min,收集上清液。BCA法测定蛋白浓度,变性,上样,用SDS-丙烯酰胺凝胶电泳,转移至PVDF膜,快速封闭液封闭20 min后,4 ℃摇床孵育16 h(TRP-1、TRP-2和GAPDH)。1×TBST洗膜10 min×3次,4 ℃摇床孵育二抗1 h,再用1×TBST洗膜10 min×3次,曝光、显影并保存条带结果,进行条带灰度值分析。
1.2.6 DPPH自由基清除活性 按照DPPH自由基清除能力试剂盒说明书进行试剂配制和操作。DPPH自由基清除率(%)=(1-A测定-A对照)/A空白)×100%,以同浓度VC作为阳性对照,做相同处理并计算结果。
1.2.7 抗超氧阴离子活力与抑制羟自由基能力 将B16-F10细胞接种于6 cm培养皿,分别加入含白及多糖和VC的培养基。24 h后裂解细胞,在4 ℃条件下,12 000 r/min离心10 min,蛋白定量,然后分别按照抑制与产生超氧阴离子自由基测定试剂盒、羟自由基测定试剂盒说明书进行试剂配制和操作,并计算结果。抗超氧阴离子活力(U/gprot)=(A对照-A测定)/(A对照-A标准)×标准品浓度×1000 mL/待测样本蛋白浓度;抑制羟自由基能力(U/mgprot)=(A对照-A测定)/(A标准-A空白)×标准品浓度/(待测样本蛋白浓度×取样量)。

2 结果
2.1 白及多糖对B16-F10细胞活性的影响 CCK-8法检测结果显示,干预B16-F10细胞24、48、72 h后,不同浓度白及多糖组(0.1~1.0 mg/mL)与Control组间的细胞活性差异无统计学意义,说明0.1~1.0 mg/mL浓度内白及多糖不影响B16-F10细胞活性(图1)。

图1 不同浓度白及多糖对B16-F10细胞活性的影响(n=6)。
2.2 白及多糖对B16-F10细胞中黑色素含量的影响 黑色素含量测定结果显示:0.1、0.2、0.5、1.0 mg/mL白及多糖干预B16-F10细胞24 h后,0.5和1.0 mg/mL的白及多糖明显抑制B16-F10细胞黑色素生成(P<0.01,图2)。

**:与Control组相比,P <0.01;n=6。图2 白及多糖对B16-F10细胞中黑色素含量的影响
2.3 白及多糖对B16-F10细胞中酪氨酸酶活性的影响 酪氨酸酶活性测定结果显示:与Control组相比,α-MSH组TYR的活性明显升高(P<0.001),表明模型成功;而与α-MSH组比较,Artubin组和BSP-H组TYR的活性明显降低(P<0.001),表明白及多糖能有效抑制α-MSH诱导后B16-F10细胞中TYR活性(图3)。

***: α-MSH组与Control组相比,P<0.001;###: BSP-H组、Artubin组与α-MSH组相比,P<0.001;n=3。图3 白及多糖对B16-F10细胞酪氨酸酶活性的影响
2.4 白及多糖对α-MSH诱导的B16-F10细胞中TRP-1、TRP-2蛋白表达的影响 蛋白表达测定结果显示:与Control组相比,α-MSH组TRP-1和TRP-2表达量明显升高(P<0.01),表明模型成功;与α-MSH组比较,Artubin组、BSP-M组和BSP-H组TRP-1和TRP-2表达量明显降低(P<0.01),表明白及多糖可能通过抑制TRP-1和TRP-2的蛋白表达,起到抑制黑色素生成的作用(图4)。
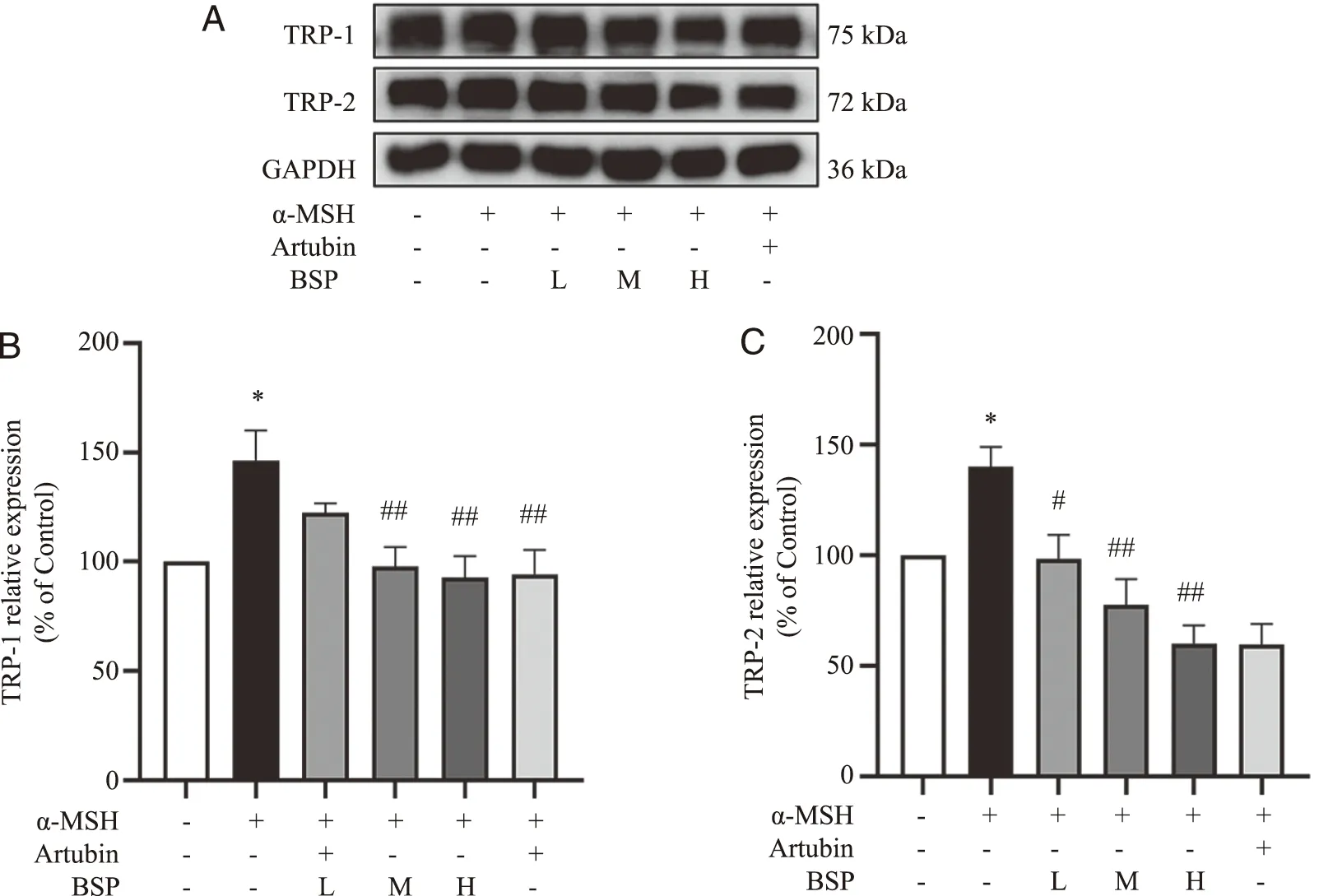
A: TRP-1、TRP-2蛋白免疫印迹图;B:各组TRP-1蛋白相对表达量;C:各组TRP-2蛋白相对表达量。*:与Control组相比,P<0.05;#:与α-MSH组相比,P<0.05;##:与α-MSH组相比,P<0.01;n=6。图4 白及多糖对α-MSH诱导的B16-F10细胞中TRP-1、TRP-2蛋白表达的影响
2.5 白及多糖抗氧化性测定结果
2.5.1 白及多糖对B16-F10细胞中DPPH自由基清除活性的影响 结果显示,白及多糖和VC对DPPH自由基均具有一定的清除作用,并且清除能力随白及多糖浓度的增加而增加。白及多糖对DPPH自由基清除率分别为18.85、27.10、47.92、60.65(%);VC对DPPH自由基清除率分别为41.77、63.09、97.34、98.14(%),表明白及多糖具有较好的DPPH自由基清除能力(P<0.001,图5)。

***: BSP组与VC组相比,P<0.001;n=3。图5 白及多糖对B16-F10细胞中DPPH自由基清除活性的影响
2.5.2 白及多糖对B16-F10细胞中超氧阴离子活力的影响 结果显示,白及多糖和VC均具有一定的抗超氧阴离子活力,呈现出浓度依赖性。白及多糖抗超氧阴离子活力为20.94、22.41、30.68、38.86(U/gprot);VC抗超氧阴离子活力为42.05、47.49、61.03、73.61(U/gprot),表明白及多糖具有较好的抗超氧阴离子活力(P<0.001,图6)。

***: BSP组与VC组相比,P<0.001;n=3。图6 白及多糖对B16-F10细胞中超氧阴离子活力的影响
2.5.3 白及多糖对B16-F10细胞中羟自由基抑制能力的影响 结果显示,白及多糖和VC均具有一定的羟自由基抑制能力,随白及多糖浓度的增加而增加。白及多糖抑制羟自由基的能力分别为7.39、8.07、18.84、34.37(U/mgprot);VC抑制羟自由基的能力分别为14.35、17.51、54.62、85.87(U/mgprot),表明白及多糖具有较好的抑制羟自由基的能力(P<0.01或P<0.001,图7)。
3 讨论
在美白领域研究中,通过抑制酪氨酸酶活性和减少氧自由基的堆积来降低或阻断皮肤黑色素生成,已是国内外公认的有效途径。黑色素的正常合成、体内氧化与抗氧化系统的动态平衡对于机体抵御外界紫外线辐射,防止大量氧自由基堆积导致的生理损伤有着不可或缺的重要性,过多过少的黑色素或氧自由基都会影响皮肤正常的生理功能。
皮肤是否白皙取决于表皮层中黑色素的生成及沉积,而TYR是黑色素生成过程中最关键的限速酶,调控酪氨酸羟化为多巴后参与真黑素合成的速率。此过程中TRP-2催化5,6-二羟基吲哚(5,6-dihydroxyindole,DHI)转变为5,6-二羟基吲哚羧酸(5,6-dihydroxyindole-2-carboxylic acid,DHICA),TRP-1促进两者氧化聚合形成真黑素[11-13]。另外,紫外线对人体角质形成细胞的长时间照射,会诱导细胞内大量氧自由基产生,迁移至黑素细胞中打破其原有氧化还原稳态,刺激TRP-1和TRP-2的表达,进而导致黑色素生成增多,抑制TYR的活性及TRP-1、TRP-2的表达水平即可有效抑制黑色素生成。α-MSH为内源性神经肽,能与黑素细胞膜上的受体(MC1-R)结合,激活腺苷酸环化酶(AC),引起细胞信号应答,将ATP转化为环磷酸腺苷(c-AMP),使c-AMP水平上升,导致TYR活性增强,最终黑色素生成增加[14]。本研究基于以上文献结果,构建α-MSH诱导模型,选用小鼠黑色素瘤细胞B16-F10,研究其对该细胞黑色素生成的作用。结果表明,白及多糖对黑色素生成有较好的抑制作用,可能通过抑制TYR活性和TRP-1、TRP-2的蛋白表达,起到抑制黑色素生成的作用。
此外,以往研究发现白及多糖具有良好的抗氧化作用。蔡锦源等[15]研究表明,实验范围内超声-微波协同提取法提取的白及多糖对DPPH自由基和羟自由基具有明显清除作用,分别为74.21%和92.82%,而氧自由基在黑色素生成过程中也起到一定的作用,提示白及多糖也可能通过清除氧自由基来减少黑色素的生成。
综上,白及多糖通过降低细胞内黑色素含量,抑制TYR活性和TRP-1、TRP-2的蛋白表达以及抗氧化来起到抑制黑色素生成的作用。

