重组人血管内皮抑制素注射液持续静脉泵注联合同步放化疗治疗中晚期肺鳞癌的疗效
王锡林,姜妍,曲震
作者单位: 264000 山东省烟台市,中国人民解放军第970医院全军肿瘤治疗中心
肺癌是我国目前发病率和病死率较高的恶性肿瘤,其中肺鳞癌占肺癌总数的23%左右[1]。肺鳞癌患者确诊时大多已为中晚期,无法手术,治疗缺乏有效的基因靶向药物,常用的治疗方法是放疗、化疗,疗效较差。目前抗血管药物联合化疗治疗非小细胞肺癌已成为共识。研究显示,贝伐珠单抗联合含铂双药化疗一线治疗晚期非鳞非小细胞肺癌,与单纯含铂双药化疗治疗相比,明显延长了中位无进展生存期和中位总生存期[2]。重组人血管内皮抑制素为多靶点的一种抗血管药物,可抑制肿瘤新生血管形成,使肿瘤血管正常化,诱导肿瘤细胞死亡[3]。研究显示,重组人血管内皮抑制素注射液联合同步放化疗可明显提高包括肺鳞癌在内的中晚期非小细胞肺癌的临床疗效,且无咯血等严重的并发症[4-5]。本研究观察重组人血管内皮抑制素注射液持续静脉泵注联合同步放化疗治疗中晚期肺鳞癌的临床疗效。现报道如下。
1 资料与方法
1.1 临床资料 选取2015年1月—2020年12月中国人民解放军第970医院收治住院的中晚期肺鳞癌患者50例,按照随机数字表法分为联合组和对照组,每组25例。2组患者性别、年龄及肺癌TNM分期比较差异均无统计学意义(P>0.05),具有可比性,见表1。患者或家属均签署知情同意书,本研究经医院伦理委员会批准。
表1 对照组与联合组患者临床资料比较 [例
1.2 选择标准 纳入标准:(1)年龄18~75岁;(2)经支气管镜病理活检或痰脱落细胞学、CT下肺穿刺细胞学检查明显诊断的中晚期肺鳞癌初治患者;(3)卡氏(KPS)评分≥70分;(4)血常规、肝肾功能、凝血功能、心电图正常;(5)至少有1条可精确测量径线的病灶,螺旋CT测量≥1.0 cm;(6)预计生存期>3个月。排除标准:(1)有活动性感染者;(2)有慢性肺间质病变者;(3)肝、肾、心、造血系统严重疾病者;(4)过敏性体质或有蛋白类生物制品过敏史者;(5)处于哺乳期或妊娠期的女性;(6)精神疾病或依从性差,不能配合和叙述治疗反应者。
1.3 治疗方法 对照组患者仅采用同步放化疗:应用真空负压体膜辅助患者定位,在CT下放疗增强定位,扫描范围上至胸廓入口,下至后肋膈角底。后在工作站进行靶区勾画,包括肺部原发灶和纵隔转移淋巴结范围,用6MV的X线行影像引导放射治疗(IGRT)(瑞典医科达公司,型号SYNEGR),单次剂量1.8~2.0 Gy,连续放疗5 d,休息2 d,治疗6~8周。放疗同时给予注射用酒石酸长春瑞滨(国药一心制药有限公司生产)25 mg/m2静脉滴注,第1天、第8天;顺铂注射液(江苏豪森药业集团有限公司生产)20 mg/m2静脉滴注,第1~3天。3周为1个周期,化疗2个周期。放疗结束3周后继续按原方案给予全身化疗4个周期。放化疗期间常规给予患者止吐、口服升白细胞药物等治疗,如白细胞减少则给予皮下注射重组人粒细胞集落刺激因子等治疗。联合组患者在对照组治疗的基础上于每次化疗前4 d给予重组人血管内皮抑制素注射液(山东先声生物制药有限公司生产)15 mg·m-2·d-1持续静脉泵注,持续治疗7 d。
1.4 观察指标与方法
1.4.1 近期疗效:2组全部治疗结束后复查胸部增强CT并与放疗前增强定位CT对比,依据RECIST1.1价标准评价疗效[6]。
1.4.2 生存质量改善率:以KPS评分评价患者的生存质量,与治疗前相比,KPS评分降低≥10分为下降,KPS评分提高≥10分判断为提高,KPS评分下降或增高不足10分为稳定。生存质量改善率=提高例数/总例数×100%。
1.4.3 不良反应:按CTCAE-4.0版标准进行评估,患者在6个周期的化疗前后复查血常规、肝肾功能、电解质、心肌酶、心电图。每2个周期复查心脏彩超;放疗期间5~7 d复查1次血常规,必要时随时复查血常规。
1.5 疗效评定标准 完全缓解(CR):患者所有肿瘤病灶完全消失,且超过4周未发现新病灶;部分缓解(PR):患者基线病灶的最大径之和至少减少30%,且超过4周;疾病稳定(SD):患者基线病灶最大径之和减少,但未达到30%,基线病灶最大径之和有增加,但未达到20%;疾病进展(PD):患者基线病灶最大径之和至少增加20%或出现新的病灶。客观缓解率(ORR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。

2 结 果
2.1 近期疗效比较 联合组患者ORR为60.00%,高于对照组的32.00%(P<0.05);联合组与对照组患者DCR比较差异无统计学意义(80.00% vs. 64.00%,χ2=1.587,P=0.208),见表2。
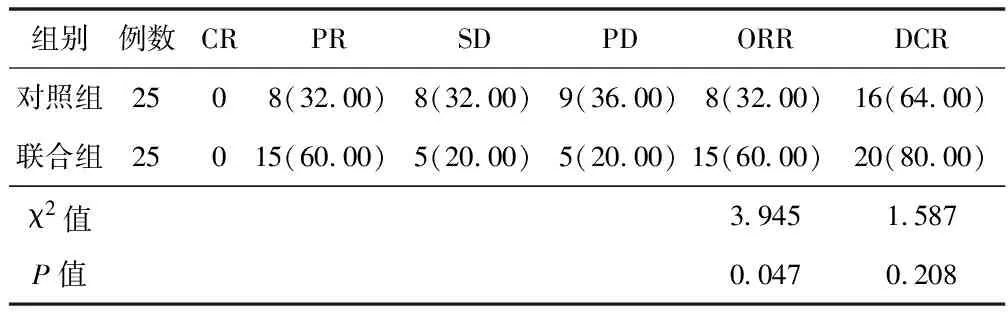
表2 对照组与联合组患者临床疗效比较 [例(%)]
2.2 生存质量改善率比较 联合组患者生存质量改善率为76.00%,高于对照组的48.00%(χ2=4.160,P=0.041),见表3。

表3 对照组与联合组患者生存质量改善比较 [例(%)]
2.3 不良反应比较 2组患者各项不良反应发生率比较差异无统计学意义(P>0.05),见表4、表5。不良反应主要为血液系统毒性、放射性食管炎、急性放射性肺炎,Ⅲ~Ⅳ度不良反应主要为白细胞减少和胃肠道反应。
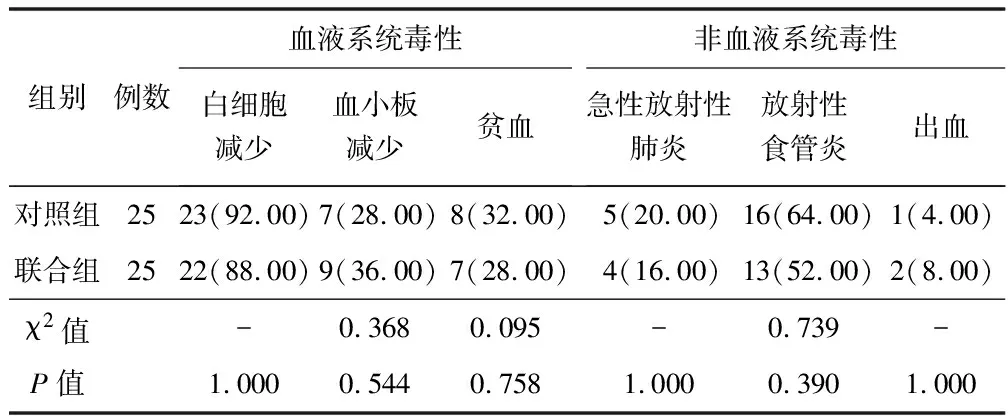
表4 对照组与联合组患者不良反应比较 [例(%)]
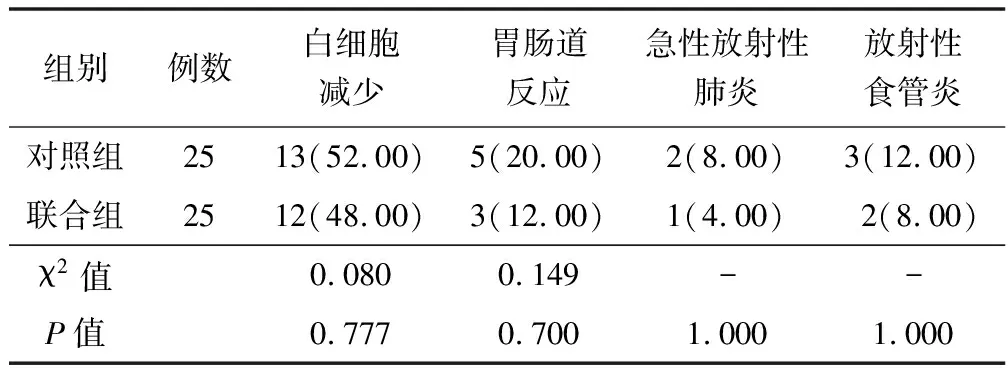
表5 对照组与联合组患者Ⅲ~Ⅳ度不良反应比较 [例(%)]
3 讨 论
近年来,随着环境污染加重和人们生活方式改变,肺鳞癌发病率越来越高,确诊时大多数已为中晚期,一般采用同步放化疗方案治疗,常出现较严重的放射性肺炎和放射性损伤等不良反应,患者治疗效果和生存质量较差[7]。临床一直寻找更可靠、安全的治疗方法,目前提高放疗技术精度和抗血管新型药物与放、化疗联合应用已逐渐应用于临床。
研究显示,IGRT是一种四维放疗技术,与三维适形和调强放疗相比,在三维的基础上增加了时序概念,治疗前、治疗过程中通过影像引导,减少了摆位或器官移动造成的肿瘤位置变化后带来的放疗误差,减少了放射性肺损伤等不良反应[8]。放射性肺损伤发生率和严重程度与放疗同步化疗的药物有关系,研究提示,吉西他滨、紫杉醇类化疗药物联合同步放疗时放射性肺炎发生率和严重程度高于长春瑞滨[9]。因此,本研究采用长春瑞滨方案联合IGRT同步放化疗,尽量减少放射性肺炎等不良反应,结果显示,联合组的急性放射性肺炎发生率为16.00%,低于HELPER研究中的22.4%[10],考虑与本研究所用的IGRT四维放射技术、放射总剂量略低和同步化疗药物有关。
重组人血管内皮抑制素是我国科学家在内皮抑素的基础上研发的具有完全自主知识产权的新型血管内皮抑制素,通过在内皮抑素的母体结构的N端添加9个氨基酸序列,明显延长了半衰期,提高了生物活性和稳定性[11]。重组人血管内皮抑制素是多靶点血管内皮抑制素,主要通过阻断血管内皮生长因子(VEGF)诱导血管内皮生长因子受体酪氨酸磷酸化,下调VEGF及其受体表达来发挥抗血管生成作用,还可通过抑制VEGF-C信号通路来发挥抗淋巴管生成的作用。重组人血管内皮抑制素还对其他多个重要靶点如低氧诱导因子-1α、基质金属蛋白酶、碱性成纤维细胞生长因子、整合素αvβ3等有明确的抑制作用。因此,重组人血管内皮抑制素可降低肿瘤组织和细胞中的VEGF、缺氧诱导因子等多种因子表达,诱导肿瘤细胞凋亡。研究显示,重组人血管内皮抑制素不仅与化疗有协同作用,与放疗联合,也可起到增敏作用[12-13]。研究发现,重组人血管内皮抑制素具有使肿瘤内血管在一段时间内正常化作用,即血管正常化时间窗,在这个时间窗内肿瘤的乏氧环境得到改善,化疗药物更易进入肿瘤组织,放、化疗的敏感性较高,通过大量动物实验和临床研究,发现重组人血管内皮抑制素的血管正常化时间窗一般为开始应用后4~7 d[14-16]。因此本研究静脉滴注重组人血管内皮抑制素注射液4 d后才开始化疗,以便最大程度发挥重组人血管内皮抑制素注射液的抗血管作用,提高化疗效果。重组人血管内皮抑制素注射液的常规用法是每天7.5 mg/m2静脉滴注3~4 h,持续2周,这在一定程度上降低了患者的依从性,而且患者血液中的重组人血管内皮抑制素浓度不稳定,引起不良反应较多。研究发现,24 h持续泵入重组人血管内皮抑制素注射液15 mg·m-2·d-1,连续1周,血液中重组人血管内皮抑制素浓度较高且持续稳定,可增加诱导肿瘤细胞凋亡,不会增加药物不良反应,具有更好的耐受性[17]。
本研究结果显示,联合组患者ORR高于对照组;联合组与对照组患者DCR比较差异无统计学意义;联合组患者生存质量改善率高于对照组,考虑可能与本研究各组病例数较少有关。2组患者各不良反应发生率比较差异无统计学意义,本研究中不良反应主要为血液系统毒性、放射性食管炎、急性放射性肺炎,Ⅲ~Ⅳ度不良反应主要为白细胞减少和胃肠道反应,考虑为放、化疗联合所致。
综上所述,重组人血管内皮抑制素注射液持续静脉泵注联合同步放化疗治疗中晚期肺鳞癌近期临床疗效显著,可提高客观有效率,改善生存质量,且未明显增加不良反应,值得临床进一步研究。
利益冲突:所有作者声明无利益冲突。

