去甲肾上腺素联合乌司他丁对脓毒症患者血清内皮损伤指标及炎性因子水平的影响
方德祥 黄珊娇 杨淑贞
摘要:目的探讨去甲肾上腺素(NE)联合乌司他丁对脓毒症患者血清内皮损伤指标及炎性因子水平的影响。方法择取2020年4月-2022年4月于莆田学院附属医院就诊的脓毒症患者79例,用随机数字法分成治疗组(40例)、对照组(39例)。对照组予NE治疗,在对照组治疗基础上,治疗组加用乌司他丁治疗,治疗1周后对比两组血清内皮损伤指标[内皮特异性分子-1(ESM-1)、内皮素-1(ET-1)、血管性血友病因子(vWF)]、炎性因子水平[白介素-6(IL-6)、IL-10、肿瘤坏死因子α(TNF-α)]、不良反應。结果治疗1周,两组血清ESM-1、ET-1、vWF水平较治疗前降低,治疗组的血清ESM-1、ET-1、vWF水平较对照组低,差异有统计学意义(p<0.05)。治疗1周,两组血清IL-6、TNF-α水平较治疗前降低,治疗组血清IL-6、TNF-α水平较对照组降低,两组血清IL-10水平较治疗前升高,治疗组血清IL-10水平较治疗前升高,差异有统计学意义(p<0.05)。两组不良反应总发生率比较,差异无统计学意义(p>0.05)。结论NE联合乌司他丁能减轻脓毒症患者内皮功能损伤,降低炎性反应,且不增加不良反应。
关键词:脓毒症,去甲肾上腺素,乌司他丁,内皮损伤因子,炎性因子
中图分类号:TP393
文献标识码:A
文章编号:1674-9545(2023)03-0106-(04)
DOI:10.19717/j.cnki.jjun.2023.03.020
脓毒症为临床常见危重症疾病,据相关文献显示,随人们环境、饮食等不断变化,脓毒症患病率以1.5~8%的速率增加,且已成为重症病房内非心脏死亡的重要原因,严重威胁人们生命安全[1]。目前,针对该类患者临床虽能通过抗感染、营养支持等治疗控制患者病情,但仍有部分患者炎性反应控制不佳,致肝肾、心等器官功能障碍,严重者甚至出现器官衰竭[2]。因此,如何有效调节炎性反应、保护器官对患者预后尤为重要。去甲肾上腺素(nepinephrine NE)为常用血管活性药物,其能促使外周血管收缩,增加回心血量,保证重要脏器血供[3];乌司他丁为丝氨酸蛋白酶拮抗剂,具有抗炎、改善免疫功能异常等作用,且有研究证实,其能改善脓毒症大鼠心肌损害,并发挥肺脏、肠道屏障保护作用[4]。鉴于此,该研究将分析NE联合乌司他丁对脓毒症患者血清中内皮损伤各指标及炎性因子水平的影响。研究如下。
1临床资料与方法
1.1一般资料
择取2020年4月-2022年4月于莆田学院附属医院就诊的脓毒症患者79例,经医学伦理委员会通过,用随机数字法分成治疗组(40例)和对照组(39例)。治疗组年龄46~75岁,平均(56.38±4.17)岁;男28例,女12例;体重指数20.65~27.58kg/m2,平均体重指数(23.25±1.25)kg/m2;原发疾病类型:败血症19例,急性胰腺炎10例,泌尿系统感染2例,肺部感染9例。对照组年龄46~78岁,平均(56.45±4.23)岁;男26例,女13例;体重指数20.58~27.61kg/m2,平均体重指数(23.31±1.28)kg/m2;原发疾病类型:败血症18例,急性胰腺炎11例,泌尿系统感染3例,肺部感染8例。两组一般资料比较(p>0.05),研究可对比。
1.2入选标准
纳入标准:①符合脓毒症[5]相关诊断;②具备基础听、写能力;③知情研究,并签署相关协议;④入组前30d内无抗感染、激素等治疗史。
排除标准:①患神经、免疫、血液等系统性疾病;②合并恶性肿瘤的患者;③肝肾功能中度以上异常的患者;④合并各类慢性病终末期的患者;⑤合并哺乳/妊娠期的患者。
1.3方法
两组均予吸氧、重症监护、抗感染、营养支持等常规治疗。在常规治疗基础上,对照组患者接受NE(西安利君制药有限责任公司,规格:2mg,国药准字H61021666)治疗,用双通道微量注射泵(浙江史密斯医学仪器有限公司,型号:佳士比F6)经中心静脉泵入NE,首剂量为0.5μg/(kg·min),后依患者血压情况调整药量0.2μg/(kg·min)。治疗1周。
治疗组在常规治疗上予NE联合乌司他丁(广东天普生化医药股份有限公司,规格:2mL:10万/U,国药准字H20040506)治疗,NE用法用量同上,取10万/U乌司他丁与0.9%氯化钠50mL溶液稀释,静脉泵注2h,3次/d。治疗1周。
1.4观察指标
(1)血清内皮损伤指标:治疗前、治疗1周,抽取两组患者晨起空腹肘静脉血5mL,离心处理(3000r/min)10min后,离心半径10cm,取上层清液,置于-20℃冰箱内备用。用酶联免疫吸附法(ELISA)检查患者血清内皮特异性分子-1(ESM-1)、内皮素-1(ET-1)及血管性血友病因子(vWF)水平,ESM-1、vWF试剂盒厂家为上海博湖生物科技有限公司,ET-1试剂盒厂家为合肥莱尔生物科技有限公司。
(2)血清炎性因子水平:治疗前、治疗1周,抽取两组患者晨起空腹肘静脉血3mL,以3000r/min离心10min后,离心半径10cm,取上层清液,用ELISA检测患者的血清白介素-6(IL-6)、IL-10及肿瘤坏死因子α(TNF-α)水平,试剂盒均购自上海酶联生物科技有限公司。
(3)不良反应:比较两组治疗期间的皮疹、恶心、呕吐、腹泻等发生率。
1.5统计学方法
采用SPSS 22.0软件进行数据处理,计量资料采用均数±标准差(x-±s)表示,组间比较采用独立样本t检验,组内比较用配对样本t检验;计数资料用例数和百分比表示,用χ2 检验,p<0.05为差异有统计学意义。
2结果
2.1两组血清内皮损伤指标相比
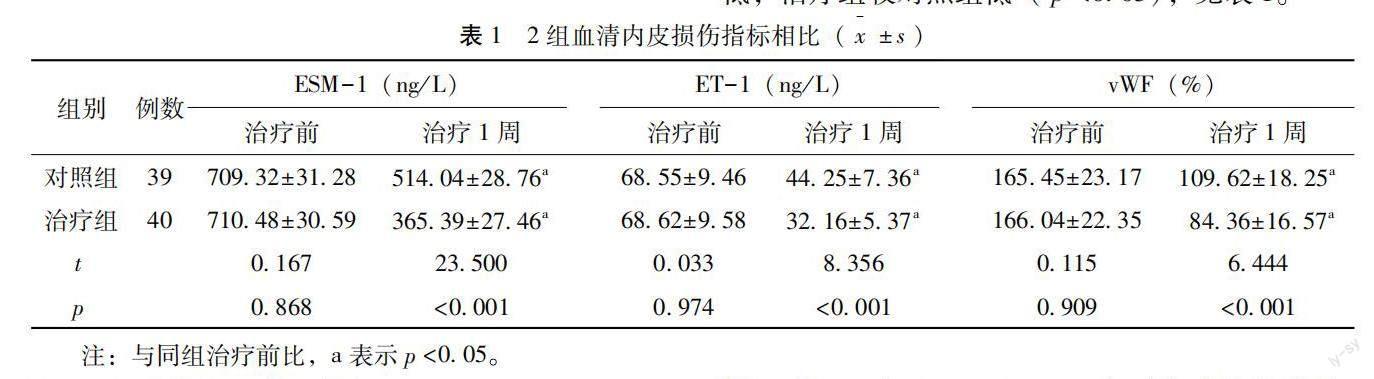
治疗前,两组血清ESM-1、ET-1、vWF水平比较,差异无统计学意义(p>0.05);治疗1周,两组血清ESM-1、ET-1、vWF水平较治疗前降低,治疗组较对照组低(p<0.05),见表1。
2.2两组炎性因子水平相比
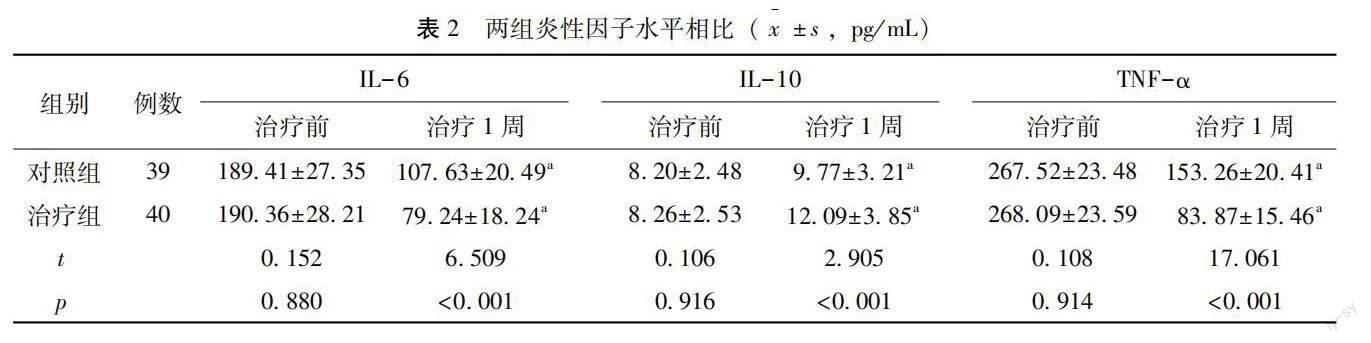
治疗前,两组血清IL-6、IL-10、TNF-α水平比较,差异无统计学意义(p>0.05);治疗1周,两组血清IL-6、TNF-α水平较治疗前降低,治疗组较对照组低,两组血清IL-10水平较治疗前升高,治疗组较治疗前高(p<0.05),见表2。
2.3不良反应
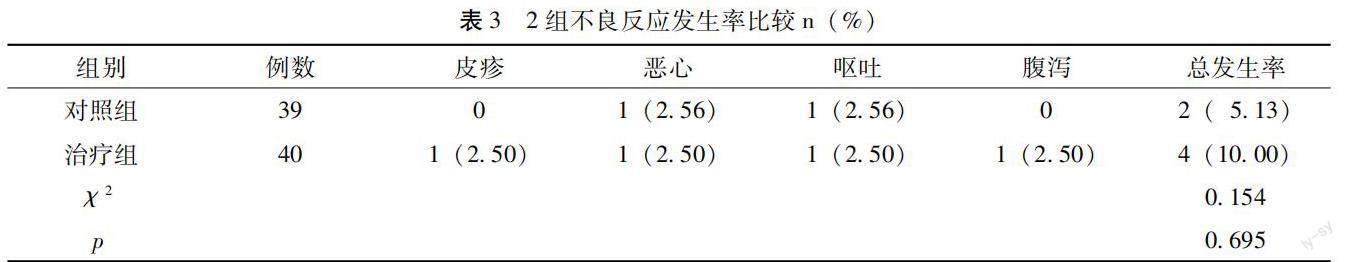
两组不良反应总发生率比较,差异无统计学意义(p>0.05),见表3。
3讨论
脓毒症为感染、严重创伤等引起的器官功能障碍,临床多表现为心慌、发热、气促等症状,有病情凶险、进展迅速等特点,若未及时救治,可进展为脓毒性休克,造成循环障碍,危及患者生命安全[6]。目前,抗感染、吸氧等对症治疗虽能有效改善脓毒症患者的临床症状,降低休克、多器官功能衰竭、死亡等发生风险,但临床实践发现,仍有部分患者病情改善不佳。
炎症反应是脓毒症进展、发生的基础,促炎因子IL-6能刺激中性粒细胞颗粒,释放过量氧自由基,诱发肾脏损害、呼吸衰竭等;TNF-α能通过炎性级联反应释放、激活更多炎症介质,诱发多器官障碍综合征;IL-10作为一种抗炎因子,能拮抗IL-6等促炎因子分泌,对控制脓毒症患者病情有重要作用[7-8]。因此,控制机体炎症反应对疾病治疗尤为重要。研究显示,治疗组治疗1周的IL-6、TNF-α水平较对照组低,IL-10水平较对照组高,说明NE联合乌司他丁能降低脓毒症患者的炎性反应。分析原因在于,NE属α受体激动剂,可结合血管受体,促使α受体兴奋后可增加血管阻力,改善微循环灌注,进而减轻机体炎症反应[9]。乌司他丁作为广谱蛋白酶拮抗剂,其能通过拮抗细胞外蛋白酶活性,阻滞细胞内活性物质分泌及生成,且能有效清除氧自由基、稳定溶解体膜,减轻组织缺氧、缺血所致的组织细胞损害[10];同时其还能通过拮抗IL-6、TNF-α等炎性介质释放,降低炎性物质对器官、组织的损伤,进而保护患者心肝肾等器官免受炎性损伤,达到改善多器官功能的目的[11]。
内皮功能损伤亦与脓毒症病情进展关系密切,内皮细胞为内毒素首要攻击靶点,也是连接炎症反应和凝血功能障碍的中心环节[12-13]。ET-1可以调控心血管功能,维持血管稳态和血管张力,ET-1增多会导致一氧化氮减少,促使血小板聚集,诱发微循环血栓形成[14];ESM-1为内皮功能障碍的标志物之一,水平异常升高预示血管内皮功能损伤的发生[15];vWF为具有粘附功能的糖蛋白,会与血小板膜糖蛋白Ib-IX复合物结合,诱发血小板聚集,参与内皮保护、血栓形成等病理生理过程的调控[16]。研究显示,治疗1周,治疗组ET-1、vWF、ESM-1水平较对照组低,说明NE联合乌司他丁能减轻脓毒症患者内皮功能损伤。分析原因在于,NE能提高内皮钙粘着素表达,降低炎性介质及氧化应激水平,进而减轻内皮细胞损伤[17];同时乌司他丁能通过调控抑炎因子、促炎因子及黏附分子表达水平,调节微血管通透性,进而发挥保护内皮细胞的作用。
此外,该研究还发现,两组不良反应总发生率差异无统计学意义,说明在NE治疗脓毒症基础上加用乌司他丁不会增加不良反应,安全性较好。这是因为乌司他丁静注后其血浆浓度可快速下降,半衰期较短,并能以低分子代谢物形式从尿中排泄,在体内蓄积量极少,不会对机体产生较大的危害。但因研究人员精力有限,未对大样本脓毒症患者进行探究,可能导致不良反应的相关结果存在偏差,未来可增加样本量,对此展开进一步探究,以便为脓毒症患者的临床治疗提供指导。另外因研究时间限制,该研究未对脓毒症患者的远期预后进行探究,未来可延长随访时间,对该类患者的远期预后进行追踪,以便进一步明确NE联合乌司他丁治疗脓毒症患者的效果及安全性。
综上所述,NE联合乌司他丁能减轻脓毒症患者内皮功能损伤,降低炎性反应,不增加不良反应。
参考文献:
[1]江伟,杜斌.中国脓毒症流行病学现状[J].医学研究生学报,2019,32(1):5.
[2]乔增海,尚志博.乌司他丁对重症脓毒症患者血浆PCT、CRP水平的影响及对心肝肾的保护作用[J].河北医药,2018,40(8):1172.
[3]张辉,郭燕.去甲肾上腺素联合艾司洛尔对脓毒症休克患者心肌功能及乳酸清除率的影响[J].实用临床医药杂志,2019,23(17):10.
[4]李祥,杨春波,古丽菲热·塔依尔,等.乌司他丁通过抑制脓毒症大鼠肠道NLRP3炎症小体活化发挥肠道黏膜屏障的保护作用[J].中华危重病急救医学,2021,33(2):192.
[5]中国医师协会急诊医师分会,中国研究型医院学会休克与脓毒症专业委员会.中国脓毒症/脓毒性休克急诊治疗指南(2018)[J].感染、炎症、修复,2019,20(1):3.
[6]中国医疗保健国际交流促进会急诊医学分会,中华医学会急诊医学分会,中国医师协会急诊医师分会,等.中国“脓毒症早期预防与阻断”急诊专家共识[J].中华危重病急救医学,2020,32(5):518.
[7]王婷,韦小碗,杨亮,等.脓毒症患者血清PCT、CRP、IL-6和IL-10水平檢测及临床意义[J].陕西医学杂志,2020,49(11):1510.
[8]孙航,赵菊馨,杨方,等.TNF-α,IL-10及CRP在脓毒症患者中的表达及其临床意义[J].中国实用医刊,2021,48(19):31.
[9]康大伟,于健,夏嘉鼎,等.去甲肾上腺素联合磷酸肌酸钠对脓毒症早期循环衰竭保护及免疫功能影响[J].中国免疫学杂志,2019,35(11):1368.
[10]王立秋,周忠彬,刘树元,等.不同剂量乌司他丁对严重脓毒症和脓毒性休克患者氧化应激及血乳酸的影响[J].中国急救复苏与灾害医学杂志,2017,12(3):229.
[11]杨勇,彭友林,王冉,等.乌司他丁辅助治疗对脓毒症患者炎症细胞亚群及分泌细胞因子的影响[J].现代中西医结合杂志,2019,28(4):427.
[12]胡艳晶,宋景春.脓毒症时内皮细胞功能损伤标志物研究进展[J].临床军医杂志,2020,48(3):355.
[13]莫连芹,汪娟,黄栋,等.脓毒症患儿病情与血管内皮细胞功能障碍的相关性分析[J].中国中西医结合儿科学,2019,11(1):23.
[14]钟昌宝,王兰芳,王必管.C-反应蛋白和血清降钙素原及内毒素水平对革兰阴性菌血流感染致脓毒症患者早期诊断的应用价值[J].河北医药,2018,40(16):2420.
[15]汪晓波,吴建华,倪步烤,等.血清sTREM-1联合ESM-1预测脓毒症相关急性肾损伤患者预后的价值[J].浙江临床医学,2021,23(5):729.
[16]陈艳青,黄潇,孔桂青,等.HMGB1和vWF等细胞因子对脓毒症患者病情严重程度及预后评估的意义[J].中华危重病急救医学,2020,32(8):933.
[17]胡静,龙燕琼,岳阳,等.去甲肾上腺素减轻脂多糖所致内皮细胞损伤[J].中国病理生理杂志,2018,34(4):735.
(责任编辑 胡安娜)

