长链非编码RNA PCAT19对胰腺癌细胞增殖与侵袭的影响及其作用机制
赵银峰,梁云,魏天天,嘉玉成
(湖北医药学院附属随州医院/随州市中心医院 普通外科,湖北 随州 441300)
胰腺癌是高度恶性的消化道肿瘤。在全球,胰腺癌在男性中发病率为5.5/10万,女性为4.0/10万,在癌症相关病死率中排第4位[1]。在我国,胰腺癌发病率列第10位,病死率列第5位[2]。胰腺癌特征是进展迅速、早期转移复发及对放化疗抵抗[3],导致预后不佳,5年总生存率<5%,中位生存时间不足6个月[1]。胰腺癌临床症状缺乏特异性,很多胰腺癌患者诊断时即为晚期而失去手术机会,深入探索胰腺癌进展的分子机制对提高诊治水平具有重要的临床意义。
长链非编码RNA(long non-coding RNA,lncRNA)长度超过200个核苷酸,没有蛋白质编码功能[4]。lncRNA参与不同类型的肿瘤进展,是肿瘤发生、进展和转移的关键调节因子,lncRNA在胰腺癌的发病、诊断、治疗和预后中起着至关重要的作用[5]。lncRNA PCAT19(简称PCAT19)是最新发现的lncRNA分子,长度为693 bp,基因位于9号染色体上。研究显示其在胃癌[6]、喉癌[7]、非小细胞肺癌[8]、肺腺癌[9]、神经胶质瘤[10]中表达上调,且与恶性进展和不良预后密切相关。尽管如此,PCAT19在胰腺癌中的表达、功能及作用机制尚无研究报道。基于笔者前期通过starBase数据库预测PCAT19可与miR-195-5p互补结合,本研究进一步探讨PCAT19在胰腺癌细胞中的表达与功能,及其与miR-195-5p的调控关系。
1 资料与方法
1.1 实验试剂
人胰腺导管上皮细胞系(HPNE)和胰腺癌细胞系(PANC-1、SW1990、HS766T及CFPAC-1)由华中科技大学同济医学院实验室馈赠,10% FBS及DMEM培养基购自Invitrogen公司,LipofectamineTM3000转染试剂盒购自Invitrogen公司,miR-195-5p模拟物(miR-195-5p mimics)、miR-195-5p抑制物、si-PCAT19序列均由上海吉玛生物公司合成,TRIzol试剂购自Invitrogen公司,Western blot试剂盒购自北京碧云天生物公司,TaqMan miRNA逆转录试剂盒购自美国Thermo Fisher Scientific公司,Transwell侵袭小室购自美国BD Biosciences公司,MTT细胞增殖检测试剂盒购自日本Kumamoto公司,β-catenin、c-Myc、cyclin D1及GAPDH一抗购自美国BD公司,二抗购自美国Invitrogen公司。
1.2 细胞培养及分组
所有细胞都在补充有10% FBS和100 U/mL青霉素的DMEM培养基中在37 ℃、含5% CO2环境的培养箱中培养。采用LipofectamineTM3000将PANC-1细胞系分别转染PCAT19沉默序列si-PCAT19(si-PCAT19组)、阴性对照序列(si-NC组)、miR-195-5p抑制序列+si-PCAT19(共转染组),并分成si-PCAT19组、si-NC组及共转染组,待各组细胞系培养至对数期后行后续实验。
1.3 RNA提取和qRT-PCR
使用TRIzol 试剂从细胞系中提取总RNA。用逆转录酶将分离的RNA转录成互补DNA(cDNA)。使用 SYBR Green实时聚合酶链式反应扩增成cDNA产物。使用 SYBR Green RT-PCR检测PCAT19及miR-195-5p的表达。PCAT19的表达以GAPDH为内参,标准化为GAPDH的对照值。miR-195-5p的测定以U6小核为内参,标准化为U6的对照值。miR-195-5p引物序列正向(5'→3'):CGC AGC ACA GAA ATA TTG GC,反向(5'→3'):CTC AAC TGG TGT CGT GGA GTC;U6引物序列正向(5'→3'):CTC GCT TCG GCA GCA CA,反向(5'→3'):AAC GCT TCA CGA ATT TGC GT;PCAT19引物序列正向(5'→3'):CAG AAC AGG ATG GCA GAG,反向(5'→3'):GGA CTA CTT GGA TGG CTA AT;GAPDH引物序列正向(5'→3'):TCT CTG CTC CTC CTG TTC,反向(5'→3'):GTT GAC TCC GAC CTT CAC。
1.4 细胞增殖能力测定
采用MTT实验评估细胞增殖能力。将细胞以5×103个/孔的密度培养在96孔板中,在转染后0、24、48、72 h,将细胞在含有10 µL MTT溶液的DMEM培养基中于37 ℃孵育2 h。使用酶标仪测定每孔在490 nm处的吸光度A490 nm,实验重复3次,并绘制细胞增殖曲线。
1.5 细胞侵袭能力检测
采用Transwell实验评估细胞侵袭能力,将4×104个细胞放入涂有稀释的Matrigel的上室中,然后将500 µL培养基添加到下室。细胞用PBS洗涤2次,用多聚甲醛固定25 min,培养24 h后用0.1%结晶紫染色30 min。然后,在光学显微镜下随机取10个视野拍摄并计数,实验重复3次,取平均值。
1.6 萤光素酶报告基因检测
PCR产物纯化后,酶切产物用限制性内切酶克隆到pmirGLO转染载体。采用LipofectamineTM3000将pmirGLO-WT-PCAT19或Mut-PCAT19与miR-182 mimics或si-NC共转染入胰腺癌细胞系PANC-1。培养48 h后,用PBS洗涤细胞,然后在室温下用被动裂解缓冲液裂解20 min。收集孵育裂解物并转移到96孔板中,并将等分试样添加到板中。立即添加萤光素酶检测试剂Ⅱ后,在Infinite M200读板器系统中测量萤光素酶活性,检测转染后细胞相对的萤光素酶活性。
1.7 Western blot
收集转染后的PANC-1细胞,用蛋白酶抑制剂混合物在冰冷的RIPA 缓冲液中裂解细胞并在冰上孵育30 min。在10%~15% Tris-Glycine Gels中进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,然后将分离的蛋白质转移到PVDF膜上。用含0.05%Tween-20和5%牛奶的Tris 缓冲盐水封闭膜,予一抗孵育,并按标准程序洗涤3次。一抗是兔单克隆抗β-连环素(β-catenin)抗体(1∶200)、兔单克隆抗c-Myc(1∶300)、兔单克隆抗周期素D1(cyclin D1)抗体(1∶300)、兔单克隆抗GAPDH(1∶400)。与HRP偶联的二抗孵育后,用PBS洗涤蛋白条带,加入显影剂后在暗室曝光,计算条带的灰度值和蛋白相对表达量。
1.8 统计学处理
数据表示为平均值±标准差(±s)。通过GraphPad Prism 12.0软件统计数据,并使用t检验或单向方差分析进行统计分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PCAT19与miR-195-5p在胰腺癌细胞及正常胰腺导管上皮细胞中的表达
qRT-PCR示,正常胰腺导管上皮细胞系HPNE中PCAT19表达量为1.25±0.21,胰腺癌细胞系PANC-1、SW1990、HS766T、CFPAC-1中PCAT19表达水平依次为8.75±1.34、8.44±1.27、7.44±1.29、7.06±1.31,各胰腺癌细胞系中PCAT19表达水平均高于HPNE细胞(均P<0.05)(PANC-1细胞中PCAT19增高程度最明显,故后续实验选用PANC-1细胞为研究对象)。HPNE细胞中miR-195-5p表达水平为4.23±0.24,胰腺癌细胞系PANC-1、SW1990、HS766T和CFPAC-1中miR-195-5p的水平依次为1.75±0.13、1.64±0.15、1.44±0.21和1.26±0.24,各胰腺癌细胞系中miR-195-5p明显高于HPNE细胞(均P<0.05)(图1)。

图1 PCAT19与miR-195-5p在胰腺癌细胞及正常胰腺导管上皮细胞中的表达水平Figure 1 The expression levels of PCAT19 and miR-195-5p in pancreatic cancer cells and normal pancreatic ductal epithelial cells
2.2 PCAT19靶点miRNA分析
前期通过生物信息学软件starBase 2.0版检索发现miR-195-5p存在与PCAT19结合位点(图2A)。因此,进一步用萤光素酶报告质粒pGL3.0-PCAT19和miR-195-5p模拟物共转染胰腺癌细胞PANC-1。结果表明,miR-195-5p可降低野生型质粒WT-PCAT19萤光素酶活性(P<0.05),而对突变型质粒Mut-PCAT19萤光素酶活性无明显影响(P>0.05)(图2B)。

图2 PCAT19的靶点预测与验证 A:PCAT19与miR-195-5p存在靶向结合位点;B:萤光素酶实验示miR-195-5p为PCAT19的靶标分子Figure 2 Target prediction and validation of PCAT19 A: PCAT19 has binding sites for miR-195-5p; B: Dual-luciferase experiments demonstrate that miR-195-5p is a target molecule of PCAT19
2.3 PCAT19与miR-195-5p对PANC-1细胞增殖的影响
与si-NC组比较,si-PCAT19组PANC-1细胞系中miR-195-5p表达水平明显升高(P<0.05),而共转染组miR-195-5p表达水平无明显变化(P>0.05)(图3A);MTT结果显示,在转染后24、48、72 h,si-PCAT19组A490 nm值均低于si-NC组(均P<0.05),而共转染组各时间点A490 nm值与si-NC组差异均无统计学意义(均P>0.05)(图3B)。

图3 PCAT19与miR-195-5p对PANC-1细胞增殖的影响 A:各组细胞miR-195-5p的表达比较;B:各组细胞的增殖曲线比较Figure 3 The impact of PCAT19 and miR-195-5p on the proliferation of PANC-1 cells A: Comparison of miR-195-5p expression among groups of cells; B: Comparison of the proliferation curves of cells in each group
2.4 PCAT19与miR-195-5p对PANC-1细胞侵袭能力的影响
Transwell结果显示,si-NC组侵袭细胞数为(180.7±10.4)个,si-PCAT19组侵袭细胞数为(78.7±9.34)个,共转染组侵袭细胞数为(175.3±9.5)个,si-PCAT19组侵袭细胞数明显少于si-NC组和共转染组(均P<0.05),si-NC组和共转染组侵袭细胞数差异无统计学意义(P>0.05)(图4)。

图4 PCAT19与miR-195-5p对PANC-1细胞侵袭能力的影响Figure 4 The influence of PCAT19 and miR-195-5p on the invasion capability of PANC-1 cells
2.5 PCAT19 表达水平对Wnt/β-Catenin信号通路蛋白的影响
鉴于Wnt/β-catenin信号通路在胰腺癌进展中起重要作用,故分析PCAT19/miR-195-5p是否参与Wnt/β-catenin信号通路调控过程。Western blot结果显示,si-PCAT19组中β-catenin、c-Myc和cyclin D1表达水平下调,明显低于si-NC组和共转染组(均P<0.05),si-NC组和共转染组β-catenin、c-Myc和cyclinD1表达水平差异无统计学意义(均P>0.05)(图5)。
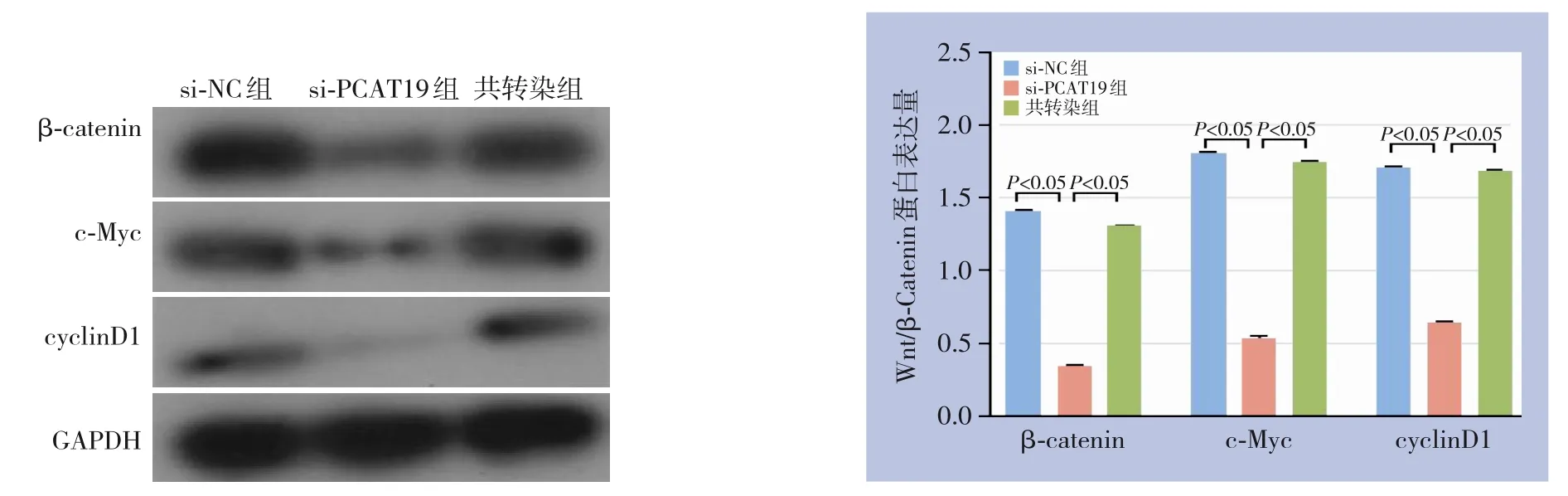
图5 PCAT19与miR-195-5p对Wnt/β-Catenin信号通路蛋白表达的影响Figure 5 The effect of PCAT19 and miR-195-5p on the expression of proteins in the Wnt/β-Catenin signaling pathway
3 讨 论
近年来,越来越多的证据[11-12]表明lncRNA在介导复杂的肿瘤细胞生物学过程中发挥着至关重要的作用,特别是在恶性肿瘤中,这引起了希望揭示其潜在机制的学术界的极大关注。lncRNA在肿瘤生物学过程中扮演着重要的角色,可调控多种肿瘤的增殖[13]、凋亡[14]、迁移及侵袭[15]、自噬[16]、铁死亡[17],并影响着预后[18]。
本研究发现在胰腺癌细胞系中,PCAT19表达水平显著上调,研究结果与文献[13]报道一致。在前列腺癌[19]组织和体外培养的细胞系中均发现PCAT19表达水平较正常组织和细胞系显著上调。同时,在非小细胞肺癌[20]中也发现类似的结果,其体外培养的细胞系中PCAT19表达水平上调。在体外培养的胶质瘤[10]细胞中发现,干扰或敲低PCAT19表达后,胶质瘤细胞增殖、迁移和侵袭能力显著下降。在喉癌[7]中,PCAT19通过调节miR-182/PDK4轴促进细胞增殖、肿瘤发生及代谢平衡。在肺腺癌[9]中,PCAT19可靶向miR-143-3p调控细胞增殖、迁移和侵袭,且是影响肺腺癌预后的独立危险因子。通过干扰RNA技术敲低胰腺癌细胞系中PCAT19表达水平后,发现胰腺癌细胞增殖和侵袭能力受到显著抑制,提示沉默PCAT19表达可能发挥抑癌的功能。双萤光素酶基因报告实验证实PCAT19下游的靶miRNA为miR-195-5p。同时在胰腺癌细胞系中发现与正常胰腺导管上皮细胞系相比,胰腺癌细胞系中miR-195-5p表达水平显著下调,而下调PCAT19表达后,胰腺癌细胞中miR-195-5p表达水平显著增加,提示两者可能存在负向调节关系。
大量的lncRNA可作为miRNA的分子海绵或内源性竞争性RNA而在多种肿瘤中介导肿瘤的发生和进展[21]。lncRNA-NEAT1促进沉默调节蛋白1表达并通过海绵化miR-34a激活Wnt/β-catenin信号通路促进结直肠癌的发生和进展[22]。在胰腺癌[23]中,lncRNA TP73-AS1可通过发挥分子海绵作用竞争性抑制miRNA-128-3p表达,进而通过miRNA-128-3p/GOLM1轴促进胰腺癌的发生和进展。本研究进一步发现下调miR-195-5p表达水平可显著恢复下调PCAT19对胰腺癌细胞增殖和侵袭的抑制作用。上述结果显示PCAT19可能作为miR-195-5p分子海绵而发挥作用。
Wnt/β-catenin 信号通路在胰腺癌发生和进展中发挥重要作用[24]。研究[25]显示在胰腺癌中,Wnt/β-catenin信号通路被激活,从而导致信号通路下游相关蛋白的表达水平增加,促进癌细胞的增殖、迁移和侵袭,促进胰腺癌的发生和进展。最新研究也显示通过开发针对Wnt/β-catenin信号通路的抑制剂在体外可显著抑制胰腺癌细胞增殖和侵袭[26]。目前研究[27]发现,大量的lncRNA可通过调节Wnt/β-catenin信号通路而发挥作用,例如lncRNA H19/miR-194/PFTK1轴即可通过激活Wnt/β-catenin信号通路而促进胰腺癌细胞增殖和侵袭。在膀胱癌中,miR-195-5p可通过调控Wnt/β-catenin信号通路而抑制细胞增殖、迁移和侵袭[28]。在结肠癌中,circ_0038718可通过miR-195-5p/Wnt/β-catenin信号通路促进肿瘤恶性进展[29]。由此笔者推测PCAT19、miR-195-5p可能与Wnt/β-catenin信号通路存在着密切联系,PCAT19可能通过调控Wnt/β-catenin信号通路影响胰腺癌的进展。故本研究进一步通过Western blot实验分析Wnt/β-catenin信号通路是否参与PCAT19/miR-195-5p调节胰腺癌细胞增殖和侵袭,结果显示,单独敲低PCAT19可显著降低Wnt/β-catenin信号通路的关键蛋白表达,包括β-catenin、c-Myc和cyclin D1,同时进行PCAT19敲低和下调miR-195-5p表达后Wnt/β-catenin信号通路的关键蛋白表达水平无显著变化。本研究发现,敲低PCAT19表达水平可抑制Wnt/β-catenin信号通路,而下调miR-195-5p后可部分恢复敲低PCAT19对胰腺癌细胞增殖和侵袭的抑制作用,表明沉默PCAT19表达抑制胰腺癌细胞增殖和侵袭的机制可能与抑制Wnt/β-catenin信号通路有关,提示沉默PCAT19表达可能作为胰腺癌潜在的治疗靶点。
当然,由于本研究是在细胞系中的研究,不可避免存在一定的不足,比如:PCAT19在胰腺癌组织中的表达及功能,在模式动物体内的功能如何,都值得进一步研究。综上,敲低PCAT19表达可能通过上调miR-195-5p抑制胰腺癌细胞增殖和侵袭,机制可能与抑制Wnt/β-catenin信号通路有关,其可能为胰腺癌新的治疗靶点。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:赵银峰参与课题设计及写作;梁云参与细胞增殖实验;魏天天参与细胞侵袭实验;嘉玉成参与课题指导及论文写作修改。

