circZMYM2/miR-29a/PUMA轴对急性胰腺炎腺泡细胞凋亡的影响及作用机制
高明,王琪,孙远松,李贺
(安徽医科大学第二附属医院 急诊外科,安徽 合肥 230601)
急性胰腺炎(acute pancreatitis,AP)是临床上最常见的急腹症之一,发病率在全球范围内正以每年3.07%的增长幅度逐年提升,其总体病死率约为1%[1]。尽管AP患者大多数临床分类为轻度和中度AP,但仍有1/5的患者进展为重症急性胰腺炎(severe acute pancreatitis,SAP),表现为持续性单个器官或多器官功能衰竭,其病死率高达20%[2]。故在疾病早期进行及时有效的针对性干预治疗显得尤为重要,目前临床治疗上多采用早期目标导向液体复苏、肠内外营养、镇痛等对症支持治疗,尚缺乏特异性的治疗药物或干预方法[3]。相关研究表明,线粒体膜通透性改变引起线粒体功能障碍,进而导致自噬受损、内质网应激是引起细胞凋亡和坏死的普遍机制[4],而胰腺腺泡细胞凋亡是介导AP发生发展的关键环节,其在促进炎症反应和多器官继发损伤方面发挥重要作用[5-6]。因此,恢复腺泡细胞凋亡失调成为治疗AP的潜在靶点和方向之一。Wang等[7]表明,敲除锌指蛋白基因ZMYM2转录环状核糖核酸(zinc finger protein gene ZMYM2 transcribed circular RNA,circZMYM2)可使表达乙型肝炎病毒X蛋白的肝细胞免于DNA损伤诱导的细胞凋亡;Wang等[8]发现上调微小RNA-29a(miR-29a)可改善糖尿病心肌病(diabetic cardiomyopathy,DCM)大鼠的心脏结构和功能、减轻心肌组织学异常和纤维化并降低心肌细胞凋亡;何勇等[9]通过对AP相关肺损伤的肺组织检测发现p53上调凋亡调节因子(p53 upregulated modulator of apoptosis,PUMA)上调可促进肺泡上皮细胞凋亡。因此,本研究分析AP腺泡细胞中circZMYM2、miR-29a、PUMA表达水平的变化及其相互关系,以期为AP的治疗提供新靶点及新思路。
1 材料与方法
1.1 实验材料
大鼠胰腺腺泡细胞AR42J购自上海佰利莱生物科技有限公司;DMEM-F12培养基购自武汉普诺赛生命科技有限公司;雨蛙素购自北京索莱宝科技有限公司;pcDNA3.1-si-ZMYM2购自苏州吉玛基因股份有限公司;RAPI蛋白裂解液购自爱必信(上海)生物科技有限公司;BCA蛋白检测试剂盒购自合肥莱尔生物科技有限公司;兔多克隆抗PUMA抗体、鼠单克隆β-actin抗体、山羊抗兔IgG抗体、CCK-8检测试剂盒、膜联蛋白V-APC细胞凋亡检测试剂盒、TUNEL检测试剂盒均购自艾博抗(上海)贸易有限公司;Immobilon™ Western HRP底物试剂盒及电泳槽、TRIzol试剂、PrimeScript RT Master混合物、SYBR Premix Ex TaqTM试剂及荧光定量PCR检测仪、细胞培养箱、全自动多功能酶标仪、FACS Caliber流式细胞分析仪均由安徽医科大学第二附属医院科研实验中心付费提供。
1.2 实验方法
1.2.1 细胞培养与处理 将AR42J腺泡细胞种于含10%胎牛血清和1%青霉素的DMEM-F12培养基中,再将培养基置于37 ℃条件下、5% CO2浓度的细胞培养箱中保存培养。培养基每48 h更换1次,细胞每周传代1次,生长和适应4~6周后进行实验。将AR42J腺泡细胞分为对照组、AP组和si-circZMYM2组。对照组不作处理,AP组用10 nmol/L浓度的雨蛙素诱导AP体外模型,si-circZMYM2组使用pcDNA3.1-si-ZMYM2对AR42J腺泡细胞进行瞬时转染,将转染后的AR42J腺泡细胞置于37 ℃条件下、5% CO2浓度的2 mL正常培养基中继续培养24 h,24 h后与AP组同时按照10 nmol/L浓度的雨蛙素诱导AP体外模型。3 h后检测相关指标。
1.2.2 生化检测 取上清液并以1 000 r/min离心5 min,采用ELISA法检测淀粉酶水平。
1.2.3 细胞活力检测 用CCK-8检测试剂盒检测AR42J腺泡细胞活力,加入CCK-8溶液10 μL后在37 ℃条件下、5% CO2浓度环境中孵育4 h,通过酶标仪测定450 nm处的吸光度值。
1.2.4 细胞凋亡检测 ⑴ 流式细胞术:AR42J腺泡细胞用磷酸缓冲溶液(PBS)洗涤2次,使用膜联蛋白V-APC细胞凋亡检测试剂盒进行染色,所有流式细胞术分析均使用FACS Caliber流式细胞分析仪进行。⑵ TUNEL法:加入原位细胞死亡检测试剂并在37 ℃条件下孵育1 h后检测AR42J腺泡细胞凋亡情况。
1.2.5 Western blot检测 在RAPI蛋白裂解液中裂解后,通过BCA蛋白检测试剂盒完成总蛋白的定量检测,再采用SDS-PAGE电泳2 h进行蛋白质分离,并转移印迹到PVDF膜上。然后将膜浸泡在Tris缓冲盐水和5%脱脂牛奶中并在室温下封闭2 h,最后与以下抗体混合并在4 ℃条件下培养过夜,包括兔多克隆抗PUMA抗体以及鼠单克隆β-actin抗体。用TBST缓冲液洗涤3次后再加入HRP标记的抗体山羊抗兔IgG并在室温下孵育2 h。最后,使用Immobilon™ Western HRP底物试剂盒观察显色;采用Quantity One version 4.6.9 进行密度定量分析。以β-actin作为内参对照。
1.2.6 qRT-PCR检测 使用TRIzol试剂裂解AR42J腺泡细胞后分离提取总RNA,并用PrimeScript RT Master混合物逆转录成cDNA,再使用SYBR Premix Ex TaqTM试剂进行qRT-PCR检测,使用GAPDH和U6作为内参对照,采用2-ΔΔCT法检测circZMYM2相对于GAPDH、miR-29a相对于U6的表达情况。qRT-PCR中使用的所有不同引物序列见表1。

表1 qRT-PCR引物序列Table 1 Primers sequence for qRT-PCR
1.3 统计学处理
所有数据均使用Excel 2019记录,采用IBM SPSS 21.0软件进行统计分析,使用GraphPad Prism 8软件进行图形生成,服从正态分布的测量值以均数±标准差(±s)表示,组间差异对比使用单因素方差分析,P<0.01为差异有统计学意义。
2 结 果
2.1 淀粉酶水平比较
ELISA检测结果显示,与对照组比较,AP组和si-circZMYM2组淀粉酶水平均明显升高(均P<0.01),表明AP细胞模型成功建立,但si-circZMYM2组淀粉酶水平明显低于AP组(P<0.01)(图1)。
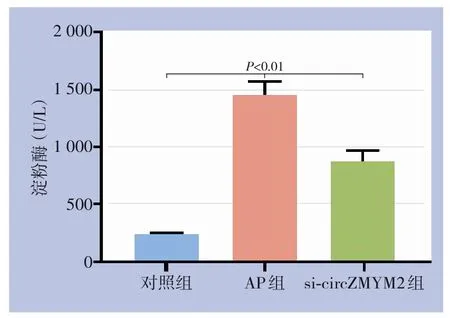
图1 各组细胞淀粉酶水平比较Figure 1 Comparison of amylase levels among the groups of cells
2.2 细胞活力比较
CCK-8实验结果显示,AP组和si-circZMYM2组的细胞活力均明显低于对照组(均P<0.01),而sicircZMYM2组细胞活力明显高于AP组(P<0.01)(图2)。
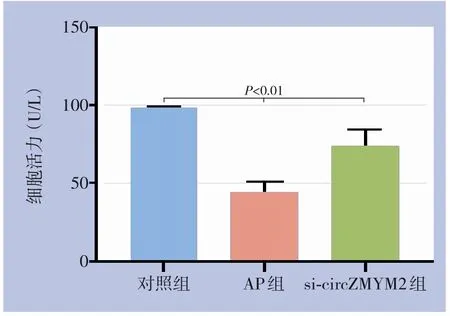
图2 各组细胞活力比较Figure 2 Comparison of cell viability among the groups of cells
2.3 细胞凋亡情况比较
流式细胞术检测结果显示,AP组和sicircZMYM2组细胞凋亡率均显著高于对照组(均P<0.01),而与AP组比较,si-circZMYM2组细胞凋亡率明显降低(P<0.01)(图3A)。TUNEL法检测结果显示,与对照组比较,AP组和si-circZMYM2组凋亡细胞数均明显增加(均P<0.01),但si-circZMYM2组凋亡细胞数明显低于AP组(P<0.01)(图3B)。
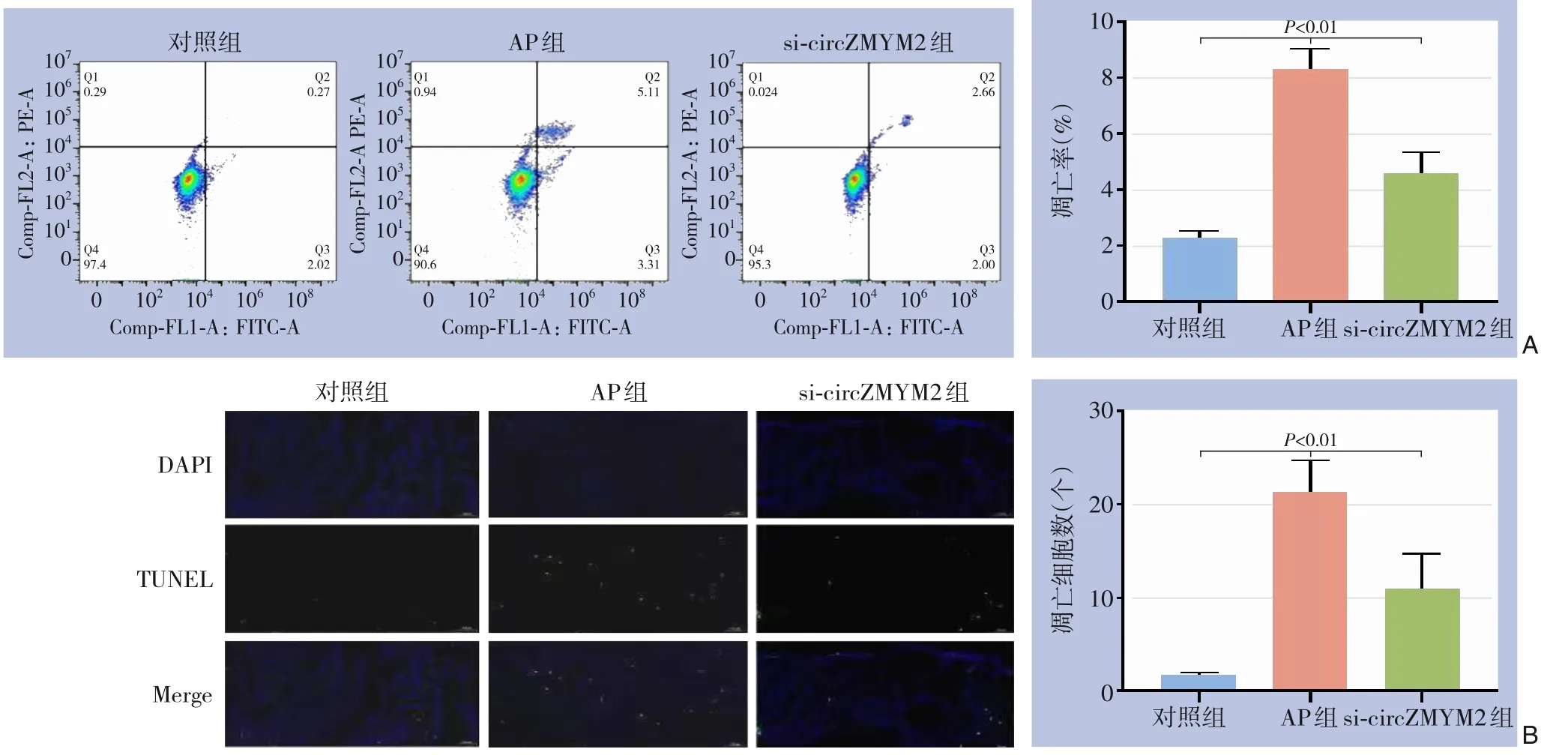
图3 各组细胞凋亡情况比较 A:流式细胞术检测;B:TUNEL法检测Figure 3 Comparison of cell apoptosis status among the groups A: Flow cytometry determination; B: TUNEL assay
2.4 PUMA蛋白表达水平比较
Western blot结果显示,与对照组比较,PUMA蛋白表达水平在AP组和si-circZMYM2组中均明显升高(均P<0.01),但si-circZMYM2组PUMA水平明显低于AP组(P<0.01)(图4)。

图4 各组细胞PUMA蛋白表达水平比较Figure 4 Comparison of PUMA protein expression levels among the groups of cells
2.5 circZMYM2及miR-29a表达水平比较
qRT-PCR法检测结果显示,circZMYM2表达水平在AP组明显高于对照组,而在si-circZMYM2组明显低于对照组和AP组(均P<0.01);miR-29a表达水平在AP组明显低于对照组,而在si-circZMYM2组中明显高于对照组和AP组(P<0.01)(图5)。

图5 各组细胞circZMYM2及miR-29a表达水平比较Figure 5 Comparison of circZMYM2 and miR-29a expression levels among the groups of cells
3 讨 论
AP是多种病因引起的胰酶过度激活释放、胰腺实质自身消化的急性炎症性疾病[10],常见病因包括高脂血症、胆源性结石继发胆胰管梗阻、酒精、内镜逆行胰胆管造影以及药物等,上述病因触发胰腺腺泡细胞一系列病理通路和细胞器功能障碍,最终导致腺泡细胞凋亡坏死以及局部或全身性炎症反应[11]。发生AP时,在严重或持续的内质网应激下,未折叠蛋白反应(unfolded protein response,UPR)破坏保护性细胞反应从而引起不可逆的细胞损伤,细胞凋亡信号通路被激活、细胞凋亡和炎症反应随之发生[12]。细胞凋亡被认为与AP的进展密切相关,AP中非胰腺器官的损伤主要即由细胞凋亡引起[13-14]。因此,进一步探究凋亡机制及信号通路,通过对信号通路相关蛋白的调控来改善细胞凋亡途径,延缓甚至逆转AP的发展病程,成为了治疗AP潜在有吸引力的治疗靶点和思路。
环状RNA(circular RNA,circRNA)是一类非编码闭环RNA,具有结构高度稳定性、细胞组织特异性表达、物种间高度保守等特征[15-16]。其中circZMYM2基因编码一种锌指蛋白,主要定位于细胞核,根据circBase收录信息,circZMYM2可通过反向剪接产生60个环状RNA。circRNA富含稳定的微小核糖核酸(microRNA,miRNA)应答元件,后者作为一种重要的竞争性内源RNA(competing endogenous RNA,ceRNA)与miRNA结合,发挥miRNA海绵作用,常通过负调控miRNA调节下游靶基因表达水平[17]。An等[18]的研究发现,circZMYM2可以通过对其靶点miR-335-5p的海绵作用来抑制miR-335-5p的表达,调节下游致癌基因JMJD2C的表达水平并调控细胞凋亡,从而延缓胰腺癌的进展。吴明浩等[19]的研究表明circKIF4A可与miR-515-5p结合发挥海绵作用并靶向下游SLC7A11的表达,在结直肠癌的生长与侵袭中可能发挥重要作用。本研究首次发现,circZMYM2表达水平在AP组中显著高于对照组、miR-29a表达水平显著低于对照组,而通过对circZMYM2进行转染抑制表达后,与AP组相比,circZMYM2表达水平显著降低、miR-29a表达水平显著升高,腺泡细胞活力显著增加、细胞凋亡率及凋亡细胞数显著降低,初步表明circZMYM2可能同样包含有相应竞争性内源ceRNA并与miR-29a结合发挥miRNA海绵作用,并通过负调控来下调miR-29a水平,从而在AP中调控腺泡细胞凋亡。
微小RNA(microRNA,miRNA)是一种长度约为18到25个核苷酸的小型非编码RNA,这些小分子RNA可以在翻译或转录后水平调控mRNA及靶基因的表达,从而在细胞多种生理和病理过程如增殖、转移、分化和凋亡中发挥重要作用[20]。miR-29家族是疾病中最常见的关联miRNA之一,在多种疾病如骨关节炎[21]、骨质疏松症[22]和恶性肿瘤[23]中均有异常表达,是上述疾病的病因学和发病机制的核心,其中以miR-29a表达最为丰富[24]。相关研究[25]表明,在炎症刺激诱导的信号级联反应中,促炎细胞因子可激活相关转录因子并导致包括miR-29a在内的多种miRNA的上调。Hsu等[26]虽已在糖尿病肾小球功能障碍中证实过表达miR-29a可以通过DKK1/Wnt/β-catenin信号通路挽救高糖诱导的小鼠系膜细胞凋亡并具有保护作用,但在AP等急性炎症性疾病中尚无研究。本研究通过建立AP细胞模型发现,AP组中miR-29a表达水平显著低于对照组,而通过对circZMYM2进行表达抑制后,与AP组相比,si-circZMYM2组的miR-29a表达水平显著升高,而PUMA水平显著下降、细胞凋亡率及凋亡细胞数明显减少,本研究初步表明miR-29a在AP中可能具有抗凋亡作用,其表达水平可能受circZMYM2调控,亦可调控下游PUMA的表达而参与腺泡细胞凋亡。
PUMA作为B淋巴细胞瘤-2基因(B-cell lymphoma-2,BCL-2)家族中促凋亡的BCL-2同源3(BH3)成员,是各种刺激诱导细胞凋亡的最有效介质之一[27]。其中只有PUMA-α和PUMA-β编码蛋白显示出促凋亡活性,它们与线粒体膜中的BCL-2家族成员相互作用,直接激活促凋亡载体BCL-2相关X蛋白(BCL-2-associated X protein,BAX)和/或BCL-2拮抗剂(BCL-2 antagonist/killer,BAK),从而导致线粒体外膜通透(mitochondrial outer membrane permeabilization,MOMP)及线粒体功能障碍、凋亡分子释放以及caspase级联激活,最终诱导细胞凋亡坏死[28]。目前已有研究[29]表明miR-29a可调控Bax和PUMA的表达、Caspase-3的激活以及细胞凋亡。Wei等[30]通过萤光素酶报告基因实验和Western blot分析进一步证明了miR-29a在成熟交感神经元中能够靶向调控促凋亡BCL-2家族成员PUMA的表达。本研究发现在AP组中PUMA表达水平显著升高,细胞活力下降、细胞凋亡率及凋亡细胞数明显增加,而通过对circZMYM2进行表达抑制后,腺泡细胞miR-29a表达水平显著升高,而PUMA水平显著下降、细胞凋亡率及凋亡细胞数明显减少,表明miR-29a对促凋亡基因PUMA可能起负调控作用并抑制其表达,从而调控腺泡细胞凋亡。
综上所述,circZMYM2在AP的腺泡细胞中表达水平显著升高,其可能通过内源竞争性作用与miR-29a结合并抑制miR-29的表达,从而上调下游靶基因PUMA的表达水平并诱导腺泡细胞凋亡,而通过抑制circZMYM2表达可上调miR-29a表达水平并抑制下游PUMA表达水平,进而减少腺泡细胞凋亡,据此笔者推测circZMYM2/miR-29a/PUMA轴可能在AP的腺泡细胞凋亡调控中发挥重要作用,为AP的特异性治疗方面提供新靶点及新思路。然而,本研究也存在一定局限性,如未在临床水平检测正常患者和AP患者circZMYM2、miR-29a及PUMA的表达水平变化,也未在细胞实验中过表达或沉默miR-29a进一步验证circZMYM2/miR-29a/PUMA轴的靶向作用机制,本课题组将在后续实验中进一步完善来加以佐证。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:高明负责实验设计与实施以及论文撰写,王琪负责数据的收集与统计学分析,孙远松负责技术、材料支持,李贺负责指导实验、审核和修改论文。

