小肠自体移植式扩大胰腺癌根治术的疗效与安全性分析:附2例报告
刘军桂,张涛,刘翔,郭宇,金奎,雷磊,段伟宏
(1.中国人民解放军火箭军特色医学中心 肝胆外科,北京 100088;2.中国人民解放军空军特色医学中心 肝胆外科,北京 100142)
胰腺癌具有高度的恶性和侵袭性,影响着患者的生活质量和生存时间[1-3]。目前,外科手术切除仍然是胰腺癌有机会获得治愈的唯一方式。随着血管重建技术与自体器官移植技术的进步,小肠自体移植技术对于肿瘤侵犯肠系膜上动脉(superior mesenteric artery,SMA)、肠系膜上静脉/门静脉(superior mesenteric vein,SMV/portal vein,PV)主干超过180°的局部进展期胰腺癌(locally advanced pancreatic cancer,LAPC)的根治性切除成为可能。笔者所在团队成功实施了2例小肠自体移植式胰腺癌扩大根治手术,取得良好效果,现将其诊治经过报告如下。
1 资料与方法
1.1 病例资料
患者1 女,66岁。2022年2月开始出现腹胀伴腰背部疼痛,呈进行性加重,当地医院行腹部CT检查见:胰腺钩突见4.4 cm×3.9 cm的肿块影,包绕SMA/SMV/PV,考虑胰腺癌累及周围动脉及PV系统,穿刺病理见胰腺导管腺癌,当地医院给予放疗联合化疗(FOLFIRINOX),但患者耐受性极差,改为对症支持治疗,2022年5月份开始出现恶心呕吐症状,呕吐物内含大量胆汁,考虑瘤体累及十二指肠水平段引起上消化道梗阻,为求治疗于2022年6月25日收治入中国人民解放军火箭军特色医学中心。
患者2 女,58岁。2023年3月开始出现腹胀及疼痛,呈进行性加重,未行系统检查治疗,2个月后出现呕吐症状,不能进食,就诊当地医院腹部CT检查:胰头钩突占位性病灶,增强后呈乏血供表现,考虑恶性肿瘤,为求治疗于2023年5月30日收治入中国人民解放军火箭军特色医学中心。
1.2 术前检查
1.2.1 患者1 血常规:白细胞(WBC)3.23×109/L,红细胞(RBC)3.51×1012/L,血小板(PLT)228×109/L,血红蛋白(HB)104 g/L。生化检查:总胆红素(TBIL)4.55 μmol/L,直接胆红素(DBIL)1.63 μmol/L,间接胆红素(IBIL)2.92 μmol/L,丙氨酸氨基转氨酶(ALT)12.6 U/L,天冬氨酸氨基转氨酶(AST)13.9 U/L,总蛋白66.5 g/L,白蛋白38.1 g/L。血清肿瘤标志物:糖基抗原19-9(CA19-9)355 U/mL,糖类抗原50(CA50)250.9 IU/mL,癌胚抗原(CEA)0.30 ng/L。术前增强CT提示胰腺钩突占位性病变,约4.4 cm×3.9 cm大小,边界欠清,密度不均匀,增强扫描呈渐进性轻度强化,动脉期CT值为51 HU,门脉期CT值为83 HU,延迟期为96 HU,延迟期强化程度低于邻近胰腺组织,病变包绕SMA、SMV(图1)。
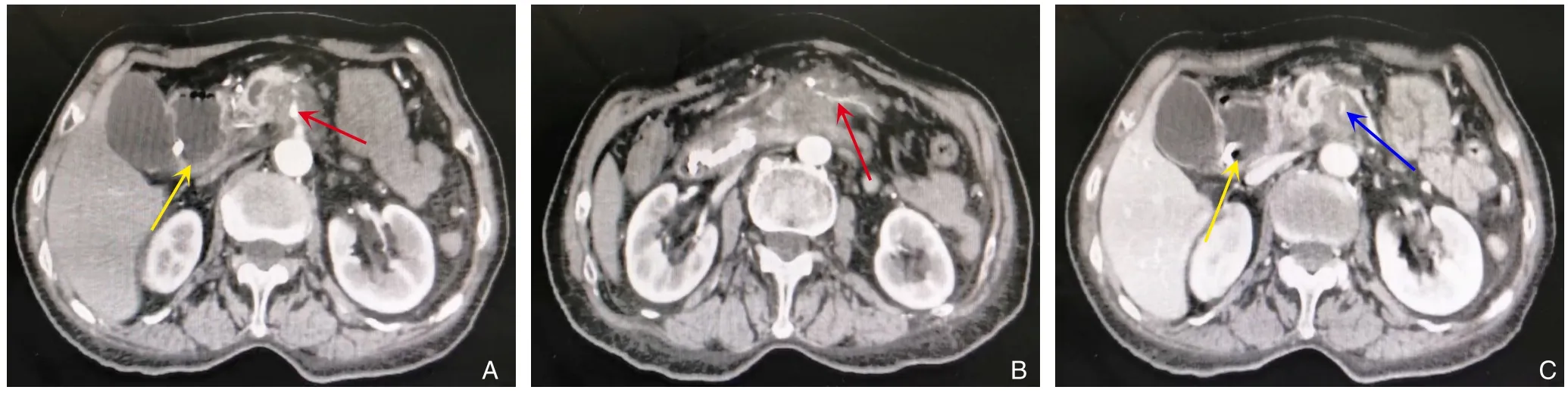
图1 患者1术前影像资料 A-B:SMA及空肠动脉被肿瘤包绕(红色实箭头),黄色箭头示扩张的十二指肠;C:SMV及其分支受侵犯(蓝色实箭头),黄色箭头示扩张的十二指肠Figure 1 Preoperative imaging data of case 1 A-B: Encirclement of the SMA and jejunal artery by the tumor (red solid arrows),with the yellow arrow indicating the dilated duodenum; C: Invasion of the SMV and its branches (blue solid arrows),with the yellow arrow showing the dilated duodenum
1.2.2 患者2 血常规:WBC 4.3×109/L,RBC 3.67×1012/L,PLT 157×109/L,HB 113 g/L。生化检查:TBIL 13.8 μmol/L,DBIL 5.8 μmol/L,IBIL 8.0 μmol/L,ALT 43.4 U/L,AST 13.2 U/L,总蛋白59.6 g/L,白蛋白38.4 g/L。血清肿瘤标志物:CA19-9 8.8 U/mL,CA50 6.7 IU/mL,CEA 3.29 ng/L。术前增强CT提示胰腺钩突区软组织密度团块,约2.3 cm×3.0 cm大小,增强扫描呈轻中度不均匀延迟强化,病变沿SMA蔓延,SMA、SMV及脾静脉受累明显变窄,十二指肠降段受累致胃扩张(图2)。
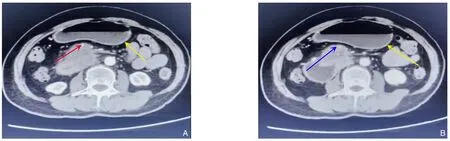
图2 患者2术前影像资料 A-B:SMA/SMV被肿瘤侵犯包绕(红色实箭头/蓝色实箭头)、黄色实箭头为扩张的胃Figure 2 Preoperative imaging data of case 2 A-B: Invasion and encirclement of the SMA/SMV by the tumor (red solid arrows/blue solid arrows),with the yellow solid arrows indicating a dilated stomach
1.3 术前评估
1.3.1 手术耐受性评估 患者1为老年女性,一般情况可,2014年出现室性心律失常,口服普罗帕酮及美托洛尔治疗,入院后复查动态心电图示频发室性早搏伴二联律、三联律;心脏超声左心射血分数63%;胸部CT未见明显异常;肝功能Child-Pugh评分分级A级;心内科及麻醉科术前评估未见绝对手术禁忌证。患者2为中年女性,一般情况好,术前的胸部CT、心脏超声以及心电图检查均未见异常,心肺功能正常。肝功能Child-Pugh评分分级A级;麻醉科术前评估全身情况能够耐受手术。
1.3.2 手术切除可行性评估 2例病例术前均行MDT讨论。患者1腹痛症状明显且无法耐受化疗,十二指肠梗阻表现日趋严重,胸、腹部CT未见远处转移;肿瘤包绕SMA,受累长度7 cm(左侧:第2、3支空肠动脉,中间:结肠中动脉,右侧:右结肠动脉)、SMV受累,长度7 cm(上端:脾静脉汇入处上方,下端SMV分叉处下方)腹腔干(celiac axis,CA)及脾动脉(splenic artery,SpA)未见累及,SpA可充分游离,动脉重建选择SMA与SpA对端吻合,切除重建后能够保留足够肠管且能满足R0切除的需要。拟行小肠自体移植式扩大胰腺癌根治术(全胰腺切除;横结肠及右半结肠切除;SMA/SMV切除6~7 cm;小肠自体移植;PVSMV吻合;SpA转位与SMA吻合),于2022年7月18日实施手术。患者2入院时剧烈腹痛合并十二指肠梗阻,PET/CT未见远处转移;肿瘤包绕SMA,长度约8 cm(距离根部7 cm);SMV及其分支受累,长度约8 cm。拟行小肠自体移植式全胰腺联合血管切除手术(全胰腺十二指肠联合近端2 m空肠切除+右半结肠切除+SMA/SMV切除8 cm后对端吻合重建+小肠自体移植术),于2023年6月8日实施手术。
1.4 手术过程
患者1:腹腔镜探查未见腹腔转移,后取正中切口,上至剑突绕脐至脐下逐层进腹腔。探查肿瘤位置及侵犯肠系膜血管情况,后先行切除手术:⑴ 游离胰头十二指肠:将十二指肠降段、胰头及水平段完全游离,并显露下腔静脉、左肾静脉及腹主动脉。⑵ 廓清肝总(固有)动脉周围组织,显露SMA根部:此过程经肝门部解剖分离出左右肝动脉,逐步游离至肝总动脉根部,期间廓清动脉周围组织,再向腹腔干根部解剖,分离出SpA根部,向下解剖出SMA根部。⑶ PV全程显露及其周围廓清:悬吊肝动脉,显露PV前壁,沿其走形尽可能长的显露PV,上端至左右支分叉处,下端至脾静脉汇合处直至SMV。⑷ 切除手术:解剖肠系膜血管确认结肠中动、静脉及右结肠动、静脉受累,调整术中方案增加横结肠切除,回盲部内侧约10 cm离断远端回肠、结肠中动脉左侧约5 cm离断横结肠、胃大弯侧无血管区用直线切割器自离断,完整游离出胰腺体尾部及脾脏;空肠第1、2、3支动脉受累,离断十二指肠3、4段周围系膜,在Treiz韧带以远60 cm处离断空肠,离断SMA分支,远端保留充足的吻合长度,离断SMA根部、SMV属支及PV主干,整块移除胆囊、肝外胆管、胃远端、十二指肠、部分空肠、右结肠、横结肠和全胰腺及脾脏(图3A-D)。优先行小肠自体移植,翻转SpA,并修剪残端,与空肠动脉支行吻合(图3E),检查吻合口通畅,未见扭转,远端动脉搏动好,同时动脉支配区域肠管未见缺血,SMV与PV行对端吻合(SMA、SMV吻合时间共约24 min)。消化道重建:远端回肠与结肠端侧吻合;肝总管与空肠黏膜对黏膜端侧吻合,吻合口约10 mm;距胆肠吻合处40 cm处上提与胃行胃肠吻合。
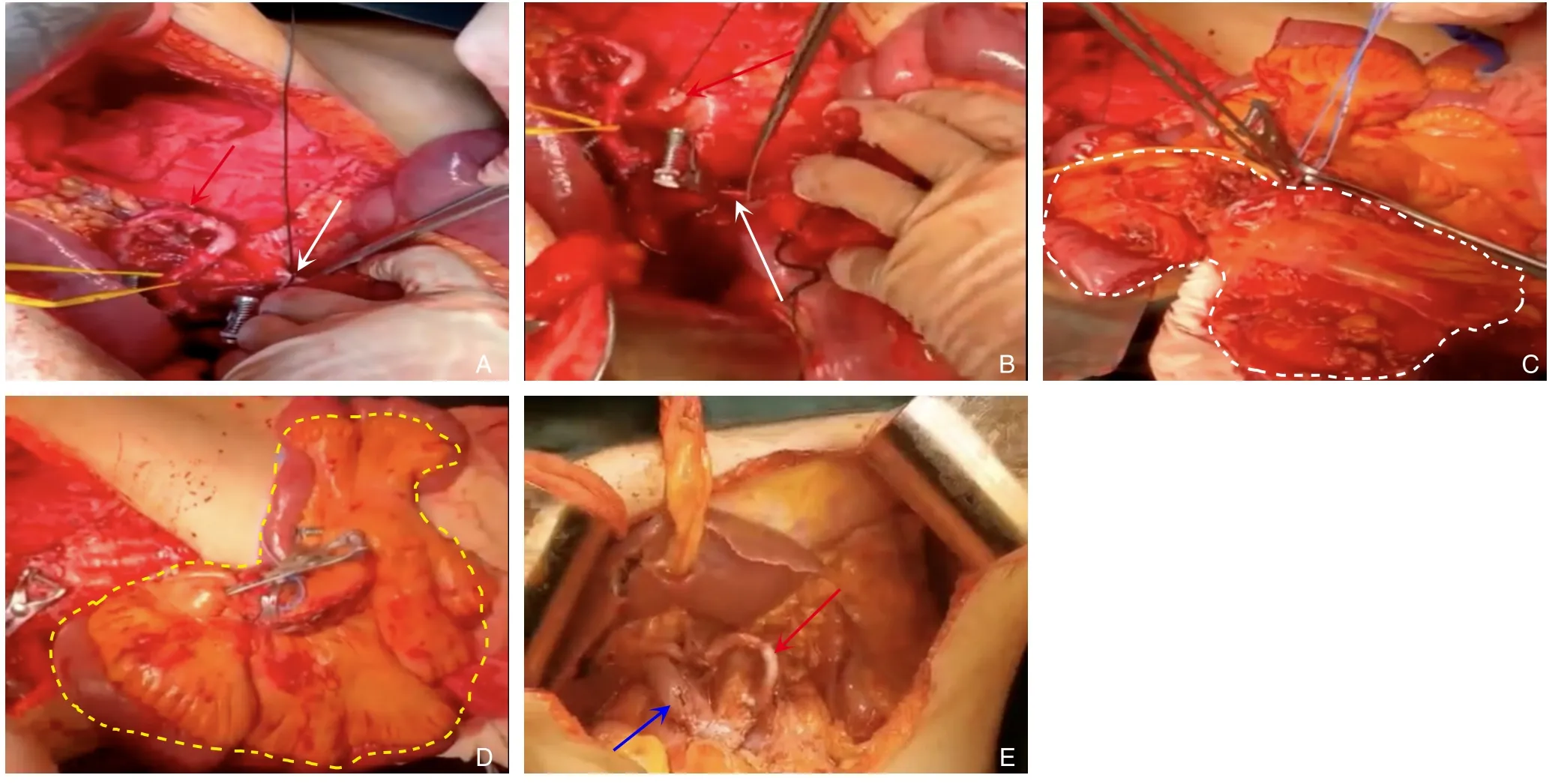
图3 患者1术中照片 A:保留的SpA,备行动脉重建(红色实箭头)、拟剪断的SMA近心侧(白色实箭头);B:红色实箭头为SMA断端、白色实箭头为拟剪断的SMV近心侧,后将肿瘤及全部小肠整体移除;C:白色虚线内区域为拟切除的手术标本(肿瘤及要切除的小肠);D:黄色虚线内区域为要保留的小肠(约3.5 m);E:SMA与SpA对端吻合(红色实箭头)、SMV与PV对端吻合(蓝色实箭头)Figure 3 Intraoperative photographs of case 1 A: Preserved SpA,for subsequent arterial reconstruction (red solid arrow),proximal side of the SMA to be cut (white solid arrow); B: Red solid arrow showing the cut end of the SMA,white solid arrow showing the proximal side of the SMV to be cut,followed by en block resection of the tumor and entire small intestine; C: The area inside the white dashed line representing the intended surgical specimen to be removed (tumor and the portion of the small intestine to be excised); D: The area inside the yellow dashed line representing the portion of the small intestine to be preserved (approximately 3.5 m); E: End-to-end anastomosis of SMA with SpA (red solid arrow) and end-to-end anastomosis of SMV with PV (blue solid arrow)
患者2:腹腔镜探查未见远处转移后开腹行根治性切除术,手术切除部分与患者1基本雷同,不同之处在于:患者2右结肠动、静脉受累,空肠第1、2、3支动脉受累游离出相对较粗SMA分支,在Treiz韧带远180 cm处离断空肠,确保供应足够长度空肠血供,整块移除胆囊、肝外胆管、胃远端、十二指肠、部分空肠、右结肠、全胰腺(脾脏保留)。优先行小肠自体移植,肠系膜上动、静脉对端吻合(SMA、SMV吻合时间共约18 min)。自体移植后小肠,颜色红润,无缺血表现(图4)。消化道重建经过同患者1。
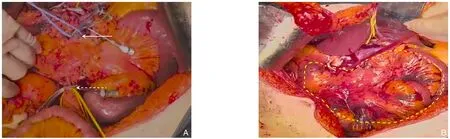
图4 患者2术中照片 A:白色实箭头指示拟首先剪断的SMA、SMV近心侧,白色虚箭头指示为体外剪断的SMA、SMV远心侧;B:黄色区域为自体移植后小肠,颜色红润,无缺血表现(该患者实施SMA对端吻合,SMV与PV对端吻合)Figure 4 Intraoperative pictures of case 2 A: The white solid arrow indicating the proximal side of SMA and SMV to be cut first,and the white dashed arrow indicating the distal side of SMA and SMV to be cut outside the body; B: The yellow area representing the small intestine after autotransplantation,appearing healthy with no signs of ischemia (in this case,end-toend anastomosis of SMA and end-to-end anastomosis of SMV with PV were performed)
2 结 果
两例手术均取得成功。患者1手术时间约8 h,术中优先行动脉重建,采用SMA分支与SpA吻合,SMV与PV对端吻合,小肠热缺血时间约24 min、保留小肠长度超过3.5 m,术中失血1 000 mL,输入6 U红细胞、400 mL新鲜冷冻血浆。术后病理为胰腺中低分化腺癌,部分区域见癌巨细胞,肿瘤大小5 cm×4 cm×3 cm,肿瘤细胞包绕SMA,癌组织侵犯神经,侵及小肠肠壁及周围组织;PV周围结缔组织内见癌组织浸润,切缘未见癌组织。患者术后腰背部疼痛消失,间断出现腹泻,补充胰酶后改善,胰岛素控制血糖,未实施放化疗及靶向免疫治疗。目前已随访12个月,生活质量好,可骑自行车遛弯。复查未见肿瘤复发及转移表现。患者2手术时间约7.5 h,采用SMA对端吻合,SMV与PV对端吻合,小肠热缺血时间约18 min、保留小肠长度超过2.8 m,术中失血800 mL,输入4 U红细胞、400 mL新鲜冷冻血浆。术后病理为胰胆管型壶腹部腺癌,肿瘤大小7 cm×7 cm×5 cm,肿瘤侵及十二指肠全层粘连胰腺及周围脂肪组织,可见神经侵犯,未见明确脉管癌栓,切缘未见肿瘤组织,淋巴结(0/26)。患者术后腰背部疼痛消除,术后恢复低脂饮食,每日补充胰酶,胰岛素控制血糖,目前为术后2个月,尚未开始实施后续治疗。
3 讨 论
源于胰腺、腹膜后组织或肠系膜的肿瘤容易侵犯并包绕SMA和(或)SMV,给手术带来一定的困难,但根治性手术切除仍然是这类肿瘤获益最大的选择[4-8]。胰头颈部、钩突区域及壶腹部肿瘤进展时极易侵犯SMA和SMV、并常侵犯>180°,甚至呈360°包绕,NCCN指南[9]将局部进展不可切除胰腺癌更改为LAPC,到近年来的热点“转化治疗”也体现出根治性手术切除在进展期胰腺癌中的重大意义[10-12]。
胰腺癌行动静脉血管切除在有经验的胰腺中心早已开展[13-15]。小肠自体移植是切除包绕SMA和(或)SMV肿瘤的一项有效手段,为LAPC提供根治性切除机会。最早由Lai等[16]报告胰腺切除联合小肠自体移植治疗胰腺癌,但因其技术复杂,并没有广泛推广。常见的小肠自体移植将肿瘤连同小肠、部分结肠、肠系膜根部及整个或部分胰腺整体切除,体外用冷冻保存溶液灌洗SMA[17-18],其优点在于小肠离体后进行保存液的灌注,既可以保护肠道,又提供无血的手术视野,让肿瘤的剥离、血管的重建等操作更加从容和方便。研究表明动脉缺血>30 min 时小肠发生缺血坏死的风险显著增高[19],但日本学者曾在小肠热缺血时间超过1 h行小肠自体移植,术后仍获得良好效果[20]。然而小肠自体移植技术的复杂性不言而喻,热缺血时间过长导致移植后小肠发生缺血再灌注损伤,引起肠壁水肿而脆性增加,行消化道重建时易出现吻合口瘘、出血,术后发生慢性腹泻、营养不良以及短肠综合征。因此,必须进行严格的术前检查、术中仔细评估。Liang等[21]提出了可行小肠自体移植的标准:⑴ 肿瘤侵犯SMA>180°且侵犯长度>4 cm;⑵ 肿瘤侵犯空肠动脉第一分支分叉周围的SMA;⑶ 远端肿瘤侵犯PV/SMV>5 cm,涉及空肠静脉、结肠中静脉或回结肠静脉汇入SMV的汇合点。
熟练的血管吻合技术是小肠自体移植手术成功的关键,否则将引起小肠缺血甚至坏死,进而导致短肠综合征甚至肠功能衰竭,从而影响到患者的生活质量乃至生命安全。术前应仔细阅片,术中应根据仔细探查,做出恰当的血管吻合策略;如术中SMA切除较长,可预留出SpA并将其翻转与SMA行端端吻合术;常见的SMV受侵犯的切除后可行端端吻合,切除过长时往往需要人工血管、异体或自体血管进行吻合重建。小肠自体移植手术可以无张力进行动静脉血管重建,其安全性及可行性已得到验证[21-23]。
笔者团队深耕中晚期胰腺癌的外科治疗,依托肝移植血管重建技术,对胰腺癌的根治以及SMA、SMV、脾静脉、肝动脉切除重建上积累丰富的经验[24-26]。研究[27-28]表明,在有经验的胰腺外科中心行血管联合切除的胰腺癌根治术是安全可行的,且能为患者带来更长的生存获益。临床上LAPC的病例并不少见,肿瘤侵犯动静脉血管、后腹膜神经丛,出现顽固的腹痛,肿瘤侵犯十二指肠则消化道梗阻,转化治疗或化疗周期长,副反应的发生常使患者及家属望而却步,此时能够手术切除就意味着患者拥有能够有尊严地活下去的希望。常规的可切除胰腺癌侵犯SMV超过6 cm时,需要应用异体血管进行替代吻合,SMA缺损较长时,可以使用SpA翻转下来与远端吻合,通常不需要异体血管,而小肠系膜离体切除的方式,不仅保证了可以不用顾忌切除较长受侵犯血管的胰腺癌根治性,更是在切除肿瘤后将小肠系膜直接上提,与PV断端进行完全接触式的、无张力的、不需任何替代血管的直接吻合,动脉则很容易利用SpA-SMA进行吻合,这样大大拓宽了胰腺癌切除的适应证,使得LAPC可以获得较高切除率及较高R0比例,为后续治疗下较好的基础。与Liang等[21]的“离断小肠→保存液灌注→切除肿瘤、移除标本→先静脉、再动脉吻合”的技术路线不同,笔者团队严格把控小肠热缺血时间,将小肠连同肿瘤标本一并切除至体外,再迅速移除标本。因为小肠耐受动脉缺血的时间短于小肠耐受静脉淤血的时间,首先进行动脉吻合(SpA-SMA/SMA-SMA),然后再进行静脉吻合(PV-SMV)。本组2例患者,目前随访时间分别为12个月和2个月,复查未发现肿瘤复发及转移。
全胰腺切除后,内、外分泌功能都会受到影响[29-30]。胰酶缺乏,加之SMA切除后神经纤维离断,都会导致患者术后较顽固的腹泻。早期可使用生长抑素、胰酶制剂及抑制肠蠕动、肠激惹的药物,后期可在饮食结构方面进行调整,使排便次数尽量正常,经过调整,患者可以达到每日1~2次大便,营养状态也会得到很好的改善。此外血糖的调整至关重要,这主要需要对患者及家属进行专业宣教,在饮食、胰岛素使用方面有机配合,就能达到良好的血糖状态。外分泌功能的丧失导致食物消化和吸收出现障碍,表现为脂肪泻、消瘦,可在调整饮食结构的基础上,补充外源性胰消化酶。
笔者团队认为小肠自体移植式扩大胰腺癌根治术具有一定的可行性和安全性,在拓宽局部晚期胰腺癌手术治疗根治方面具有积极的意义,与以往小肠切除后再行肿瘤切除,小肠需保存在冷灌注液中不同,依据自身团队的手术技巧,最大限度控制小肠的热缺血时间,保持其术后的功能。鉴于该手术方式复杂,可能存在严重的血管吻合后并发症及多个器官功能丧失等,因此,病例应进行高度选择,进行充分的术前评估。手术采用中间入路,优先探查肠系膜上动静脉情况,游离并确认血管切除的上、下缘,为保证手术安全,应游离正常血管长度>1 cm,以备吻合重建。肠管能耐受较长时间淤血状态,但长时间的缺血状态对肠管影响较大。因此,移除标本时,应先离断静脉,后离断动脉,而血管重建时则顺序相反,遵循“先动脉、后静脉”的吻合顺序进行无张力吻合[26]。当然,还需要更长时间的随访,更大的样本量,以及术后的综合治疗来进一步观察患者术后的生活质量和生存时间。
志谢:本文作者均感谢已故周宁新教授所传授的不断突破与创新的外科理念。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:段伟宏主要负责手术设计及操作,并修改文章;刘军桂主要协助设计及手术操作,并修改文章;张涛负责资料整理,文章撰写;刘翔负责数据收集并和郭宇、金奎一起负责临床工作;雷磊负责资料收集和随访。

