“单孔+1”荧光腹腔镜下保留十二指肠胰头切除术在胰头良性肿瘤中的应用
游欣雨,程东辉,蒋佶朋,左邦佑,郝建杰,3,刘涛,张宇
(1.四川省医学科学院·四川省人民医院/电子科技大学附属医院 肝胆胰外科,四川 成都 610072;2.西南医科大学,四川 泸州 646000;3.电子科技大学医学院,四川 成都 611731)
胰十二指肠切除术(pancreaticoduodenectomy,PD)是治疗胰头良恶性肿瘤的经典术式,该术式涉及胆道、胃肠道、胰腺的切除与吻合重建,创伤大、并发症较多。随着高分辨率CT与MRI的广泛应用,越来越多的胰头良性或低度恶性肿瘤被诊断出来,包括慢性胰腺炎、胰腺浆液性囊腺瘤、神经内分泌肿瘤、实性假乳头状肿瘤、胰腺导管内乳头状黏液瘤等[1],这些肿瘤手术切除预后良好,复发转移率低。不过,PD虽可以满足根治要求,但创伤过大。1972年Beger首次报道保留十二指肠胰头切除术(duodenum-preserving pancreatic head resection,DPPHR)用于治疗慢性胰腺炎,与PD相比,它保留了十二指肠消化、吸收功能,保留了Oddi括约肌,避免了肠道内容物反流及胆肠吻合所带来的远期影响,现已广泛用于胰头良性或低度恶性肿瘤的治疗。随着微创技术的发展,腹腔镜手术与DPPHR相结合,腹腔镜保留十二指肠胰头切除术(laparoscopic duodenum-preserving pancreatic head resection,LDPPHR)应运而生。LDPPHR相较于DPPHR可借助腹腔镜的高清、放大优势更加精细地解剖血管,保留胰十二指肠前、后动脉弓,保障胆总管胰腺段及十二指肠乳头血供[2],更加微创且精确。
另一方面,自1990年推出单切口腹腔镜手术(single-incision laparoscopic surgeries,SILS)以来,其作为微创手术广泛应用于胆囊切除术、脾切除术、胃切除术和结肠切除术[3]。SILS最大限度地减少切口数量,具有疼痛更少,伤口并发症更少,恢复更快和美观性好的潜在优势[4]。但由于学习曲线陡峭和“筷子”效应及较小的器械工作角度,SILS在胰腺手术中的应用长期处于困境,单孔腹腔镜胰十二指肠切除术(single-incision laparoscopic pancreaticoduodenectomy,SILPD)虽然较多孔腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)减少了术后疼痛,但其手术时间更长,脾脏及脾血管保留率更低[5-6],而SILS在DPPHR方面更是鲜有报道。笔者团队每年开展LPD超过50台,在大量实践探索中进行改良,认为只要添加1个12 mm辅助Trocar(SILS+1)就可以很大程度改善SILS的“筷子”效应,辅助孔的加入亦提供了更多的器械工作角度,其学习曲线也有所减缓。笔者团队将SILS+1与LDPPHR结合,开展单孔+1腹腔镜保留十二指肠的胰头切除手术(single-incision laparoscopic plus one port duodenum-preserving pancreatic head resection,SILDPPHR+1),至今团队共完成8例SILDPPHR+1手术,且在实践中不断探索改进、总结,以研究其对胰腺良性疾病的疗效。
1 资料与方法
1.1 临床资料
回顾性分析2022年2月—2023年5月四川省医学科学院·四川省人民医院肝胆胰外科8例接受了SILDPPHR+1患者的病历资料,8例患者平均年龄为(55±14)岁;男6例,女2例。所有患者术前均完善相关检查。术前完善增强CT、增强MRI+MRCP及实验室检查诊断为良性病变,并排除了远处转移,利用增强CT、MRCP及基于CT的三维重建排除了重要血管及胆总管胰腺段受侵(图1)。术前血常规、肝肾功能、凝血功能、心电图及心脏超声无手术绝对禁忌证。麻醉ASA评分I~Ⅱ分。在经过评估后,中心所在多学科团队(multidisciplinary team,MDT)得出的结论:8例患者均为SILDPPHR+1适应对象,在保留十二指肠的同时可以完成对胰头病变的切除,告知病患风险与并发症,患者及家属均知情同意,进行SILDPPHR+1。本研究经四川省医学科学院·四川省人民医院伦理委员会审批(批号:2023年第182号)。
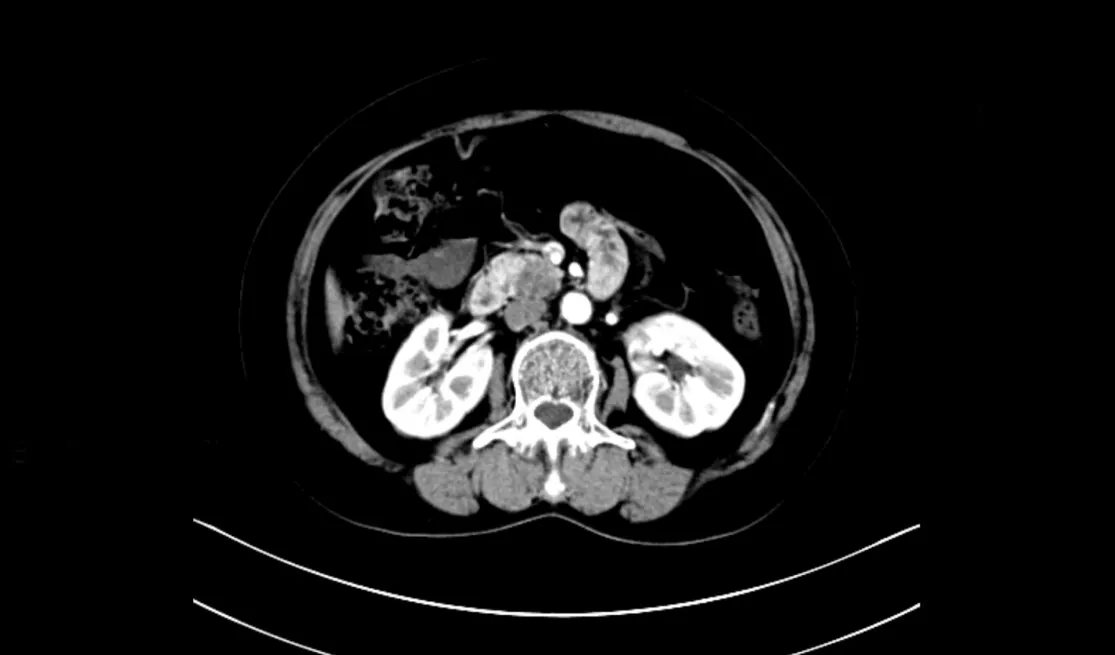
图1 术前增强CT显示胰腺肿瘤Figure 1 Preoperative enhanced CT showing pancreatic mass
1.2 纳入排除标准
纳入标准:⑴ 经临床及影像学诊断为胰腺良性病变;⑵ 肿瘤未侵犯重要血管、胆总管及十二指肠;⑶ 术前评估患者可耐受手术及麻醉。排除标准:⑴ 肿瘤考虑为恶性;⑵ 患者存在严重心、肝、肾功能不全及血液系统疾病;⑶ 患者预期寿命较短。
1.3 手术方式
患者取“人”字体位,取头高脚低。扶镜手持30°腹腔镜站在患者两腿之间,主刀医生和一助分别从患者的左侧和右侧进行手术。术中经颈外静脉导管注射20 mg/mL吲哚菁绿(indocyanine green,ICG)(丹东医创,中国,丹东)1 mL导航胆总管。经脐区纵切4 cm。然后,将1个多通道单孔Trocar(北京航天卡迪科技研究院,中国,北京)放进切口,以2个5 mm通道和2个12 mm通道作为操作孔。为了提供更好的工作空间,在左锁骨中线肋弓下3 cm处增设12 mm Trocar。单孔Trocar左侧12 mm通道和附加左肋缘下12 mm Trocar由主刀医生操作,下方12 mm通道供扶镜手插入腹腔镜,右侧12 mm通道由一助使用(图2)。

图2 术中Trocar布局与医护人员站位 A:单孔+1布局;B:外科医生、麻醉医生、器械护士站位Figure 2 Intraoperative trocar arrangement and positioning of medical staff A: Single-incision +1 layout; B: Positions of the surgeon,anesthesiologist,and instrument nurse
SILDPPHR-T+1的步骤如下:⑴ 悬吊左肝,打开胃结肠韧带,进入小网膜囊,悬吊胃露出胰腺,探查肿瘤边缘。⑵ 切开肝结肠韧带,显露十二指肠外侧。⑶ 从胰腺下方切开胰头后腹膜及包膜,仔细解剖胰腺组织,保留胰十二指肠下动脉弓。⑷ 游离胰腺下段,显露肠系膜上静脉(uperior mesenteric vein,SMV),经胰后隧道,用超声刀或电钩切断胰腺颈部,肿瘤一侧部分胰管组织送速冻病理(病理结果呈阴性)。⑸ 将SMV向左推,沿肠系膜上动脉(superior mesenteric artery,SMA)向上切除胰腺钩状突。向上提起钩突残端,仔细解剖SMV与右侧胰腺组织之间的软结缔组织,最大限度地保留胰头后的血管。⑹ 在剥离过程中,采用实时ICG荧光融合影像(fusion indocyanine green fluorescence imaging,FIGFI)显示胆总管,以保护其不被损伤,术中也能清楚地显示胆总管和Wirsung导管的汇合处。⑺ 取标本袋装肿瘤,经单孔切口取出。⑻ 肿瘤切除后,经颈外静脉导管再次注射20 mg/mL ICG 1 mL,检查十二指肠血供情况。⑼ 消化道重建3例采用胰胃吻合术,即胰管近端采用双层吻合术与胃壁背面吻合,采用4-0聚乙醇酸(Vicryl Plus;Ethicon,Cincinnati,美国,俄亥俄州),同时用相同的缝线将胰腺外层连续缝合到整个胃层。吻合口用1根F12硅胶管作为支撑管,后期经胃镜取出;5例采用改良Blumgart胰肠吻合术。SILDPPHR+1术中相关场景见图3。
2 结 果
8例SILDPPHR+1的手术时间为(360±68)min,术中出血(84±26)mL。术后2 d去除患者导尿管,可以缓慢下床行走。他们大多在术后第3天开始肛门排气。为检查胰胃或胰肠吻合口是否完好,经鼻胃管注射0.8 mg/mL亚甲蓝(济川药业集团有限公司,中国,济川)50 mL,观察24 h。8例患者在引流管中均没有发现亚甲基蓝,所以在术后第5天拔除鼻胃管,开始进食流食。术后5 d复查腹部CT未见腹腔积液。术后病理示:5例术后病理诊断为导管内乳头状黏液性肿瘤、2例为浆液性囊腺瘤、1例为慢性胰腺炎。随访期间所有患者未见局部复发或远处转移征象,术后未出现低血糖或高血糖,未出现呕吐、腹泻等胃肠道功能障碍,2例出现A级胰瘘(参照国际胰瘘研究小组2016版的诊断与分级标准[7]),1例出现了胆道狭窄,表现为术后11 d出现腹痛、发热、胆红素升高,经内镜植入胆道支架后症状缓解。术后住院时间为(9±2)d。8例患者随访(7.8±4.6)个月,均未出现肿瘤复发及严重的胃肠道功能障碍。8例患者的术中与术后的基本情况见表1。

表1 8例患者的术中与术后情况Table 1 Intraoperative and postoperative conditions of the 8 patients
3 讨 论
随着影像技术的发展,越来越多的良性或癌前肿瘤被诊断出来。PD或LPD是大多数肝胆外科医生青睐的治疗这些良性肿瘤的方法。随着对壶腹区解剖认识的加深和器官保留手术的兴起,DPPHR手术应运而生[8]。DPPHR术后具有较低的消化道功能障碍发生率[9-11],可以维持胰腺内分泌和外分泌功能[11-13],术后LDPPHR患者发生胰瘘的概率也低于开腹DPPHR[1,13-14],生活质量评分较高的优势,且随着荧光导航、3D腹腔镜技术的兴起,LDPPHR的安全性与可操作性得到了提升[15]。与此同时,外科医生亦在追求更加微创的术式,随着外科器械、外科理论的发展,越来越多传统开腹手术可通过腹腔镜手术完成,而单孔腹腔镜术式则是追求微创的极致体现。20多年前,Inoue等[16]首次将SILS应用于阑尾切除手术中,随后这项创新技术被广泛应用于胆囊切除术[17]、脾切除术[18]、胃切除术[19]和结肠切除术[20]。许多研究表明,与多孔腹腔镜手术相比,SILS的术后疼痛更少,住院时间更短,恢复工作更快[17,20],但因SILS难度大,难以在胰腺手术,尤其是在DPPHR中开展,故而笔者团队在SILDPPHR基础上通过在左肋缘下增加1个12 mm Trocar辅助操作,即“SILDPPHR+1”。
笔者认为SILDPPHR+1的手术适应证仍是目前LDPPHR适应证,包括胰头部肿块型慢性胰腺炎或慢性胰腺炎合并胰头部胰管结石,胰头的良性肿瘤、交界性肿瘤等。
术前须通过肿瘤标志物、增强CT、增强MRI+MRCP排除恶性肿瘤可能,并结合三维重建排除十二指肠、胆总管及重要血管受侵,而对于非侵入性检查难以明确的患者可行超声内镜下组织穿刺活检。术中也应探查有无肿瘤的转移,对于可疑病灶及术中切缘均应行术中冷冻活检,而术中探及十二指肠后动脉弓、胆总管胰腺段、十二指肠受侵,即难以将胆总管、十二指肠与肿瘤分离或保障切除后胆总管和十二指肠血供时,应考虑扩大手术,改行PD。
SILDPPHR在微创、减轻术后疼痛方面优势明显,但因其“筷子”效应明显,器械操作角度小,故局限性也非常明显。为了充分利用其优点,规避其缺点,笔者于左肋缘下增加了一个额外的12 mm Trocar供主刀使用,即整体布局为:多通道单孔Trocar下部12 mm通道由持腹腔镜的扶镜手使用,多通道单孔左侧12 mm Trocar和左肋缘下12 mm Trocar由主刀医生使用,右侧12 mm通道由一助使用,这样主刀医生就不会改变手术习惯。单孔多通道中位于上方的器械孔与位于下方的腹腔镜孔构成的这种倒三角形的分布给了腹腔镜更多的观察空间。术中通过主刀和一助的反向牵引,暴露更广阔的手术视野,避免了“筷子”效应,而“+1”孔作为主操作孔,即为超声刀、电钩、持针器的主要通过孔,为主刀两器械营造了纯单孔无法达到的大夹角,这在腹腔镜下缝合、精细剥离等高难度操作中是极其重要的,明显降低了操作难度和学习曲线。同时因“单孔+1”通道相对狭窄,难以容纳过多器械,故要更合理、多样化地使用牵引、悬吊技术,诸如通过直针带线经剑突两侧穿刺的缝线法悬吊左肝、小儿红尿管悬吊游离后的胃等手段,微创而不占用术者的手与通道空间,达到更好的术区暴露。在既往单孔腹腔镜报道中,肝脏粘贴技术、真空型肝脏牵拉技术、硅胶盘牵拉技术等腹腔内牵拉技术,也为腹腔镜视野暴露困难提供了解决方案[21-23]。
合理运用“单孔+1”一大一小两切口亦是SILDPPHR+1的要点。采用脐周切口取出标本,无须像5孔LDPPHR那样再开额外的标本取出口;利用左肋缘下12 mm Trocar的孔道供2根引流管通过,为手术区提供引流,最大限度发挥切口作用。
保留胰十二指肠动脉弓的完整性是SILDPPHR+1成功与否的要点及难点。十二指肠的血供由胰十二指肠前、后动脉弓供应,胆总管胰腺段及十二指肠乳头的血供主要由胰十二指肠后动脉弓供应。故保护好胰十二指肠后动脉弓尤为重要,否则可能导致十二指肠缺血坏死、胆道狭窄等并发症。在操作理念方面应遵循5孔法LDPPHR,采用膜解剖路径保护行走于包膜内的血管弓。于胰头前壁打开包膜,沿包膜与胰腺组织间隙仔细分离,游离过程中离断走行向胰头内部的血管分支,保留包膜外组织、血管完整性。此方法可很好避免胆道与十二指肠缺血[24]。因单孔+1法的操作空间相对5孔法更小,故在相同操作下具有更大的暴露难度,为优化操作,术中较多的采用交叉牵拉暴露与重要管道的骨骼化悬吊牵引,如在肠系膜上静脉左侧离断胰颈后,主刀与一助交叉器械暴露术区,分别向右推开胰腺勾突和向左牵引肠系膜上静脉,再沿胰腺后包膜顺膜间隙解剖。
经典的Beger术式[8]会残留部分十二指肠内侧胰腺组织,以保证十二指肠、远端胆总管及Vater壶腹的血供,即保留十二指肠胰头部分切除术。该术式逐渐衍生Frey[25]术式、Berne[26]术式、Imaizumi[27]术式、Takada[28]术式等。其中Takada术式在真正意义上保留十二指肠血供的同时完整切除了胰头,从而降低了术后胰瘘发生率及切缘阳性的风险[29]。但其胆道和十二指肠并发症发生率相对较高,主要原因是壶腹周围十二指肠局部缺血、胆总管和十二指肠的热损伤,在其中一项DPPHR的远期随访中,胆道狭窄率高达13.6%[30]。运用前述技术保留胰十二指肠动脉弓后,对胆总管的保护是接下来的重点。
因胆总管下段深埋于胰腺组织内,故辨认其走形、防止误伤较为困难,而荧光成像可以用于胆总管导航和胆汁漏评估[15],术中经静脉注射20 mg ICG,使用荧光腹腔镜实时观察显象的胆总管为之保护提供了便利,Lu等[31]在LDPPHR的研究中显示ICG组胆汁漏发生率低于非ICG组(0vs.10%)。一些中心在胆总管内经十二指肠镜放入鼻胆管用于胆总管导航,但有报道[32]认为胆总管周围胰腺组织炎症水肿明显,胆总管辨认困难,不推荐术前常规在胆总管内放置鼻胆管。在避免操作中热损伤方面,对于与胆总管粘连较为紧致,难以分离的胰腺组织可以采用非能量器械锐性、钝性结合分离而非超声刀或电钩等能量器械。
根据胰腺吻合的部位,DPPHR重建方式多采用改良Blumgart胰肠吻合和胰胃吻合。我们在其中3例手术中尝试了胰胃吻合方式,因不需离断小肠,保证了消化道的连续性,胰腺和胃后壁位置邻近,胃壁较肠壁厚,吻合相对便捷,且胃壁血供丰富,利于吻合口愈合[33-34],胰胃吻合术后胰瘘、腹腔积液等方面低于胰肠吻合[35-36]。
荧光显影SILDPPHR+1是安全、可行且术后并发症少、恢复好的。但作为一项复杂的手术,术前仔细评估、术中的操作技术与技巧皆不可少。但由于这只是少数的病例,需要更多的前瞻性随机对照试验来真正确定SILDPPHR+1的效用或不足,建议可以在有丰富5孔DPPHR经验的中心展开进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:游欣雨,程东辉参与手术实施、数据收集分析、文章撰写;蒋佶朋,左邦佑,郝建杰,刘涛负责临床相关工作、资料整理、论文撰写;张宇负责制定手术方案、实施手术、论文修订。

