胰腺肝样腺癌腹腔多发转移1例报告并文献复习
李春梅,李春满,唐继红,何敏,白宇凡,朱加啟
(昆明医科大学第二附属医院 肝胆胰外科,云南 昆明 650000)
肝样腺癌(hepatoid adenocarcinoma,HAC)是一种罕见的具有肝细胞癌(hepatocellular carcinoma,HCC)样分化特征的原发性的上皮源性的特殊类型腺癌,其发病率仅为0.014/10万[1],恶性程度高,侵袭性强,预后差。HAC临床表现缺乏特异性,术前检查无典型表现,可表达HCC特征性指标甲胎蛋白(alpha fetal protein,AFP),其阳性率可高达84.8%[2]。病理结果是诊断金标准。本文报告1例胰腺肝样腺癌(pancreatic hepatoid adenocarcinoma,PHC)并腹腔多发转移病例的临床诊治过程,并对相关文献进行复习,旨在增加临床医生对该疾病的认识。
1 病例资料
患者 男,63岁,因“乏力、纳差,进行性腹胀3个月”入院。既往体健,无其他基础疾病,吸烟、饮酒史30年。专科查体:贫血貌,左上腹膨隆,可触及直径约10 cm包块,边界不清,局部压痛,无反跳痛及肌紧张,余未见异常。影像学检查:3个月前外院MRI平扫+MRCP:胰腺体尾部、脾脏、胃底、胃体、肝脏S6、S7段多发占位。入院后肝胆胰MRI平扫+增强+MRCP:肝右后叶巨大团块,边界清楚,大小约7.01 cm×9.30 cm×10.65 cm,增强扫描动态早期轻度强化,门静脉期及延迟期持续轻度强化,包膜后期明显强化;胰尾及脾脏分界不清并见巨大团块大小约8.04 cm×10.46 cm×11.43 cm,动态增强呈轻度强化;病变与胃底分界不清,腹腔内多发淋巴结肿大。考虑胰腺尾部恶性肿瘤侵犯胃底部大弯侧,肝、脾转移。中下腹CT平扫+增强:肝右叶见混杂等及低密度影肿块,大小同上,增强后呈快进快出征象,考虑原发性肝癌,转移不能排外;胰腺尾部、脾脏及胃底区软组织密度肿块,边界不清,增强后呈轻-中度强化,考虑胰腺或胃来源;腹膜后稍大淋巴结;脾动脉受侵,管腔不规则断续,脾静脉受侵闭塞,肝静脉右支受侵可能(图1)。胸部CT示肺上未见明显转移灶,其余术前心、肺功能检查未见明显异常。实验室检查:红细胞(RBC)3.61×1012/L,血红蛋白(HGB)68 g/L,红细胞压积(HCT)0.251 L/L,红细胞平均体积(MCV)69.5 fL,RBC平均含量(MCH)18.8 pg为慢性失血引起的小细胞低色素性重度贫血。丙氨酸氨基转移酶(ALT)13 U/L,天冬氨酸氨基转移酶(AST)26 U/L,谷氨酰基转移酶(GGT)74 U/L,胆碱酯酶(CHE)4 582 U/L,乳酸脱氢酶(LDH)796 U/L,AFP>1 000.00 ng/mL,糖类抗原CA-125、CA-50、CA19-9均在正常范围内,其余血常规、生化、凝血未见明显异常。术前诊断为:腹腔脏器多发占位性病变。择期行剖腹探查术,术中见:肝脏颜色、质地可,右肝见5.0 cm×4.5 cm×9.0 cm占位,质硬,活动性差;小网膜囊内可触及肿块,肿瘤位于胰腺体尾部呈囊实性,大小约9.0 cm×10.0 cm×11.0 cm,边界不清,脾脏呈浅白色,与胃后壁粘连严重,波及胃体部,周围未触及肿大淋巴结(图2)。考虑患者术前肝肾功能、心肺检查无明显异常,主要因乏力、纳差、腹胀等症状就诊,病变波及胃,出现慢性失血性贫血,如将病灶切除可改善患者症状,同时行改道手术可使胃肠道保持通畅,改善患者后期生存质量,且患者术前手术意愿强烈,探查后决定行胰体尾切除+脾切除+右半肝切除+胆囊切除+胃大部切除+胃肠吻合+腹腔淋巴结清扫术的姑息性减瘤手术,尽可能切除病灶。术后病检结果:肝组织:考虑PHC转移,实性型,组织学分级3级;免疫组化CK8(+),CK18(+),CD34(血管+),glypican-3(+),Ki-67(约40%),Hep Par-1(-);银染(+)(图3)。胰腺组织:恶性肿瘤,同肝组织病检结果;免疫组化:CK低(+),Ki-67(约40%),villin(+),glypican-3(部分+);银染(+)(图4)。胃、脾组织诊断同上,胃壁见肿瘤侵犯,周围脂肪组织见多个肿瘤结节,局部见脉管内癌栓;脾脏内肿瘤侵犯,淋巴结1枚见肿瘤侵犯浸润/转移(1/1)。其余1、2、11、19组淋巴结均未见癌转移。术后予抗感染、营养支持、保肝、抑酸护胃等对症处理,于术后第43天出院。
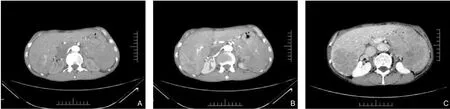
图1 术前腹部CT A:肝脏占位,增强后呈“快进快出”征象;B-C:胰腺尾部、脾脏及胃底区软组织密度肿块,边界不清,增强后呈轻-中度强化Figure 1 Preoperative abdominal CT A: Space occupying lesion of the liver showing a "wash-in/wash-out" pattern after contrast enhancement; B-C: A soft tissue density masses in the tail of the pancreas,spleen,and gastric fundus area with illdefined borders,showing mild to moderate enhancement after contrast

图3 肝组织病理检查 A:手术大体标本形态;B:HE染色示癌细胞不规则呈多边形或立方形,胞质丰富,嗜酸性;核仁明显,居中,大而不规则,核分裂象易见(×200);C:银染阳性(×200)Figure 3 Liver tissue pathological examination A: Appearance of the surgical specimen; B: HE staining showing irregularly shaped cancer cells with abundant eosinophilic cytoplasm,prominent,centrally located,large,and irregularly shaped nuclei,and frequent mitotic figures (×200); C: Positive silver staining (×200)
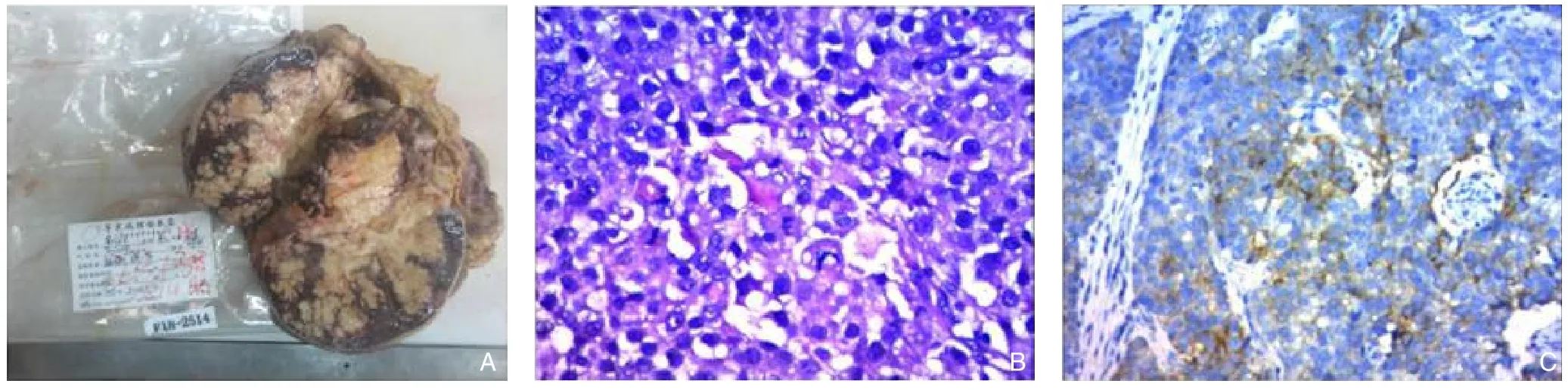
图4 胰腺组织病理检查 A:手术大体标本,胰尾部肿瘤侵犯周围脾脏及胃;B:HE染色示癌细胞不规则呈多边形,胞质丰富,嗜酸性,核仁明显,居中,大而不规则(×200);C:银染阳性(×200)Figure 4 Pancreatic tissue pathological examination A: Gross surgical specimen showing tumor in the pancreatic tail invading into the surrounding spleen and stomach; B: HE staining revealing irregularly shaped cancer cells with abundant eosinophilic cytoplasm,eosinophilic staining,prominent,centrally located,large,and irregularly shaped nuclei (×200); C:Positive silver staining (×200)
术后1个月复查腹部CT见术后改变,肝右前叶及左内叶多发结节状强化,肿瘤标志物均恢复正常,其中AFP 8.12 ng/mL;术后2个月复查腹部CT提示腹膜后多发稍大淋巴结,肝右前叶小结节灶考虑转移灶,于术后改变。胸部CT见肺部多发小结节影,考虑为转移灶;肿瘤标志物指标正常,AFP 4.67 ng/mL;胰腺、脾、胃未见可疑肿瘤复发;术后3个月AFP 7.38 ng/mL,肝右叶小结节灶考虑转移灶,予行肝动脉灌注化疗及栓塞治疗,注入奥沙利铂130 mg+氟尿嘧啶200 mg。术后4个月自服“伊维莫司”治疗10余天出现口腔溃疡伴双下肢水肿后停药。术后7个月复查CT提示肝内多发环形强化灶,双肺多发小结节影,较前增多,考虑为转移灶;肿瘤标志物AFP升高至210.54 ng/mL(图5)。术后10个月患者出现肝功能衰竭、大量腹水、胸腔积液、恶病质状态,于家中死亡。

图5 术后CT A:术后2个月(腹膜后多发肿大淋巴结);B-C:术后7个月(双肺多发小结节影;肝内多发环形强化灶)Figure 5 Postoperative CT A: Two months after operation (multiple retroperitoneal enlarged lymph nodes); B-C: Seven months after operation (multiple small nodular shadows in both lungs; multiple annular enhancing lesions in the liver)
2 讨 论
HAC是一种肝外组织出现的具有HCC样分化的原发性恶性肿瘤,癌细胞可表达HCC特征性指标AFP及其他免疫组化指标,可发生于消化、泌尿、呼吸及生殖等多个系统,既往认为胃和卵巢最为多见[3],而Wang等[1]发现最常见原部位为肺占49.6%,且以右肺更常见,其次为消化系统占41.9%,其中胰腺占9.9%。张晓杰等[4]对139例HAC的研究中,消化道占39.6%,仅次于肺部的41.7%。PHC指原发于胰腺的HAC,目前所知所国内外病例39例[5-6],因病例数较少,其发病机制尚不明确,各学界主要提出三种学说:异位肝组织学说、转分化学说及干细胞学说[7]。异位肝组织学说认为肿瘤发生于胰腺上存在的异位肝脏组织[8];转分化学说认为胰腺细胞向肝脏细胞发生转分化,而肿瘤出现在转分化的肝细胞中[9];干细胞学说认为与肝脏同源的胰腺组织在致癌因素作用下出现癌变,但因为分化障碍,即向肝细胞分化[10]。世界卫生组织将PHC分类为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的一种可能变异体。Mattiolo等[11]研究则发现PHC与PDAC之间只存在一个致病性的体细胞突变,故主张PHC是实性假乳头状瘤(solid pseudopapillary neoplasm,SPN)的新变体。
同其他多数恶性肿瘤一样,PHC早期缺乏特征性临床表现,诊断时常已出现肝转移及远处转移[6]。约一半的患者因体检发现占位性病变就诊,部分患者可因腹痛、腰背痛、腹胀、乏力、食欲减退、体质量下降等就诊,发生于胰头部的PHC患者可因压迫胆管而出现进行性黄疸加重而就诊。同样,PHC的影像学检查缺乏特异性,原发病灶无特异表现,且常发生淋巴道转移和远处转移,尤其极易发生肝转移,这与早期形成广泛血窦利于转移和产生的AFP的免疫抑制性相关。而肝脏可能是产AFP的肿瘤的癌细胞靶器官,肿瘤细胞对其有亲和性,为肿瘤细胞提供适宜的生长环境[12],研究[5]显示AFP低水平可能提示患者具有良好预后。王康韬等[13]发现AFP>500 ng/mL是胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS)患者死亡的危险因素,这可能与AFP的免疫抑制功能相关。如果出现肝转移,肝转移病灶与HCC的影像学表现极为相似,在CT上通常为多结节状,大部分可表现为“快进快出”[14],常可在直径<1 cm的结节内见肿瘤中心型坏死,而在HCC中常发生在直径>3 cm的肿瘤灶内[15],可以此与HCC的中心坏死灶鉴别。Lin等[16]的研究也指出孤立的门静脉癌栓合并肿瘤性坏死高度提示HAC肝转移。Bazeries等[17]认为HAC肝转移同其他恶性肿瘤一样会引起邻近肝包膜的凹陷。因为HAC部分可表达AFP,如患者检查提示胰腺占位性病变,同时存在AFP阳性,检查排外肝脏原发性肿瘤,可考虑PHC。36%~60%的PHC患者出现血清AFP升高[7],王瀚等[5]对37例PHC分析AFP阳性率仅为51.4%,Zeng等[18]对39例文献复习AFP阳性率仅为46.15%。PHC最终需要通过组织病理学特征明确诊断,光镜下可见肝样分化区,类似于HCC。癌细胞不规则呈多边形或立方形,胞质丰富,嗜酸性;核仁明显,居中,大而不规则,核分裂象易见;癌细胞呈小梁样、实性巢状、岛状或花环状排列;间质血供丰富[18];病灶可为单一或混合成分,如合并其他腺癌常相互移行、交替排列,且普通腺癌区常位于原发灶的表面。免疫组化方面,HAC主要表达HCC标志物:AFP、肝细胞抗原(Hep Par-1)、glypican-3、精氨酸酶1。其阳性率分别为51.4%~67%、75.7%~96%、18.9%~78%、8.1%~75%,以Hep Par-1敏感度最高[6-7,19];在上皮标志物中,大部分HAC高表达AE1/AE3、CK18、CK19;人类婆罗双树样基因4(spalt like protein 4,SALL4)是HAS的特征性标志物,但在PHC中表达率明显低于HAS[20],可能因SALL4与胎肠化生相关,故对HAS更敏感。在病理上PHC需与胰腺转移性HCC及胰腺嗜酸细胞肿瘤相鉴别。娄可心等[21]对8例肝脏转移性消化道HAC患者进行分析发现:原发部位肿瘤组织由肝样分化区构成,伴或不伴普通腺癌成分,肝样分化区组织学特点似典型HCC。而肝脏转移灶组织学形态以肝样分化为主,与HCC难以鉴别,转移灶与原发灶相比以HAC分化成分为主,存在更多坏死灶;在免疫表型上,原发灶与转移灶肝样分化区域不同程度表达HCC的标志物如glypican-3、AFP、SALL4和Hep Par-1;同时也表达消化道腺癌的标志物,如细胞角蛋白CK19、CDX-2和villin等。而其与胰腺嗜酸细胞肿瘤相比,后者肉眼上为褐色,容易鉴别,细胞胞浆具有丰富的嗜酸性颗粒,为增生、肿胀或透明变的腺粒体,故又称为腺粒体瘤[22]。在病检中发现PHC可同时合并有其他肿瘤成分,其中以神经内分泌瘤(pancreatic neuroendocrine neoplasm,PNET)最多见[3]。
目前,无针对HAC治疗的相关指南,对于早期患者首选手术根治性切除,可降低其死亡风险[13],但是许多患者出现症状就诊时肿瘤已进展至中晚期,常伴有肝、肺等器官转移和淋巴结转移,从而丧失根治性手术机会。对于此类患者可采取辅助治疗或姑息性手术治疗后再行辅助治疗。本例患者经评估后为改善其慢性出血所导致的贫血及乏力、腹胀的情况行姑息性减瘤手术辅予介入治疗,术后患者贫血改善,腹胀症状消失,获得10个月的生存期。在相关文献报道中辅助治疗方案各异,可以针对HAC组织学特征采取肝癌相关治疗方案,亦可根据原发病灶相关治疗方案用药。目前,化疗被认为是影响HAC的独立预后因素,其中以5-FU为基础的化疗被认为对HAS有效[7]。对于存在远处转移的HAC,Simmet等[23]则认为以顺铂为基础的化疗方案更有效,缓解率达75%(9/12),可能可以有效诱导抑制肿瘤生长。而基于消化道肿瘤的常规化疗方案,如伊立替康、奥沙利铂、吉西他滨或5-FU等对其无效。还有研究[1]显示,HAC可能是一种具有辐射抗性的肿瘤,是否接受放疗对生存期影响无显著差异。目前无针对PHC的靶向和免疫治疗研究,Zhu等[24]绘制了HAS的分子特征,发现MUC19过表达能够上调胃癌细胞中的AFP水平同时促进瘤体生长,首次提出MUC19可能是HAS的潜在治疗靶点,为HAS的精准诊断及个体化治疗提供了新的治疗思路。相关研究[25]显示PD-1抑制剂中帕博利珠单抗联合贝伐单抗联合化疗是一种安全有效的HAS治疗方案,也有相关病例在经过化学治疗无效后采用信迪利单抗治疗11个周期后取得满意效果[26]。Li等[27]探究了免疫检查点抑制剂联合化疗对血清AFP升高晚期胃癌和HAS的影响发现免疫检查点抑制剂联合化疗对其有效。既往认为HAC的侵袭性强,预后差,而在PHC的37例病例回顾中该病的1、5年总生存率分别为73.9%、38.0%[5],其预后较胰腺癌(37.8%、10.5%)好却更接近于HCC,这与肿瘤细胞肝样分化的细胞学基础相关。目前认为年龄、远处转移、晚期T期、原发部位手术和化疗是独立的预后因素。
本研究中,患者发现时病灶已发生腹腔脏器的多发转移,从术前诊断上看,对胰腺与肝脏病变同时存在的情况,需鉴别胰腺原发性肿瘤多发转移与肝脏原发性肿瘤多发转移。我国84%的HCC发生于有肝炎背景的肝脏[28],该患者无肝炎病毒感染史,且HCC的转移最早、最常见于肝内转移,其次发生血道及淋巴道转移,常见于肺部转移。而胰腺癌多为原发性,胰腺转移癌少见,约占胰腺所有恶性肿瘤的2%[29],且同时存在脾脏、胃部的转移更罕见。相反,从HAC的生物学角度分析,其可发生于消化道,且易发生肝转移,因此对于该患者的诊断更偏向于PHC的多发转移,而最终需靠术后病理确诊。从治疗角度分析,该患者已发生腹腔脏器的转移,从肿瘤分期上看属于Ⅳ期,对于此类患者全身系统性治疗和手术切除的选择有待思考。王康韬等[13]针对HAS的治疗分析中指出,姑息性手术或未手术相对于根治性手术为HAS预后的独立危险因素。对于有手术切除机会的患者,手术治疗是改善预后的保护因素,本例患者行姑息性手术达到减瘤目的,术后AFP降至正常,术前症状消失,患者获得10个月的生存期。但对于此类患者还需考虑手术创伤大,术后机体免疫功能减退可能促进残余病灶播散的风险,且同时切除腹腔多个脏器等对患者的生活质量产生了影响。在文献报道中以顺铂为基础的全身系统性化疗对发生远处转移的PHC客观缓解率较高,但基于消化道肿瘤的常规化疗方案对其效果不佳。因此对于术前诊断不明确且丧失根治性手术机会的患者,穿刺活组织检查明确诊断对于其治疗有指导意义。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:李春梅负责病例资料收集、相关文献收集及撰写文章;李春满负责手术操作、提供图片及文章修改;何敏、朱加啟、白宇凡负责文献收集及文章修改;唐继红负责病例资料收集、文章修改。

