CD36对肥厚型心肌病小鼠内皮细胞增殖的影响及其机制探讨
田宏伟 马丽娜 王晓红 谢洋 杨茜 吴燕 马小虎 魏述军 席少静 乔树宾 葛利军
目的:探讨CD36对肥厚型心肌病(HCM) 小鼠内皮细胞增殖的影响及其机制。
方法:采用3只心肌肌钙蛋白T(cTNT)R92Q转基因小鼠作为实验对象(cTNTR92Q组)。3只野生型C57BL/6小鼠作为对照组。检测cTNTR92Q组小鼠心肌组织CD36表达,并以cTNTR92Q转基因小鼠主动脉内皮细胞和人脐静脉内皮细胞(HUVEC)为载体调控CD36表达,探讨CD36对HCM小鼠内皮细胞增殖的影响及其机制。
结果:cTNTR92Q组小鼠心肌组织中CD36 mRNA和蛋白表达水平均高于对照组,微血管密度低于对照组(P均<0.05)。cTNTR92Q组小鼠主动脉内皮细胞CD36 和p21蛋白表达水平均高于对照组(P均<0.05);增殖细胞核抗原(PCNA)、细胞周期蛋白D1(cyclin D1)蛋白表达水平均低于对照组,主动脉内皮细胞增殖低于对照组(P均<0.05)。SiRNA-CD36抑制CD36后,PCNA、cyclin D1蛋白表达水平均升高,HUVEC增殖显著增加(P均<0.05)。进一步研究发现,CD36 增加p38Thr180/Tyr182 和c-Jun氨基末端激酶(JNK)Thr183/Tyr185 磷酸化水平,激活p38丝裂原活化蛋白激酶(MAPK)/JNK信号通路并抑制HUVEC增殖,p38 MAPK特异性抑制剂SB239063和JNK特异性抑制剂SP600125能够逆转上述作用(P均<0.05)。
结论:CD36通过激活p38 MAPK/JNK信号通路抑制HUVEC增殖,下调CD36表达能够促进内皮细胞增殖。
肥厚型心肌病(HCM)是最常见的遗传性心肌病之一,成人患病率约为0.2%,主要表现为非对称性室壁肥厚和流出道梗阻,是年轻患者心原性猝死的常见原因[1-2]。冠状动脉正常的HCM患者也会出现胸痛、呼吸困难和心律失常等可能与心肌缺血相关的症状[3]。通过正电子发射断层扫描(PET)发现,HCM心内膜灌注下降、冠状动脉血流储备减少[4-5];病理检测发现,HCM的心肌微小动脉平滑肌细胞增生,管腔显著狭窄[6];另有研究发现,HCM心肌微血管密度显著下降,心肌纤维化显著增加,并且微血管密度与心肌纤维化程度呈负相关[7-8]。以上研究均提示,HCM心肌处于低灌注缺血状态,而心肌缺血是HCM发展为心力衰竭的危险因素,也是恶性心律失常和死亡风险增加的重要原因[9-10]。CD36是一种跨膜蛋白,属于B类清道夫受体,可与膜表面的其他跨膜蛋白结合共同介导配体结合和信号转导[11],CD36广泛表达于心肌微血管内皮细胞表面,对调节内皮细胞功能起关键作用[12]。 肿瘤微血管内皮中CD36与血小板反应蛋白-1(TSP-1)结合,介导肿瘤血管内皮细胞凋亡[13]。目前尚不清楚CD36是否影响内皮细胞增殖。在HCM中,调控CD36表达水平能否影响心肌微血管增生、改善心肌缺血也鲜有研究。本研究以心肌肌钙蛋白T(cTNT)R92Q转基因小鼠为研究对象,该转基因小鼠具有室壁肥厚、心腔缩小、心肌细胞肥厚、排列紊乱、心肌纤维化、心肌舒张功能减退等特点,是研究HCM的理想动物模型[14]。本研究拟在动物组织、细胞及分子学层面探讨CD36对HCM内皮细胞增殖的影响及其机制。
1 材料与方法
1.1 材料
实验动物与分组:2021年10月至2022年10月,本研究采用3只cTNTR92Q转基因小鼠作为实验对象,为cTNTR92Q组。该小鼠由中国科学院实验动物研究所卫生健康委员会人类疾病医学重点实验室研究培育(已有商品出售),该转基因小鼠是研究HCM的理想动物模型。3只野生型C57BL/6小鼠购买于上海维通利华实验动物有限公司,作为对照组。调控人脐静脉内皮细胞(HUVEC)CD36基因表达时,将HUVEC分为CD36过表达组、过表达阴性对照组、小干扰RNA(siRNA)阴性对照组(si-NC组)、siRNA靶向沉默CD36基因组(si-CD36组)和未转染组;在研究CD36抑制HUVEC增殖的信号通路时,将HUVEC分为CD36过表达组、CD36过表达+ p38丝裂原活化蛋白激酶(MAPK)特异性抑制剂(SB239063)组、CD36过表达 + c-Jun氨基末端激酶(JNK)特异性抑制剂(SP600125)组和未转染组。本研究通过宁夏回族自治区人民医院伦理委员会审批(批号:2020-KY-104)。
试剂和抗体:CD105(货号:DF7431,Affinity公司,美国);辣根过氧化酶(HRP)标记山羊抗兔IgG(货号:#31460,ThermoFisher公司,美国);CD36抗体,(货号:sc-7309,Santa cruz公司,美国);细胞周期蛋白D1(cyclin D1)抗体(货号:WL01435a,万类生物公司,沈阳);增殖细胞核抗原(PCNA)抗体,(货号:WL03213,万类生物公司,沈阳);P21抗体(货号:AF6290,Affinity公司,美国);磷酸化-p38(p-p38)抗体(货号:WLP1576,万类生物公司,沈阳);p38抗体(货号:WL00764,万类生物公司,沈阳);磷酸化-JNK(p-JNK)抗体(货号:WL01813,万类生物公司,沈阳);JNK抗体(货号:WL01295,万类生物公司,沈阳)。
仪器:电泳仪(型号:DYY-7C,北京六一公司,中国);荧光定量PCR仪(型号:Exicycler 96,BIONEER公司,韩国);流式细胞仪(型号:NovoCyte,Aceabio公司,美国);酶标仪(型号:ELX-800,BIOTEK公司,美国);显微镜(型号:BX53,OLYMPUS公司,日本);显微镜拍照系统(型号:DP73,OLYMPUS公司,日本)。
1.2 实时荧光定量PCR(qRT-PCR)
收集各组心肌组织及内皮细胞(实验用HUVEC)来源于宁夏回族自治区人民医院中心实验室液氮罐冻存),使用TRIzol试剂从细胞和组织中提取总RNA,使用反转录试剂盒对RNA进行反转录,合成cDNA。以β-肌动蛋白(β-actin)为内参,并以cDNA为模板,qRT-PCR检测,反应条件设为:95℃ 3 min,随后 95℃ 30 s、退火 58℃ 30 s、延伸 72℃ 20 s,循环 40 次。获取 Ct 值,采用 2-ΔΔCt法计算各组细胞中mRNA 的相对表达量[15]。用于qRT-PCR的引物序列见表1。
1.3 蛋白免疫印迹(Western Blot)法分析
每孔加入500 μl含蛋白酶和磷酸酶抑制剂的细胞裂解液。用BCA蛋白试剂盒定量总蛋白浓度后,加入相同浓度的二硫苏糖醇缓冲液,煮沸5 min。十二烷基硫酸钠(SDS) -聚丙烯酰胺凝胶电泳测定相同蛋白浓度的样品。然后将完整的凝胶电印迹到Immobilon-P膜上。膜在含5%牛血清白蛋白(BSA)的含吐温-20的磷酸盐缓冲溶液(PBST)中孵育2 h,然后在含1% BSA的磷酸盐缓冲溶液(PBS)中与一抗孵育过夜。最后,用二抗(1:3000)在含1% BSA的PBS中孵育30 min后,用化学发光法检测增强的绿色荧光蛋白条带。用Western Blot法对处理后的细胞进行相似的评价。
1.4 基因沉默
将复苏后的HUVEC置于含10%胎牛血清的RPMI 1640 培养基中,培养于37℃、5%二氧化碳(CO2)恒温培养箱。待细胞生长至对数期时,用胰酶消化并制成单细胞悬液,接种于96孔细胞培养板,均设置3个副孔。第3~6代细胞用于正式实验,将5 μl Lipofectamine RNAiMAX试剂 (赛默飞世尔公司,美国)与500 μl Opti-MEM减血清培养基 (赛默飞世尔公司, 美国)混合,并与25 pmol siRNA (吉玛基因公司, 中国)结合转染至细胞中,转染后6 h更换为完全培养基继续培养48 h,收集细胞用于Western Blot法分析。
1.5 免疫组织化学(IHC)染色
心肌组织切片在PBS中清洗,在预冷的丙酮中固定15 min,清洗3次。然后将组织在0.5%Tritonx-100中渗透10 min并清洗。用3% H2O2灭活内源性过氧化物酶,然后用山羊血清阻断。细胞在4℃下与一抗孵育过夜,PBS清洗后用二抗孵育45 min,使用二氨基联苯胺试剂盒进行细胞化学反应,用苏木素反染色。
1.6 溴脱氧尿苷(BrdU)染色
在无菌条件下,向每个样本中加入10 μmol/L BrdU,经过培养后收集细胞悬浮,加入2 ml染色缓冲液,室温300~400 ×g离心5 min,弃上清;向每1 ml的细胞中加入1 µl 可固定的死活细胞鉴定染料,在4℃下避光孵育30 min,用染色缓冲液清洗细胞2次,将细胞重悬后加入荧光一抗,在4℃下避光孵育30 min,染色缓冲液洗涤细胞后加入1 ml新鲜BrdU 染色缓冲液,在室温下避光孵育15 min,用染色缓冲液清洗细胞后向每个样本中加入 100 µl 脱氧核糖核酸酶 I(DNase I)工作溶液,在37℃下避光孵育1 h,染色缓冲液清洗细胞后,加入 5 µl抗BrdU荧光抗体,混匀,在室温下避光孵育30 min后进行流式细胞仪检测。
1.7 统计学方法
采用SPSS 21.0统计软件分析数据。计量资料以均数 ±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,并采用LSD-t方法进行多组间两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠心肌组织微血管密度比较(图1)
用CD105标记微血管采用IHC染色结果显示,cTNTR92Q组小鼠心肌组织中微血管密度较对照组小鼠明显下降;马松染色(Masson染色)显示,cTNTR92Q组小鼠心肌组织纤维化程度明显高于对照组小鼠。
2.2 两组小鼠心肌组织CD36 mRNA和CD36蛋白表达水平比较(图2)
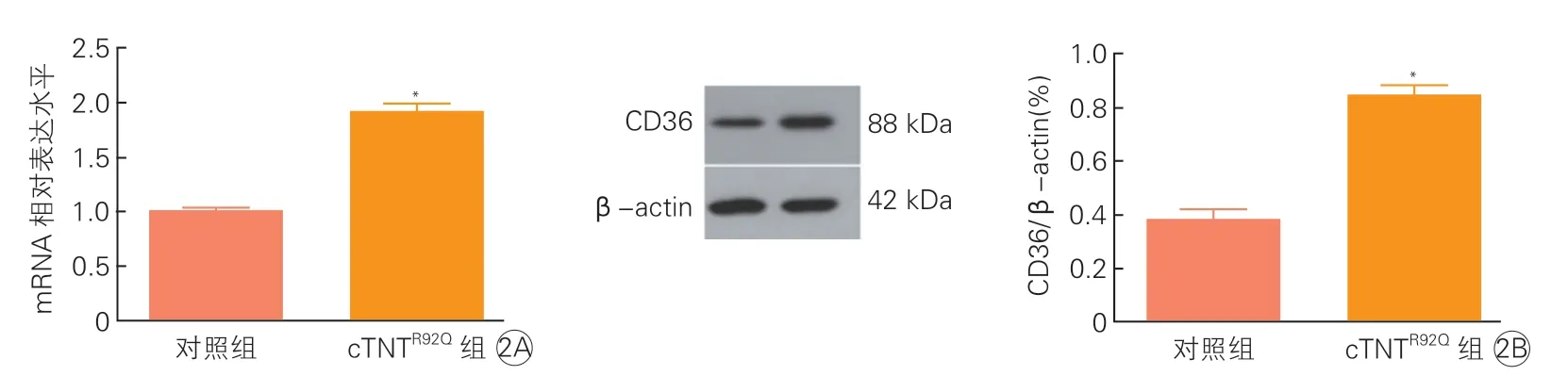
图2 两组小鼠心肌组织CD36 mRNA和CD36蛋白表达水平比较(x±s, n=3)
qRT-PCR和Western Blot法检测发现,cTNTR92Q组小鼠心肌组织CD36 mRNA和CD36蛋白表达水平均明显高于对照组(P均<0.05)。
2.3 两组小鼠主动脉内皮细胞CD36、PCNA、cyclin D1、p21表达水平和主动脉内皮细胞增殖情况比较(图3)
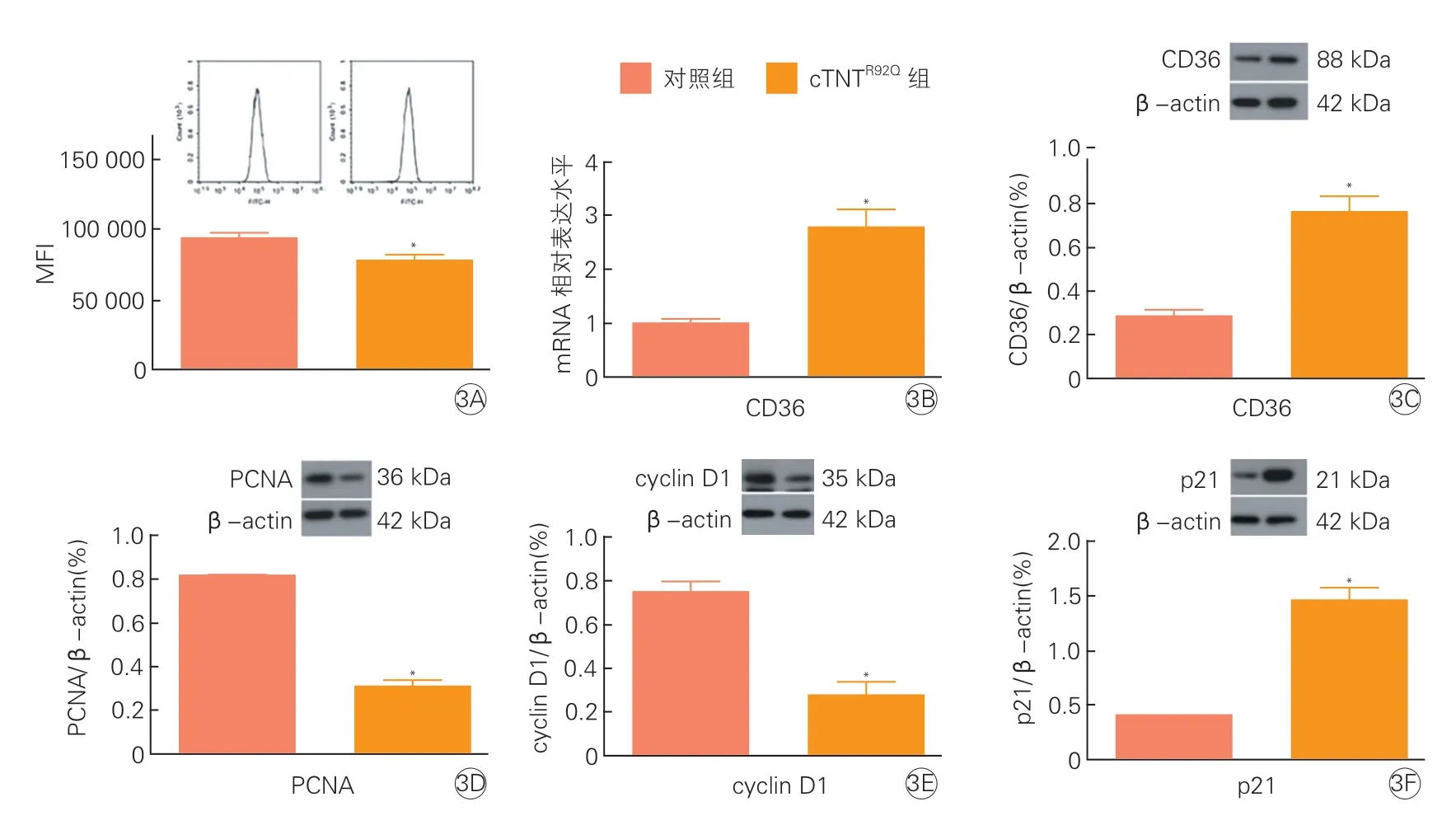
图3 两组小鼠主动脉内皮细胞CD36、PCNA、cyclin D1、p21表达水平和主动脉内皮细胞增殖情况的比较(x±s, n=3)
BrdU染色和Western Blot法分析表明,cTNTR92Q组小鼠内皮细胞增殖减少,cTNTR92Q组小鼠内皮细胞CD36 mRNA和CD36蛋白表达水平均高于对照组(P均<0.05),PCNA、cyclin D1蛋白表达水平均低于对照组(P均<0.05),p21蛋白表达水平高于对照组(P<0.05)。
2.4 调控HUVEC CD36基因后,CD36、PCNA、cyclin D1和p21表达水平和HUVEC增殖情况(图4)
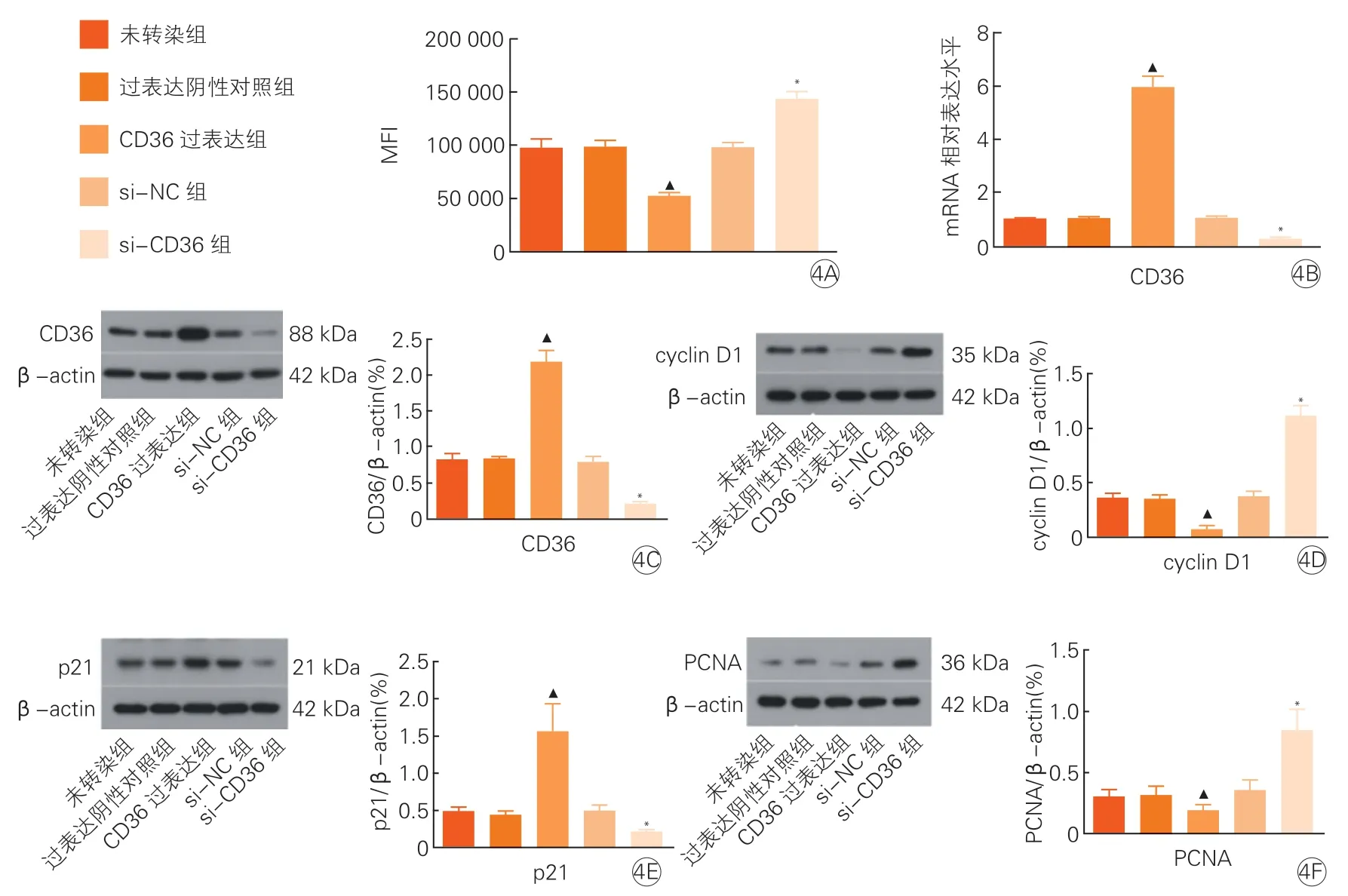
图4 调控HUVEC CD36基因后,CD36、PCNA、cyclin D1和p21表达水平和HUVEC增殖情况比较(x±s, n=3)
HUVEC增殖增加。将CD36靶向siRNA(siRNA-CD36)转染至HUVEC降低CD36 mRNA和CD36蛋白表达水平,Western Blot法分析发现,下调CD36表达后,cyclin D1和PCNA蛋白表达水平升高,p21蛋白表达水平降低。
2.5 HUVEC过表达CD36后,p-p38Thr180/Tyr182、p-JNKThr183/Tyr185、p38、JNK表达水平和HUVEC增殖情况的比较(图5)
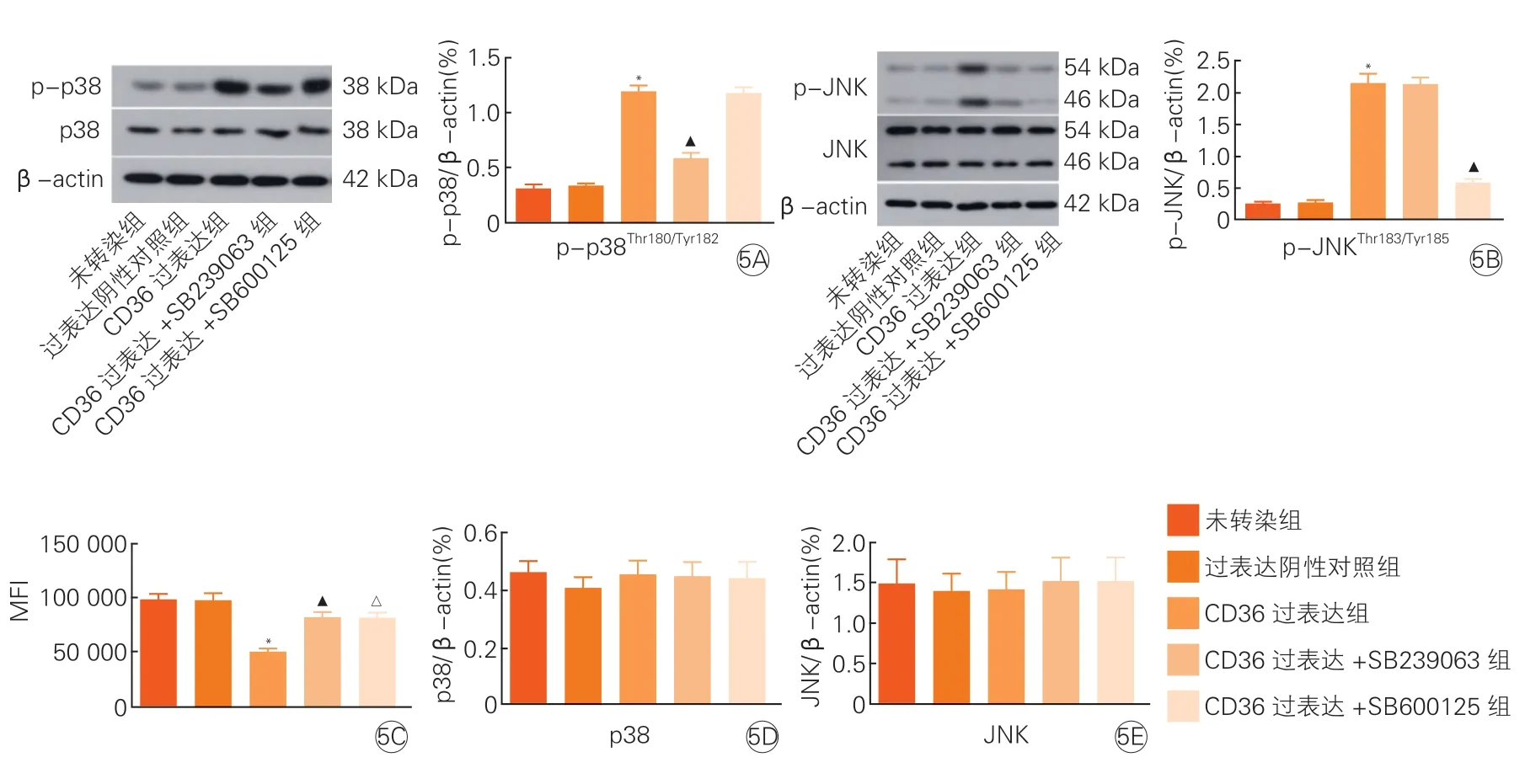
图5 HUVEC过表达CD36后,p-p38Thr180/Tyr182、p38、p-JNKThr183/Tyr185、JNK表达水平和HUVEC增殖情况的比较(x±s, n=3)
HUVEC转染CD36基因上调CD36表达后结果发现,与未转染组比较,CD 36过表达组的p-p38Thr180/Tyr182、p-JNKThr183/Tyr185蛋白表达水平增加,HUVEC增殖降低(P均<0.05),而p38与JNK蛋白表达水平差异无统计学意义(P>0.05)。与CD36过表达组比较,CD36过表达组+ SB239063组、CD36过表达组 + SP600125组的p-p38Thr180/Tyr182、p-JNKThr183/Tyr185蛋白表达水平均降低,HUVEC增殖升高(P均<0.05)。
3 讨论
有研究表明,即使冠状动脉正常的HCM也会出现心肌灌注下降、冠状动脉血流储备减少等心肌缺血现象[4-5],而心肌缺血是HCM进展为心力衰竭、发生恶性心律失常和心原性猝死的危险因素[9-10]。CD36广泛表达于心肌微血管内皮细胞表面,在调节内皮细胞功能和增殖方面起关键作用。本研究发现,CD36 增加p38Thr180/Tyr182和JNKThr183/Tyr185磷酸化水平,激活p38 MAPK/JNK信号通路并抑制HUVEC增殖,下调CD36表达促进内皮细胞增殖可能是治疗HCM心肌缺血的潜在靶点。
本研究发现,cTNTR92Q转基因小鼠心肌微血管密度显著降低,心肌纤维化程度加重,这一结果与人HCM关于心肌微血管密度和心肌纤维化的研究结论一致[7]。研究还发现,cTNTR92Q转基因小鼠心肌中CD36 mRNA和CD36蛋白的表达水平均明显高于对照组,提示CD36表达水平可能与HCM血管生成有关。p21蛋白是一种细胞周期蛋白(cyclin)依赖性激酶抑制蛋白(CDKI),具有多种生物学功能。p21可降解cyclin、抑制细胞周期蛋白依赖性激酶(CDK)活性,与PCNA结合抑制细胞复制[16]。PCNA存在于细胞核中,是DNA聚合酶δ的辅助蛋白,其浓度在细胞复制周期中发生周期性变化,可作为细胞增殖状态的指标[17]。Cyclin D1通过结合并激活CDK4促进细胞增殖[18]。本研究发现,cTNTR92Q转基因小鼠主动脉内皮细胞p21蛋白表达水平高于对照组,PCNA和cyclin D1蛋白表达水平低于对照组,BrdU染色和流式细胞术显示,cTNTR92Q转基因小鼠内皮细胞增殖较对照组降低。上述结果表明,cTNTR92Q转基因小鼠心肌和主动脉血管内皮细胞中高表达的CD36可能影响HCM血管生成。为了研究CD36对内皮细胞增殖的影响,我们对HUVEC转染siRNA-CD36或CD36基因调节CD36的表达。研究发现,siRNA-CD36下调CD36表达后HUVEC p21蛋白水平降低,cyclin D1和PCNA蛋白水平升高,HUVEC增殖增加,对HUVEC转染CD36过表达CD36后得到相反的结果。这些研究表明,CD36能够抑制内皮细胞增殖。用siRNA-CD36下调CD36后,内皮细胞增殖显著增加。Osz等[19]研究发现,CD36基因敲除小鼠血管生成增加;Ramakrishnan等[20]研究发现,细胞外囊泡激活CD36能够抑制内皮细胞的迁移和血管管腔的形成,以上研究均与本研究结果类似。过表达CD36 抑制 HUVEC增殖的机制可能是多因素的,本研究结果发现,增加HUVEC CD36表达后,p-p38Thr180/Tyr182和p-JNKThr183/Tyr185蛋白表达增加,HUVEC增殖降低,p38 MAPK特异性抑制剂SB239063和JNK特异性抑制剂SP600125能够逆转上述作用,说明CD36通过增加p38Thr180/Tyr182和JNKThr183/Tyr185磷酸化水平激活p38MAPK/JNK信号通路抑制HUVEC增殖,这一结论与CD36介导MAPK信号通路抑制肿瘤血管增生机制类似[21]。
本研究的局限性在于以HUVEC作为载体调控CD36基因表达对内皮细胞增殖的影响,未使用HCM血管内皮细胞作为载体,可能会影响实验结果。本研究发现,过表达CD36可以显著抑制内皮细胞的增殖,不能排除肥厚心肌细胞挤压机械力对内皮细胞增殖的影响。此外,本研究并未进一步探讨CD36是否对心肌细胞肥大有影响,后期研究可对此深入研究。
利益冲突:所有作者均声明不存在利益冲突

