紫杉醇联合顺铂治疗宫颈癌的临床疗效及对患者免疫功能的影响
于芳,张轶群,吴勇
1咸阳市第一人民医院药剂科,陕西 咸阳 712000
2西安医学院第三附属医院药学部,西安 710000
宫颈癌是常见的女性生殖系统恶性肿瘤,近年来其发病呈年轻化趋势[1]。多数早期宫颈癌患者无明显症状和体征,随着病情的不断发展,可出现阴道出血、排液等症状,晚期宫颈癌患者还可能合并尿频、尿急、贫血等症状,且晚期患者具有较高的病死率。目前临床治疗宫颈癌的主要方法为手术联合放化疗,其中顺铂是对宫颈癌治疗效果较为明确的化疗药物,但随着该药物在临床的广泛应用,患者对其敏感性逐渐下降,影响了治疗效果[2]。作为一种抗微管药物,紫杉醇可诱导和促进微管蛋白聚合,防止其解聚,从而抑制肿瘤细胞有丝分裂,促进肿瘤细胞凋亡,进而抑制肿瘤细胞增殖,发挥抗肿瘤作用[3]。近年来有报道显示,紫杉醇联合铂类治疗恶性肿瘤患者的疗效较好[4]。本研究探讨紫杉醇联合顺铂治疗宫颈癌的临床疗效及对患者免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2010 年1 月至2022 年2 月咸阳市第一人民医院收治的宫颈癌患者的病历资料。纳入标准:①符合《中华妇产科学》[5]中宫颈癌的诊断标准,经病理检查确诊为宫颈癌;②入院前未接受放疗、化疗等治疗;③临床资料完整。排除标准:①肝肾功能异常;②合并血液系统疾病;③对本研究使用药物过敏;④哺乳期或妊娠期女性。依据纳入和排除标准,本研究共纳入70 例宫颈癌患者,根据治疗方法的不同分为A 组(n=35,给予顺铂治疗)和B 组(n=35,给予紫杉醇联合顺铂治疗)。A组患者年龄35~68 岁,平均(50.25±7.15)岁;肿瘤直径1~5 cm,平均(3.45±0.70)cm;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)[6]分期:Ⅲa 期12 例,Ⅲb 期18 期,Ⅳ期5例。B 组患者年龄33~67 岁,平均(50.30±7.22)岁;肿瘤直径1~6 cm,平均(3.50±0.66)cm;FIGO 分期:Ⅲa 期10 例,Ⅲb 期18 期,Ⅳ期7 例。两组患者的年龄、肿瘤直径、FIGO 分期比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 治疗方法
A 组患者给予顺铂治疗,将75 mg/m2顺铂溶入500 ml 氯化钠溶液中,第1 天,静脉滴注。21 天为1个疗程,共治疗2 个疗程。
B 组患者在A 组的基础上联合紫杉醇治疗。顺铂用法用量与A 组相同,将135 mg/m2紫杉醇溶入500 ml 氯化钠溶液中,第2 天,静脉滴注。21 天为1 个疗程,共治疗2 个疗程。
化疗过程中给予患者补液、营养支持及维持电解质平衡等对症支持治疗。
1.3 观察指标及评价标准
①近期疗效。采用实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)[7]评价两组患者的近期疗效。完全缓解(complete response,CR):肿瘤病灶完全消失,至少维持4 周;部分缓解(partial response,PR):肿瘤病灶长径总和与基线相比减少≥30%,至少维持4 周;疾病稳定(stable disease,SD):肿瘤病灶长径总和与基线相比减少<30%或增加<20%;疾病进展(progressive disease,PD):肿瘤病灶长径总和与基线相比增加≥20%或出现新病灶。客观缓解率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。②血清肿瘤标志物水平。分别于治疗前后采集两组患者空腹静脉血3 ml,离心分离血清,采用酶联免疫吸附试验检测鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)、脊椎蛋白2(spondin 2,SPON2)水平,采用电化学发光法检测肿瘤特异性生长因子(tumor specific growth factor,TSGF)水平。③免疫功能指标。分别于治疗前后采集两组患者空腹静脉血3 ml,采用流式细胞仪检测CD3+、CD4+、CD8+水平,并计算CD4+/CD8+。④不良反应发生情况。记录治疗期间两组患者消化道反应、骨髓抑制、脱发、肝肾功能损伤、血小板减少发生情况。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效的比较
B 组患者的客观缓解率和疾病控制率分别为74.29%(26/35)和94.29%(33/35),分别高于A 组患者的48.57%(17/35)和77.14%(27/35),差异均有统计学意义(χ2=4.884、4.200,P<0.05)。(表1)

表1 两组患者的近期疗效[n(%)]*
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者血清SCCA、SPON2、TSGF水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者血清SCCA、SPON2、TSGF 水平均低于本组治疗前,B 组患者血清SCCA、SPON2、TSGF水平均低于A 组,差异均有统计学意义(P<0.05)。(表2)
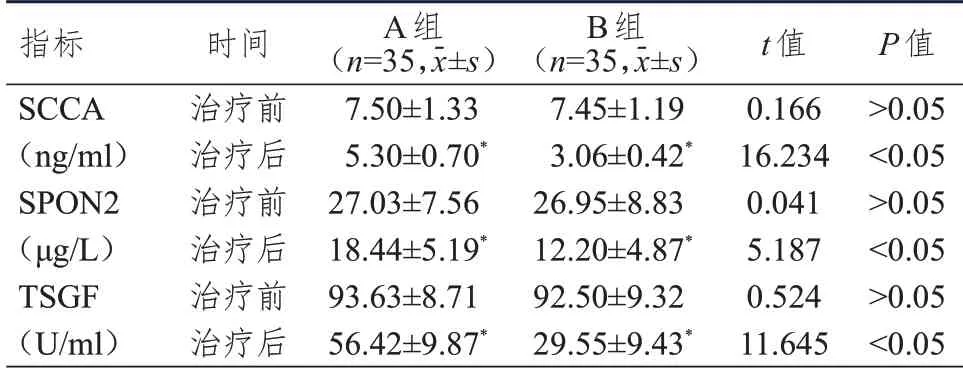
表2 治疗前后两组患者血清肿瘤标志物水平的比较
2.3 免疫功能指标的比较
治疗前,两组患者CD3+、CD4+、CD8+水平及CD4+/CD8+比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD3+、CD4+水平及CD4+/CD8+均高于本组治疗前,CD8+水平均低于本组治疗前,B组患者CD3+、CD4+水平及CD4+/CD8+均高于A 组,CD8+水平低于A 组,差异均有统计学意义(P<0.05)。(表3)

表3 治疗前后两组患者免疫功能指标的比较
2.4 不良反应发生情况的比较
B组患者的不良反应总发生率为42.86%(15/35),与A 组患者的40.00%(14/35)比较,差异无统计学意义(χ2=0.059,P=0.808)。(表4)

表4 两组患者的不良反应发生情况[n(%)]
3 讨论
研究显示,宫颈癌的发病与抑癌基因和原癌基因突变、遗传因素、外界刺激等有关[8]。该病好发于性生活过早、多孕多产、免疫功能低下者,其临床症状多表现为接触性出血、阴道流血等。近年来,随着生活水平的不断升高,宫颈癌的发病率呈不断上升趋势。因此,宫颈癌的早期筛查、预防及治疗极为重要。对于早期宫颈癌患者,临床多采取手术进行治疗,手术方式包括根治性子宫切除术、改良根治性子宫切除术等,虽取得了一定的治疗效果,但部分患者术后易出现肿瘤组织残留、转移等,同时由于早期宫颈癌患者肿瘤组织对放疗的敏感性较差,导致患者治疗疗效不佳。研究表明,宫颈癌患者术前进行化疗可使肿瘤细胞转移风险下降,从而改善患者预后[9]。
铂类药物是临床常用的抗肿瘤药物,可与DNA 产生链内、链间交联,从而损伤DNA 并抑制其复制、转录,具有抗肿瘤谱广、疗效显著等特点。顺铂应用于宫颈癌患者可造成肿瘤细胞DNA烷基化,损伤肿瘤细胞DNA,使肿瘤细胞裂解死亡,且对G1期细胞较为敏感,其抗肿瘤疗效显著[10-11]。但由于顺铂存在一定程度的肾毒性,导致其使用剂量受到一定的限制。紫杉醇作为一种从红豆杉树皮中提取的天然抗肿瘤药物,具有见效快、不良反应少等特点,主要通过破坏微管蛋白二聚体与微管蛋白的平衡抑制肿瘤细胞有丝分裂,发挥抗肿瘤作用[12-13]。本研究结果显示,B 组患者的客观缓解率和疾病控制率均高于A 组。表明紫杉醇联合顺铂治疗宫颈癌患者可提高近期疗效,抗肿瘤效果显著。
SCCA 在临床上多被用于诊断宫颈癌,健康人体内其水平较低,有癌变趋势时,SCCA 呈高表达,其水平高低可用于评估肿瘤患者的预后;SPON2属于一种细胞外基质蛋白,可通过激活相关信号通路对细胞增殖与迁移进行调节[14]。有研究表明,多种类型肿瘤患者的血清SPON2 水平明显升高[15]。血清TSGF 是反映肿瘤细胞增殖、浸润、转移等情况的指标,在宫颈癌发生早期,其水平与其他血清肿瘤标志物相比升高较为明显,与宫颈癌的发生、发展密切相关[16]。本研究结果显示,治疗后,两组患者血清SCCA、SPON2、TSGF 水平均低于本组治疗前,B 组患者血清SCCA、SPON2、TSGF 水平均低于A 组。提示紫杉醇联合顺铂治疗宫颈癌患者,可降低血清肿瘤标志物水平。其原因在于紫杉醇能够使肿瘤细胞内的DNA 断裂,导致肿瘤细胞变异后发生裂解死亡;紫杉醇还会影响宫颈癌患者的局部肿瘤微环境,导致肿瘤微环境发生改变,抑制肿瘤细胞的持续增殖,与顺铂联合发挥协同作用,导致宫颈癌细胞发生裂解死亡,从而使患者血清肿瘤标志物水平下降[17]。
临床研究显示,多数肿瘤患者会出现免疫抑制,恢复免疫功能有利于机体监视肿瘤细胞,发挥免疫杀伤作用,抑制肿瘤侵袭,从而稳定机体内环境[18]。T 细胞亚群中CD3+、CD4+、CD8+是机体介导细胞及体液免疫的主要细胞,CD4+/CD8+降低是机体免疫功能下降的重要指标,维持上述指标处于正常水平对维持机体免疫功能十分重要。本研究结果显示,治疗后,两组患者CD3+、CD4+水平及CD4+/CD8+均高于本组治疗前,CD8+水平均低于本组治疗前,B组患者CD3+、CD4+水平及CD4+/CD8+均高于A 组,CD8+水平低于A 组。表明紫杉醇联合顺铂治疗宫颈癌患者,可促进机体产生免疫反应,从而增强抗肿瘤作用。其原因可能在于紫杉醇可较为彻底地杀灭肿瘤细胞,有效抑制肿瘤细胞远处转移,与童武松等[19]研究结果基本相符。本研究中,两组患者不良反应总发生率比较,差异无统计学意义(P>0.05)。表明紫杉醇联合顺铂治疗宫颈癌患者具有一定的安全性。
综上所述,紫杉醇联合顺铂治疗宫颈癌的疗效确切,可降低血清肿瘤标志物水平,改善免疫功能,且具有一定的安全性,值得临床进一步深入研究。

