爪蟾驱动蛋白样蛋白2 靶蛋白在肝细胞癌中的表达及临床意义
张卫彬,董佳,索立达,梁向南,武云飞,邱春瑜,李博,郑彬
1锦州市中心医院普外科,辽宁 锦州 121000
2锦州市妇婴医院放射线科,辽宁 锦州 121000
3大连医科大学附属第二医院肝胆外科,辽宁 大连 112000
肝细胞癌(hepatocellular carcinoma,HCC)是一种全球性发病的恶性肿瘤,其发病例数占原发性肝癌(primary liver cancer,PLC)的75%~85%,且多数患者5 年生存率较低[1]。由于中国慢性乙型肝炎的发病率较高,以致HCC 的发病率较欧美发达国家高[2],发病例数超全球HCC 患者的1/2。虽然手术治疗和放化疗有利于提高HCC 患者的5 年生存率,但易导致多种并发症,影响患者生活质量[3]。目前,虽然全世界的研究者对HCC 的发病机制进行了广泛且深入的研究,但仍未完全阐明。有学者认为HCC 的发病与癌基因的表达密切相关[4]。因此,探讨癌基因的表达与HCC 发病之间的关系具有重要的临床意义。爪蟾驱动蛋白样蛋白2 靶蛋白(targeting protein for xenopus kinesin-like protein 2,TPX2)是一种蛋白质编码基因,最早发现于非洲爪蟾蜍卵中,具有促进染色质微管成核、调控纺锤体形成的功能,是一种与细胞核增殖微管密切相关的蛋白[5]。而且,TPX2 可调控极光激酶A(aurora kinase A,AURKA),将AURKA 锚定于有丝分裂纺锤体微管[6]。相关文献报道,TPX2 在多种疾病(包括色素性视网膜炎、宫颈癌、结直肠癌、乳腺癌以及胃癌等)中高表达且影响患者预后[7-11]。然而,目前尚没有学者对TPX2 在HCC 发生发展中的作用机制进行深入研究。因此,本研究利用生物信息学方法分析TPX2 在HCC 中的表达情况及其对患者预后的影响,现报道如下。
1 资料与方法
1.1 数据来源
数据来源于各网络在线共享可用数据库,均是以癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库相关数据为基础,分别为GEPIA 数据库(http://gepia.cancer-pku.cn/detail.php)、K-M Plot 数据库(http://kmplot.com/analysis/)、UALCAN 数据库(http://ualcan.path.uab.edu/index.html)、HPA 数据库(https://www.proteinatlas.org/)、ACLBI 数据库(https://www.aclbi.com/static/index.html)。
1.2 数据库分析方法
通过UALCAN 与K-M Plot 数据库分析TPX2蛋白和mRNA 在HCC 组织中的表达水平及其与患者预后的关系。利用HPA 数据库分析TPX2 蛋白在HCC 组织中的表达水平。
利用GEPIA 数据库对HCC 组织中TPX2 与肿瘤蛋白p53(tumor protein p53,TP53)的相关性进行分析;再利用UALCAN 数据库分析TPX2 在HCC组织中的表达水平与TP53突变之间的相关性。
利用ACLBI 数据库分析TPX2 在HCC 组织中的表达水平及其对患者预后的风险评估,并通过受试者工作特征(receiver operating characteristic,ROC)曲线中的曲线下面积(area under the curve,AUC)判断TPX2 对HCC 患者预后的预测价值。
1.3 统计学方法
采用SPSS 26.0 软件对数据进行统计分析。不符合正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Wilcoxon 秩和检验;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank 检验;相关性分析采用Pearson相关分析法;绘制ROC曲线,分析TPX2 对HCC 患者预后的预测价值;以P<0.05 为差异有统计学意义。
2 结果
2.1 TPX2 在HCC 中的表达及与预后的关系
UALCAN数据库分析结果显示,不同分期和分级HCC 组织中TPX2mRNA 表达水平均高于正常组织,差异均有统计学意义(P<0.05)。(表1、表2)
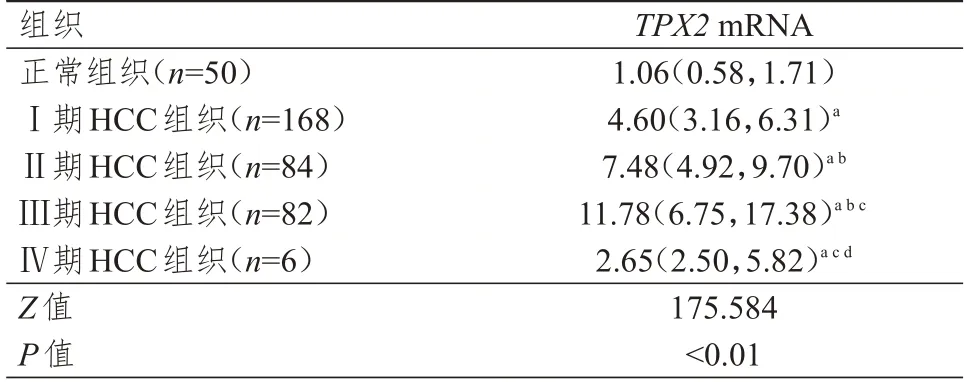
表1 正常组织和不同分期HCC 组织中TPX2 mRNA 表达水平的比较[M(P25,P75)]

表2 正常组织和不同分级HCC 组织中TPX2 mRNA 表达水平的比较[M(P25,P75)]
K-M Plot 数据库分析结果显示,TPX2 低表达HCC 患者的无复发生存期(recurrence-free survival,RFS)、总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)及疾病特异性生存期(disease-specific survival,DSS)均优于TPX2 高表达患者,差异均有统计学意义(HR=2.03、2.88、1.62、1.58,P<0.05)。(图1)
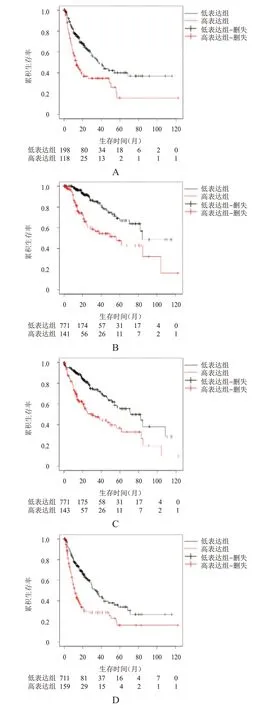
图1 不同TPX2表达情况HCC患者的生存曲线
HPA数据库免疫组化分析结果显示,HCC组织中TPX2蛋白阳性表达率高于正常肝组织。(图2)
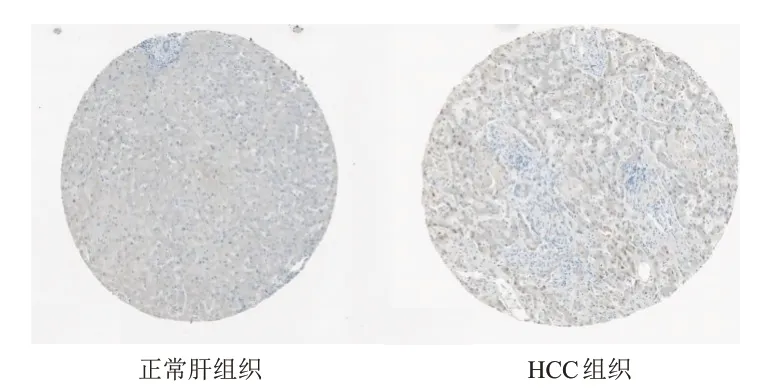
图2 HPA数据库免疫组化分析TPX2在正常肝组织和HCC组织中的表达(免疫组化染色,×200)
2.2 TPX2 与TP53 的相关性分析
UALCAN 与GEPIA 数据库分析结果显示,HCC 组织中TPX2 与TP53 的表达呈正相关(r=0.34,P<0.05),且TP53突变组TPX2mRNA 表达水平为12.25(7.08,16.77),高于TP53未突变组的4.29(2.15,6.64),差异有统计学意义(Z=180.183,P<0.05)。
2.3 TPX2 对HCC 患者预后的预测价值
ACLBI数据库分析结果显示,随着TPX2表达的增高,患者预后不良风险增加(图3A);TPX2低表达HCC患者的OS明显优于TPX2高表达患者,差异有统计学意义(HR=2.057,P<0.01)(图3B);TPX2表达预测HCC 患者1、3、5 年OS 的ROC 曲线的AUC 分别为0.731(95%CI:0.659~0.803)、0.664(95%CI:0.588~0.739)和0.644(95%CI:0.551~0.738)(图3C)。
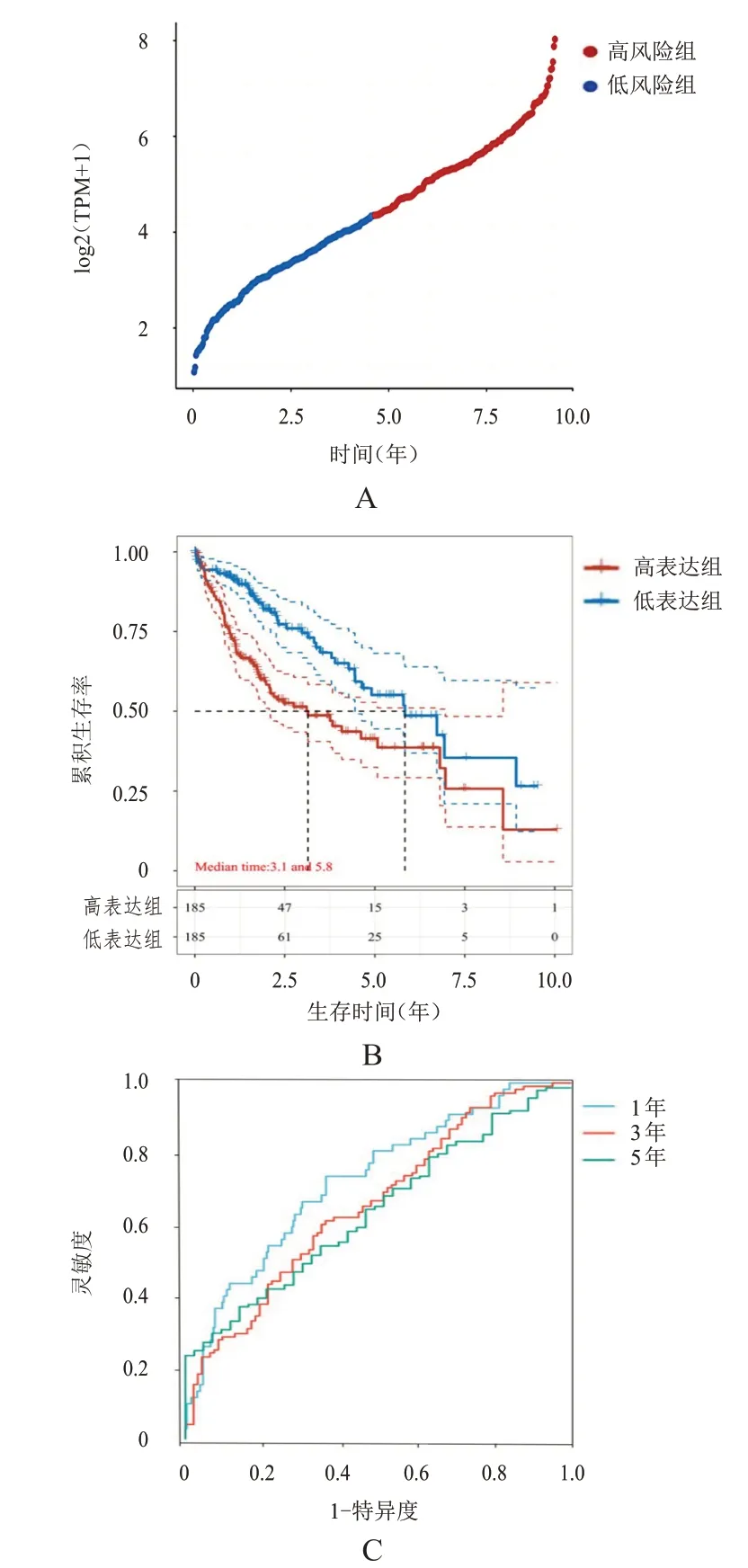
图3 TPX2表达对HCC患者预后的预测价值
3 讨论
HCC 虽然是由多种致病因素和遗传因素协同作用导致的消化系统恶性肿瘤[12-13],但致病癌基因在其发生发展过程中同样发挥重要作用。目前对HCC 相关癌基因的研究还不够深入,又缺乏相应的靶向治疗药物,从而难以准确预测患者预后[14]。因此,迫切需要寻找预测患者预后的生物标志物。
TPX2位于染色体20q11.21,可通过其羧基末端结构域介导细胞着丝粒处微管组装,并受Ran-GFP 调控,在有丝分裂早期被释放,进而与AURKA 协同促进纺锤体装配的起始[15];而且,TPX2 通过促进AURKA“Thr-288”自磷酸化从而激活AURKA,并保护该残基免于去磷酸化[16]。TPX2 与细胞周期密切相关,其表达可见于细胞G1期向S 期过渡时期,而消失于细胞质分裂期[17]。研究报道,TPX2 在恶性肿瘤组织中异常表达,且由于TPX2中心体异常扩增,常导致DNA 异倍体以及多倍体形成,造成肿瘤细胞大量增殖与恶化,并影响细胞周期与细胞凋亡[18]。因此,TPX2 的异常表达对预测恶性肿瘤的发生发展、复发与转移具有重要价值。
研究发现,TPX2 在大部分肿瘤组织中高表达,不利于患者的OS。同时也发现,TPX2及其共表达基因在HCC 组织中均高表达,是患者预后的危险因素,不利于患者的OS。此外,TPX2与其共表达基因的基因本位(Gene Ontology,GO)功能和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集情况较一致。有学者通过对43 例神经母细胞瘤进行研究发现,TPX2 可正向调节神经母细胞瘤细胞增殖和细胞周期,并通过增强细胞对凋亡的抵抗力促进细胞存活,从而不利于神经母细胞瘤患者的OS;而且,研究认为,TPX2 在神经母细胞瘤发生发展过程中起致癌作用,可作为神经母细胞瘤患者潜在的预后标志物[19]。此外,另有研究通过实验分析3952 例乳腺癌患者的TPX2 表达水平发现,TPX2在乳腺癌中显著高表达,且不利于患者的OS,并认为其可用作乳腺癌的潜在治疗靶点[20]。Wang 等[21]研究发现,子宫内膜癌组织中TPX2mRNA 和蛋白均高表达,且与患者预后不良有关,是子宫内膜癌的易感基因。Sui 等[22]分析250 例食管癌组织与癌旁组织发现,TPX2 在食管癌组织中的表达水平高于癌旁组织,且不利于患者的5 年OS,可作为评估食管癌患者预后的重要生物标志物。Zhu 等[23]通过分析HCC 组织中TPX2 的表达水平发现,其表达水平显著上调,并与患者种族、年龄、体重、临床分期和肿瘤分级相关,且不利于患者的OS、PFS、DFS及DSS。此外,也有文献报道,乙肝病毒可导致染色体着丝粒处变异,从而影响纺锤体与着丝粒的附着,最终造成染色体分离困难[24]。因此,众多学者在不同领域获得的研究结果均一致认为TPX2在肿瘤组织中高表达,不利于患者预后,与本研究结果一致。
TPX2 的表达与免疫细胞浸润和TP53突变具有相关性。Wang 等[25]通过研究发现,TPX2 可通过核因子κB(nuclear factor-κB,NF-κB)信号通路调节CXC 趋化因子受体5(C-X-C motif chemokine receptor 5,CXCR5),维持HCC 中CD8+T 细胞中的抗肿瘤作用。此外,有研究者认为TPX2 可与人类白细胞抗原(human leucocyte antigen,HLA)-A+021结合,从而更易被树突状细胞识别,增强T 淋巴细胞杀灭肿瘤细胞的能力[26]。国外学者对253 例侵袭性乳腺癌组织进行免疫组化分析发现,TPX2 过表达与侵袭性乳腺癌之间存在明显相关性,并认为TPX2 过表达常发生在TP53突变和倍体升高的情况下[27]。本研究通过分析发现,TPX2 在HCC 中高表达,且TPX2 高表达更加不利于患者预后;同时,HCC 组织中TPX2 与TP53 表达呈正相关,且TP53突变组TPX2mRNA 表达水平高于TP53未突变组。本研究结果与国外学者在侵袭性乳腺癌研究中得到的结果一致。有研究者认为,TPX2 在HCC 中的致病机制主要是其高表达改变了细胞核中染色体分离的调节,导致细胞有丝分裂和染色体不稳定[28]。TPX2可能是一种癌基因,在HCC 的发生发展过程中发挥重要作用,并与免疫细胞浸润和TP53突变有关。
通路分析发现,TPX2 在HCC 中与磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)/雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信号通路显著相关,而PI3K/AKT/MTOR 信号通路在肿瘤发生发展、复发以及转移进程中发挥重要作用,且AKT 的活化与肿瘤细胞增殖、迁移及侵袭密切相关[29]。因此,TPX2 可能与恶性肿瘤细胞增殖、迁移及侵袭有关。Huang等[30]通过多种实验技术检测HCC 组织、邻近正常肝组织以及HCC 细胞系中TPX2mRNA 和蛋白表达发现,TPX2 可通过调节PI3K/AKT 信号通路抑制HCC 的生长,从而发挥抗肿瘤作用。因此,认为TPX2 可能是治疗HCC 的潜在靶标。而Zou 等[31]研究发现,敲低TPX2表达,可诱导G2、M 期停滞,从而促进胆管癌细胞凋亡并抑制细胞的侵袭和迁移。此外,TPX2 与上皮-间充质转化(epithelialmesenchymal transition,EMT)通路基因基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、Slug 以及扭转家族bHLH 转录因子1(twist family bHLH transcription factor 1,TWIST1)密切相关,而且其在DNA 损伤反应中发挥放大作用[32]。有研究表明,在结肠癌中,TPX2和AURKA的扩增与MYC存在相关性,且其与MYC 下游靶基因的表达呈正相关,两者在结肠癌细胞的增殖以及恶化过程中发挥协同作用[33]。因此,MYC被认为是AURKA/TPX2 通路下游的重要基因。同时,TPX2 在细胞对缺氧的反应、肿瘤增殖特征及胶原蛋白形成等通路中也发挥重要作用。
总之,本研究通过生物信息学方法分析TPX2在HCC 中的表达及临床意义,结果表明TPX2 可能是HCC 的一个潜在治疗靶点。但是,这种分析结果还需要相应的基础研究和临床研究进行验证,以便进一步明确TPX2基因在HCC 患者预后中的分子机制及临床意义。

