基于神经黑色素MRI、11C-CFT PET及18F-FDG PET联合诊断PD及评估其严重程度
姜双士,刘力硕,冯洪燕,王 科,卜丽红,涂 宁
(武汉大学人民医院PET中心,湖北 武汉 430061)
神经退行性疾病中,帕金森病(Parkinson's disease, PD)全球发病率仅次于阿尔茨海默病[1]。PD好发于中老年人,以中脑黑质含神经黑色素(neuromelanin, NM)的多巴胺能神经元不可逆变性、坏死为特征[2]。目前主要根据临床症状及体征等诊断PD,但多数患者早期症状不典型,给早期诊断PD带来困难。11C-CFT多巴胺转运体(dopamine transporter, DAT)PET显像和18F-FDG脑代谢PET显像可反映人体内与PD发生、发展密切相关的靶向示踪剂的分布及活性情况,对于早期诊断PD及评估严重程度具有独特优势[3-4]。NM-MRI能反映黑质NM含量,可用于监测含NM的神经元存活情况[5]。本研究观察联合应用NM-MRI、11C-CFT PET及18F-FDG PET诊断PD及评估病情的价值。
1 资料与方法
1.1 研究对象 回顾性分析2019年12月—2023年4月武汉大学人民医院疑诊PD并接受NM-MRI、异机融合11C-CFT PET/MR和18F-FDG PET/MR检查的68名受检者,后经临床确诊原发PD患者(PD组)52例[男28例、女24例,年龄33~79岁,平均(63.0±10.0)岁]及健康人(对照组)16名[男5名、女11名,年龄31~84岁、平均(66.6±13.1)岁]。根据Hoehn-Yahr(H-Y)分级将PD组分为早期亚组(H-Y 1~2级)和中晚期亚组(H-Y 2.5~5级):早期亚组(n=29)男14例、女15例,年龄33~77岁、平均(61.5±10.3)岁;中晚期亚组(n=23)男14例、女9例,年龄39~79岁、平均(65.0±9.6)岁。排除标准:①其他帕金森综合征;②脑卒中、头颅外伤或颅脑手术史;③严重心、肺等其他系统疾病及恶性肿瘤等。本研究经院医学伦理委员会审核批准(2019-X-70)。
1.2 仪器与方法
1.2.1 PET/CT检查 检查前嘱受检者停用抗PD药物12 h以上、禁食6 h以上。采用GE Discovery 710 PET/CT机。经静脉注射355~740 MBq11C-CFT后,嘱受检者于避光环境中安静休息1 h,之后仰卧于检查床;先行头部CT扫描(管电压120 kV,管电流150 mA,层厚3.75 mm,矩阵512×512),再行PET脑显像,采集时间15 min;采用衰减校正及迭代法重建获得脑三维CT、PET及PET/CT融合图像。扫描结束后使受检者休息3.5 h以上,确认空腹血糖<7.0 mmol/L后,经静脉注射18F-FDG 3.7~7.4 MBq/kg体质量,嘱其于避光环境中安静休息1 h后接受PET/CT扫描,采集及重建方式同上。
1.2.2 MR检查 采用 GE Discovery MR750W 3.0T MR仪、24通道头颅专用线圈。嘱受检者仰卧,采集矢状位T1W BRAVO全脑图像;参考所获图像,以中脑为中心,自双侧大脑脚至双侧桥臂采集NM-MRI(TR 600 ms,TE 10 ms,FOV 22 mm×22 mm,矩阵288×192,层厚2.5 mm,层间距0,采集时间6 min 32 s)。
1.2.3 PET/MR图像融合 将DICOM格式的PET/CT及MRI导入GE后处理工作站,手动配准PET与MR图像并进行融合后存储,得到异机融合11C-CFT PET/MRI及18F-FDG PET/MRI。
1.3 图像后处理及分析 由2名具有5年以上工作经验的核医学科医师分析NM-MRI、11C-CFT PET/MRI及18F-FDG PET/MRI,意见不一致时经协商达成共识。于11C-CFT PET/MRI显示纹状体各亚区(尾状核、壳核前部、壳核后部)最清晰层面手动勾画双侧ROI,记录其最大标准摄取值(maximum standard uptake value, SUVmax);以同侧小脑半球作为本底,计算双侧标准化CFT(standardized CFT, sCFT):sCFT=靶区SUVmax/本底SUVmax,并计算纹状体各亚区不对称指数(asymmetry index, ASI):ASI=(高摄取侧sCFT-低摄取侧sCFT)/双侧sCFT均值。将18F-FDG PET/MR图像数据导入GE后处理工作站,手动勾画尾状核及壳核ROI,测量其SUVmax;以同侧大脑皮层作为本底,计算双侧标准化FDG(standardized FDG, sFDG):sFDG=靶区SUVmax/本底SUVmax;于显示中脑黑质致密部(substantia nigra compacta, SNc)最清晰且最大层面手动勾画SNc,记录双侧SNc面积。除ASI外,其余参数均取双侧均值为最终结果。
1.4 统计学分析 采用SPSS 27.0及MedCalc 20.0统计分析软件,分别以±s及中位数(上下四分位数)表示符合或不符合正态分布的计量资料,行独立样本t检验或Mann-WhitneyU检验。行二元logistic回归分析,建立模型;绘制受试者工作特征(receiver operating characteristic, ROC)曲线,以DeLong检验比较曲线下面积(area under the curve, AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析
2.1.1 组间比较 PD组纹状体各亚区sCFT及SNc面积均明显小于对照组(P均<0.05),壳核前部ASI、壳核后部ASI、尾状核sFDG及壳核sFDG明显大于对照组(P均<0.05)。见图1、2。
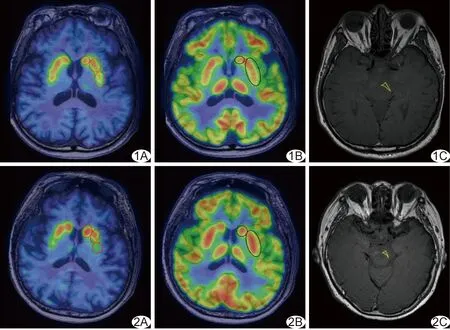
图1 对照组受试者,男,70岁 A.11C-CFT PET/MRI示纹状体各亚区放射性摄取未见减低; B.18F-FDG PET/MRI示纹状体各亚区放射性摄取未见增高; C.NM-MRI示SNc面积为48.60 mm2 (圈示纹状体各亚区,三角内为SNc) 图2 PD组患者,女,69岁,H-Y 2级 A.11C-CFT PET/MRI示双侧壳核前部CFT摄取稍减低,后部摄取明显减低; B.18F-FDG PET/MRI示双侧壳核FDG摄取增高; C.NM-MRI示SNc面积为36.92 mm2 (圈示纹状体各亚区,三角内为SNc)
2.1.2 PD组内亚组间比较 中晚期亚组尾状核sCFT、壳核前部sCFT及SNc面积均明显小于早期亚组(P均<0.05),而壳核前部ASI及壳核后部ASI大于早期亚组(P均<0.05)。见图3、4。
2.2 logistic回归分析
2.2.1 组间比较 组间壳核后部sCFT、ASI及SNc面积差异有统计学意义(P均<0.05)。基于壳核后部sCFT及ASI建立的PET模型诊断PD的AUC为0.946[95%CI(0.863,0.986)]、敏感度为92.31%、特异度为100.00%,基于SNc面积建立的MRI模型的AUC为0.864[95%CI(0.759,0.935)]、敏感度为80.77%、特异度为87.50%;基于上述3个参数建立的PET/MRI模型的AUC为0.948[95%CI(0.866,0.987)]、敏感度为82.69%、特异度为100%,其AUC明显高于MRI模型(Z=2.079,P=0.038)而与PET模型差异无统计学意义(Z=0.090,P=0.928)。见图5A。
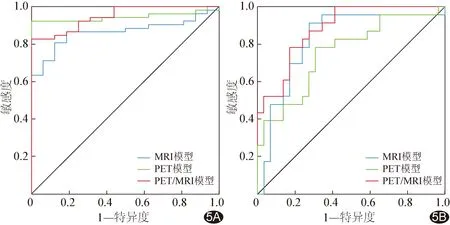
图5 MRI模型、PET模型及PET/MRI模型诊断PD及评估病情的ROC曲线 A.诊断PD; B.评估PD严重程度
2.2.2 PD组内亚组间比较 亚组间壳核前部sCFT、壳核后部ASI及SNc面积差异有统计学意义(P均<0.05)。基于壳核前部sCFT及壳核后部ASI建立的PET模型评估PD严重程度的AUC为0.754[95%CI(0.615,0.863)]、敏感度为78.26%、特异度为68.97%,基于SNc面积建立的MRI模型的AUC为0.822[95%CI(0.691,0.914)]、敏感度为91.30%、特异度为72.41%;基于上述3个参数建立的PET/MRI模型的AUC为0.882[95%CI(0.762,0.955)],其AUC明显高于PET模型(Z=2.127,P=0.033)而与MRI模型差异无统计学意义(Z=1.101,P=0.271)。见图5B。
3 讨论
11C-CFT PET可反映黑质-纹状体下游区域DAT含量[6],18F-FDG PET可显示各脑区葡萄糖代谢分布变化[7],NM-MRI则有助于观察中脑黑质区NM含量[8]。本研究结果显示,联合应用上述三者对诊断PD及评估其严重程度具有较高价值。
有研究[9-10]观察黑质NM高信号区对比度、对比度噪声比、宽度、面积和体积等指标,发现PD患者SNc的NM显著减少。本研究中,PD组SNc面积小于对照组,且PET/MRI模型诊断PD的AUC大于单独MRI模型;原因可能在于NM-MRI主要通过检测中脑NM变化以反映多巴胺能神经元变性坏死,而无法直接显示纹状体下游区域多巴胺含量变化。11C-CFT为靶向DAT分子显像剂,可通过揭示纹状体区DAT分布而反映黑质-纹状体通路多巴胺能系统退行性变演化过程,进而早期诊断PD[11-13]。本研究结果显示,相比对照组,PD组纹状体各亚区sCFT均降低且以壳核后部为著,而壳核ASI显著升高,与LIN等[14]研究结果一致;同时,PD组纹状体sFDG高于对照组,与既往研究[15]一致,提示联合应用NM-MRI与多分子靶向PET分子影像学技术不仅能用于发现黑质区NM变化规律,还可灵敏且直接地观察纹状体DAT分布变化、提供各脑区摄取葡萄糖的信息,有助于早期诊断PD。
在PD早期,壳核后部最早出现多巴胺能神经元受损,表现为双侧壳核CFT摄取降低、不对称性增高而尾状核CFT摄取下降不明显;随病程延长,由壳核至尾状核,摄取CFT逐渐降低[16]。因此,根据壳核改变可较敏感地发现多巴胺能神经元丢失,而出现尾状核CFT摄取降低则提示疾病进展。韩贵娟等[11]报道,晚期PD患者尾状核及壳核CFT摄取对称性降低。本研究中晚期PD患者壳核ASI显著高于早期患者,且双侧不对称降低,可能与本研究因纳入晚期PD患者较少而未能对中期与晚期细分有关。PD患者出现临床症状前已存在SNc多巴胺能神经元丧失,且神经元数量随疾病进展而进行性减少。GAURAV等[17]通过手动勾画ROI方式比较不同分期PD患者SNc体积,发现SNc体积变化与疾病严重程度和持续时间相关。本研究早期与中晚期PD患者SNc面积存在显著差异,且总体呈随疾病进展而减低趋势。本研究PET/MRI模型评估PD严重程度的AUC明显优于PET模型而与MRI模型无明显差异,原因可能在于PD患者出现临床症状时黑质区域多巴胺能神经元已死亡至少50%、纹状体下游区域多巴胺含量减少80%以上,且随疾病进展,多巴胺能神经元丢失程度高于纹状体下游多巴胺含量变化,而11C-CFT PET能间接反映纹状体下游多巴胺含量,故PET/MRI模型的诊断效能高于PET模型。
综上所述,联合应用NM-MRI、11C-CFT PET及18F-FDG PET有助于诊断PD并评估病情。但本研究为单中心、回顾性、小样本研究,采用手动勾画ROI方法,可能对研究结果造成一定偏倚,均有待后续加以完善。

