羟基酪醇纳米脂质体冻干粉的制备及其性能评价
李文君, 王成章, 雷建都, 周 昊
(1.中国林业科学研究院 林产化学工业研究所;江苏省生物质能源与材料重点实验室;国家林业和草原局林产化学工程重点实验室;林木生物质低碳高效利用国家工程研究中心,江苏 南京210042; 2.北京林业大学 材料科学与技术学院,北京 100083; 3.南京林业大学江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037)
羟基酪醇(HT),化学名为3,4-二羟基苯乙醇,广泛存在于橄榄科橄榄属植物的枝叶和果实中[1],也是油橄榄中重要的多酚类物质,具有较好的抗氧化[2]、抗肿瘤[3]、抗菌[1]、抗炎[4]活性,并对心血管疾病有预防和治疗的作用[5]。但是HT的半衰期很短,生物利用度较低[6-7],从而极大地限制了其进一步的应用。因而,本课题组利用薄膜蒸发法制备得到HT纳米脂质体脂悬液,使其生物利用度得到显著提高[8]。但是,由于HT纳米脂质体脂悬液以液态形式存在,脂质颗粒间易发生团聚,磷脂层也较易水解、氧化,导致其粒径变大及HT泄露等[9],且在低温下,脂悬液也仅能稳定存放几周,稳定性较差。为了使HT纳米脂质体在常温下也能长期稳定的贮存,可以利用真空冷冻干燥技术将液态的HT纳米脂质体脂悬液制备成冻干粉,由于除去了95%以上的水分,因此在室温下可以长期保存,并能够在复溶后迅速还原成原来的状态[10]。本研究将从预冻温度、预冻时间、冻干时间、冷冻保护剂种类及溶液质量分数、稳定性等方面考察冷冻干燥技术对HT脂质体冻干粉外观、再分散性、粒径和包封率等的影响,筛选得到最佳的冻干条件,并对HT纳米脂质体冻干粉的贮藏稳定性进行评价。
1 实 验
1.1 原料、试剂与仪器
羟基酪醇(HT)标准品(纯度≥98%)、氢化卵磷脂、卵磷脂、胆固醇、胆酸钠,上海阿拉丁生化科技股份有限公司;三氯甲烷、甲酸、乙醇,均为分析纯;甲醇、乙腈、水,均为HPLC级。
LC-20T高效液相色谱仪,日本岛津公司;Nano ZS激光粒度分析仪,英国马尔文公司;JY92-IIN超声波细胞粉碎机,上海精其仪器有限公司;TGL-16M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;DFY-5/30低温恒温反应浴,南京沃中仪器设备有限公司;FD-1C-50+冷冻干燥机,北京博医康实验仪器有限公司;H-7650透射电子显微镜,日本日立公司。
1.2 HT分析方法的建立
1.2.1HPLC色谱条件 色谱柱为SUPELCOSILTMLC-18(250 mm×21.2 mm,5 μm),流动相A为1%甲酸溶液,流动相B为含5%甲醇和1%甲酸的乙腈溶液,流速0.8 mL/min,进样量5 μL,梯度洗脱,以80%A和20%B开始洗脱,7 min内流动相B调整为30%并保持18 min,之后10 min内增加流动相B到95%,并保持5 min,最后调节流动相B至20%并保持5 min,总运行时间45 min。
1.2.2HPLC标准曲线的绘制 精密称取HT标准品,分别配制成质量浓度为2、 1、 0.5、 0.1、 0.05、 0.02、 0.01和0.005 g/L的标准溶液,甲醇溶解定容、摇匀,经0.45 μm的滤膜过滤后,依次进样5 μL检测(进样3次),以峰面积积分值的平均值为纵坐标(y),标准溶液质量浓度为横坐标(x),绘制标准曲线并拟合回归方程。得到HT标准曲线回归方程为:y=5 366 853x-41 226,R2=0.993 0。
1.3 HT纳米脂质体脂悬液的制备
根据先前的实验方法采用薄膜蒸发法制备HT纳米脂质体[8]。准确称取30 mg的氢化卵磷脂和1.5 mg 的HT,分别溶解在4 mL的三氯甲烷和3 mL的甲醇中,两者混合后,利用旋转蒸发仪在42 ℃下浓缩去除溶剂,待圆底烧瓶内部形成白色均匀的涂层即可。然后,加入3 mL质量分数为10%的蔗糖水溶液(冻干保护剂)[11-12],在65 ℃下水化1 h(20 r/min),再将所得乳液通过细胞破碎仪进行2次超声波处理,每次5 min,形成均匀的HT纳米脂质体脂悬液。
1.4 HT纳米脂质体冻干粉的制备工艺优化
1.4.1冻干工艺的考察 将制备好的HT纳米脂质体脂悬液置于低温恒温反应浴中进行预冻后,置于冷冻干燥机进行冻干,考察不同冻干工艺如预冻温度(-18、-50 ℃)、预冻时间(4、 8、 12 h)、冻干温度-50 ℃下冻干时间(24、 48、 72 h),对样品的外观和再分散性的影响,筛选最佳的冻干工艺条件。
1.4.2冻干保护剂的考察 根据1.3节的制备条件,首先考察不同种类的单一冻干保护剂(D-海藻糖、乳糖、蔗糖、麦芽糖、葡萄糖、甘露醇)对冻干产品的影响,根据单因素试验结果,筛选对HT纳米脂质体冻干粉较为有利的3种冻干保护剂,进行3因素3水平的正交试验,并通过方差分析确定冻干保护剂溶液质量分数,筛选最佳的冻干保护剂。
1.5 HT纳米脂质体包封率
1.5.1脂悬液包封率 脂质体制剂的包封率是一个重要的定量评估指标,由添加的药物总量与脂质体中包埋的药物量计算得出。取0.5 mL的0.5 g/L HT纳米脂质体脂悬液,加入1 mL甲醇溶液,超声波处理2 min,12 000 r/min离心10 min。移取上清液用水定容至5 mL,通过HPLC法测定溶液中HT的质量浓度,根据下式计算包封率(η):
η=(C0V0-CV)/C0V0×100%
式中:η—HT纳米脂质体脂悬液的包封率,%;C0—HT纳米脂质体脂悬液的质量浓度,g/L;V0—HT纳米脂质体脂悬液的体积,L;C—HPLC法测得的溶液中HT的质量浓度,g/L;V—溶液体积,L。
1.5.2冻干粉包封率 测定HT纳米脂质体冻干粉的包封率时,首先需要将HT纳米脂质体冻干粉进行复溶,即已知HT纳米脂质体冻干粉的实际质量及其脂悬液的体积和初始质量浓度,取一定质量的冻干粉,通过计算得到需加入水的对应体积,混合振荡待其溶解完全后,得复溶后的HT纳米脂质体脂悬液,再利用1.5.1节方法,测定HT纳米脂质体冻干粉的包封率。
1.6 HT纳米脂质体冻干粉性能评价
1.6.1外观 以基本保持原HT纳米脂质体脂悬液体积、饱满、不皱缩、不塌陷、可整块脱落但不散碎为佳,具体以“+++”表示松散、光滑、平整饱满;以“++”表示轻微的皱缩、塌陷;以“+”表示严重皱缩、塌陷;“--”表示不能成型[13]。
1.6.2再分散性 将HT纳米脂质体冻干粉复溶,振荡分散,以能够快速分散成均匀悬浮液且无不溶颗粒或团块为佳,具体以“+++”表示振荡1 min内能复溶成均匀悬浮液且无不溶颗粒或团块;“++”表示振荡1~3 min内能复溶成均匀悬浮液,但有少量不溶颗粒;“+”表示振荡5 min内仍不能复溶成均匀悬浮液,样品黏壁或有部分不溶颗粒(团块)[14]。
1.6.3粒径 按优化工艺条件制备HT纳米脂质体冻干粉,按原质量浓度复溶,稀释一定倍数后,在25 ℃、散射角90°条件下,采用激光粒度仪测定HT纳米脂质体的粒径。
1.6.4微观结构 首先取一滴样品脂悬液滴在干燥的载玻片上,把带有支持膜的铜网放在悬浮液的液珠上漂浮以蘸取样品,然后用滤纸吸干铜网上多余悬液,再将铜网放在染液(2%的磷钨酸)滴珠上漂浮,时间约1.5 min,最后用滤纸将染液吸干即可在80 kV的加速电压下通过透射电镜观察脂质体样品的微观形态。
1.6.5稳定性 按优化工艺条件制备HT纳米脂质体冻干粉,按原质量浓度复溶后,分别在第0 个月、第3个月、第6个月、第9个月、第12个月时再次按照上述方法分别测定其包封率、外观、再分散性和粒径。
2 结果与讨论
2.1 冻干工艺筛选结果分析
2.1.1预冻结果分析 根据预冻温度不同,可将预冻方式分为慢冻(-18 ℃)和速冻(-50 ℃),区别在于产生冰晶的形态和大小,这会影响后续的干燥速率和冻干粉的质量[14]。由于物体传热是由外向内,而样品内外存在一定的温度差,因此需要维持一定的预冻时间才能消除,使样品内外层温度一致,使得样品冻实,避免干燥过程中喷瓶[15]。另外,样品预冻的最低温度至少要低于样品共熔点10 ℃才能达到较为理想的预冻效果[16]。不同预冻方式的试验结果(预冻后再在-50 ℃下冷冻干燥72 h)见表1。由表1可知,-50 ℃下速冻的样品整体状态优于-18 ℃下的慢冻样品,并呈现出较好的外观,且预冻温度越低,预冻时间越长,外观越平整饱满,振荡1 min内能复溶成均匀悬浮液。但是,为了避免预冻过程增加不必要的能耗,选择速冻8 h为宜。
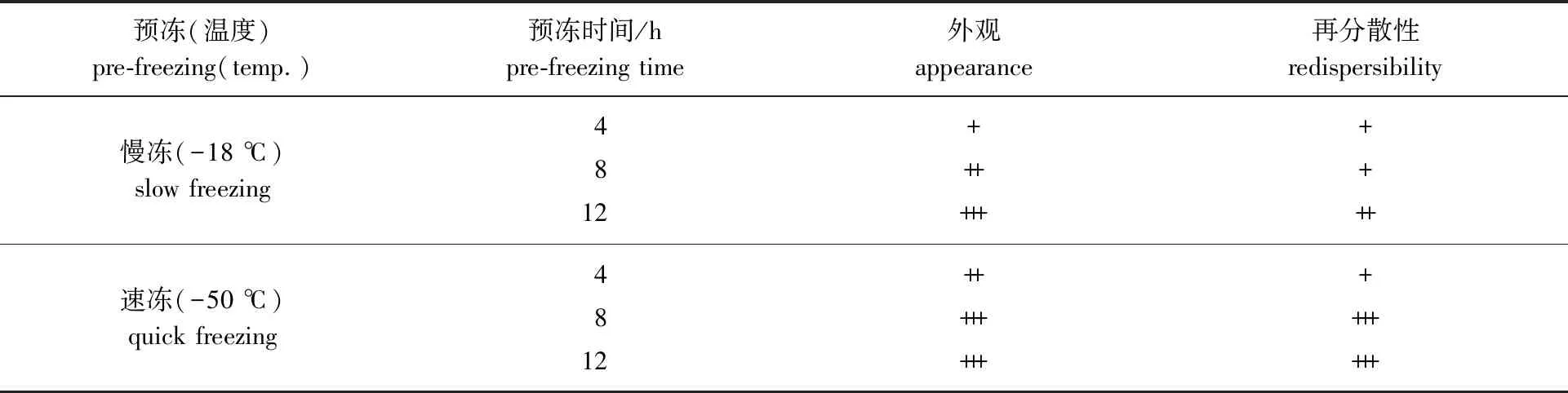
表1 预冻结果分析1)
2.1.2冻干时间 冻干主要分为升华和解吸两个过程,升华的温度一般要低于共熔点,否则样品会融化,易出现干缩现象,约90%以上的游离水分将在升华过程中除去;解吸可使样品温度快速升高至许可的最高温度并保持到干燥结束,此阶段主要以结晶水、吸附于晶格间隙中的水及以氢键结合的水的除去为主,由于这些水吸附能量高,所以此过程需要足够的时间[17]。先在-50 ℃下预冻8 h,然后在-50 ℃下冷冻干燥24、 48和72 h,干燥结果如表2所示。冻干时间分别为48和72 h时,样品在外观和再分散性上基本没有区别,在含水率方面72 h时的样品稍低于48 h的。因此,为了达到最好的实验效果,冻干时间选择72 h。

表2 干燥结果分析
2.2 冻干保护剂筛选结果分析
2.2.1单一冻干保护剂种类 以外观、再分散性、平均粒径、包封率等参数为指标,对样品冻干保护剂进行筛选。在2.1节优化的冻干工艺条件下,以不加任何冻干保护剂所制得的HT纳米脂质体冻干粉为空白对照,考察分别添加质量分数为10%的不同种类单一冻干保护剂(D-海藻糖、乳糖、蔗糖、麦芽糖、葡萄糖、甘露醇)对冻干产品的影响,结果见表3。

表3 单一冻干保护剂种类的筛选
由表3可知,不同种类冻干保护剂对HT纳米脂质体的外观、再分散性和冻干前后的平均粒径、包封率均有不同的影响;相比于冻干前,整体上有冻干保护剂的样品冻干并复溶后平均粒径会有所增加,其原因可能是在冻干过程中由于脂悬液失水导致纳米脂质体颗粒之间发生了融合或聚集[18],并在复溶时补液使脂质体发生了双层膨胀导致粒径的增加[19];另外,在冷冻和干燥过程中由于冻干保护剂为了保护脂质体脂悬液的结构而产生各种应力,这些应力往往也会产生团聚现象而导致粒径增加[20]。同时,从表3也可以看出,复溶后再分散性较好的冻干保护剂为D-海藻糖和蔗糖,其冻干粉进行复溶后平均粒径的增加较少[21-22],可能是团聚现象不明显的结果。但是,单一的冻干保护剂并不能达到理想的冻干效果,综合考虑,以D-海藻糖、蔗糖、甘露醇的不同配比作为复合冻干保护剂,可能达到更好的效果。
2.2.2正交试验优化 在冻干保护剂溶液质量分数为10%的条件下,以D-海藻糖(A)、蔗糖(B)、甘露醇(C)3种冻干保护剂的质量比为因素,按L9(34)表设计正交试验,正交试验设计与结果见表4,方差分析结果见表5。分析可知,D-海藻糖(A)、蔗糖(B)、甘露醇(C)对HT纳米脂质体冻干粉包封率均有显著影响,且影响大小为RC>RB>RA,但对平均粒径的影响不显著,因此正交试验的最优因素组合应为A3B2C1,即m(D-海藻糖)∶m(蔗糖)∶m(甘露醇)=4∶2∶1。

表4 正交试验设计与结果1)

表5 方差分析结果
2.2.3冻干保护剂溶液质量分数 在m(D-海藻糖)∶m(蔗糖)∶m(甘露醇)=4∶2∶1条件下,考察冻干保护剂溶液质量分数(2.5%、 5%、 10%、 15%)对冻干粉外观、含水率、再分散性及冻干后包封率、粒径的影响,结果见表6。
由表6可知,复合冻干保护剂溶液质量分数为10%和15%时,冻干粉外观、含水率、再分散性良好,相比表3中使用单一冻干保护剂D-海藻糖、蔗糖、甘露醇时,平均粒径变化不大,但包封率有所提高。而溶液质量分数为15%时,可能由于糖含量较高,且其本身属于无定形保护剂,冻干时结晶产生了少量的大颗粒,复溶时出现浑浊,导致再分散时效果不好[13,23-24]。因此,综合考虑,选择冻干保护剂溶液质量分数为10%。
2.2.4验证实验 按照1.3节工艺制备HT纳米脂质体脂悬液,-50 ℃下速冻8 h,冻干72 h,冻干保护剂为m(D-海藻糖)∶m(蔗糖)∶m(甘露醇)=4∶2∶1,溶液质量分数为10%,制备3份HT纳米脂质体冻干粉,结果表明:冻干粉外观松散、光滑、平整饱满(外观+++),振荡1 min内能复溶成均匀悬浮液且无不溶颗粒或团块(再分散性+++),含水率3.28%±0.23%,平均粒径(125.24±1.58) nm,包封率69.74%±0.94%,RSD值分别为2.15%、 1.94%、 2.21%,均小于5%,表明该工艺较为稳定可靠。
2.2.5微观结构分析 由HT纳米脂质体冻干粉复溶后用透射电镜(TEM)观察其微观结构,结果见图1。由图可知,冻干粉复溶后纳米粒子外观圆整、表面光滑、大小均一,可清晰观察到磷脂双分子层结构,说明HT纳米脂质体冻干粉复溶后脂质体形态未发生明显改变,利用冷冻干燥工艺延长HT纳米脂质体的贮藏期效果是可靠的。

a.1μm; b.200 nm; c.100 nm
2.3 贮藏稳定性评价
在上述优化工艺条件下制备HT纳米脂质体冻干粉,分别在不同温度(4、 25 ℃)下、贮藏不同时间(0、 3、 6、 9和12个月)后,考察其外观、含水率、颜色、再分散性、平均粒径和包封率的变化,结果见表7。

表7 贮藏温度和贮藏时间对HT纳米脂质体冻干粉稳定性的影响
由表可知,低温下冻干粉的贮藏效果均优于同等条件时室温下的贮藏效果,但随着贮藏时间的延长,冻干粉的外观逐渐显现出塌陷的现象,且略微变红,这可能是由于HT泄露或者未被包埋的HT经过长时间的贮藏而被氧化所致;随着贮藏时间的延长,冻干粉的再分散性也受到了影响,这可能是由于贮藏过程中难以避免的轻微吸水、受潮导致的;由于再分散性的影响,导致粒径也随着贮藏时间的延长逐渐变大;此外,由于HT的氧化和泄露问题导致包封率也逐渐减小。分析可知,4 ℃下贮藏6个月时,HT纳米脂质体冻干粉稳定性较好,性能没有明显变化。
3 结 论
3.1考察了HT纳米脂质体脂悬液的冷冻干燥工艺,试验结果表明:-50 ℃下速冻8 h,冷冻干燥72 h,所得的冻干粉外观、再分散性较好。
3.2通过正交试验对冻干保护剂进行筛选,结果表明:当m(D-海藻糖)∶m(蔗糖)∶m(甘露醇)=4∶2∶1且溶液质量分数为10%时,所制备的HT纳米脂质体冻干粉的外观、含水率、再分散性良好,粒径和包封率均可达到较好的效果。复溶后观察其TEM微观结构发现:该纳米粒子外观圆整、表面光滑、大小均一,可清晰观察到磷脂双分子层结构,即利用冷冻干燥工艺延长HT纳米脂质体的贮藏期效果是可靠的。
3.3将HT纳米脂质体冻干粉在低温和室温下贮藏不同时间,通过外观、含水率、颜色、再分散性、平均粒径和包封率的变化考察其稳定性,结果表明:低温更利于HT纳米脂质体冻干粉的稳定贮藏。

