雪松松针多糖的醇沉、脱蛋白工艺及抗氧化活性研究
马趣环, 王 信, 石晓峰, 沈 薇, 范 彬, 王新娣
(1.甘肃省医学科学研究院,甘肃 兰州 730050; 2.甘肃中医药大学,甘肃 兰州 730000)
药用松针是松科植物多个品种针状叶的统称,始载于《名医别录》,被列为上品,《本草纲目》对其亦有记载[1],气味苦、温、无毒,久服令人不老,轻身益气,主风湿疮,生毛发,安五脏,守中,不饥延年。在东亚地区,松针也被制成松针粉、松针酒、松针茶等[2],这种做法与药王孙思邈创立的自然养生之“服松针法”相符。雪松是松科植物雪松属(Cedrus)常绿乔木[3],其针叶药用历史悠久,主要化学成分为挥发油、黄酮类、苯丙素类、有机酸类、三萜类、甾体类、多糖及针叶胶类等[4]。有关雪松松针多糖的研究甚少,仅见葛霞等[5]水提法提取雪松松针多糖和本课题组前期优化雪松松针多糖提取工艺的报道[6]。多糖是生命有机体的重要组成成分,为糖苷键连接起来的醛糖或酮糖组成的高聚物,大量存在于高等植物、动物细胞膜以及微生物细胞壁中,具有促进和调节机体免疫、抗肿瘤、抗自由基活性和抗氧化、抗衰老、抗病毒、调节血脂血糖、抗辐射等作用[7-8]。为了对雪松松针多糖进行深入探索与开发,本研究对雪松松针多糖醇沉、脱蛋白工艺条件进行了筛选,并对纯化后的多糖的抗氧化活性进行了体外评价。
1 实 验
1.1 材料与仪器
雪松松针于2016年6月采自甘肃省兰州市滨河路,经甘肃省医学科学研究院何福江研究员、石长栓副研究员鉴定为雪松属植物雪松Cedrusdeodara(Roxb.ex D.Don)G.Don的针叶。
D-(+)-无水葡萄糖对照品(批号MUST-14072601),中国科学院成都生物研究所提供;考马斯亮蓝G-250,中国医药公司北京采购供应站;牛血清白蛋白(BSA),生物工程(上海)股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二-3-乙基-苯并噻唑-6-磺酸(ABTS),美国Sigma公司;2,6-二叔丁基-4-甲基苯酚(BHT),天津市凯信化学工业有限公司;抗坏血酸(Vc),国药集团化学试剂有限公司;其他试剂均为分析纯,苯酚为重蒸苯酚,水为蒸馏水。
UV-1800型紫外可见分光光度计,日本岛津公司;AE-260型万分之一分析天平;CP225D型十万分之一电子分析天平;SK3310LHC超声清洗仪器,上海科导超声仪器有限公司。
1.2 雪松松针多糖醇沉工艺优化
1.2.1多糖粗提液的制备 参考文献[9]的方法,称取阴干粉碎后的雪松松针(粒径≤450 μm)80 g,置于圆底烧瓶中,首次提取按液料比13∶1(mL∶g,下同)加入蒸馏水,第2次提取按液料比10∶1加入蒸馏水,回流提取2次,每次120 min。过滤,合并滤液,浓缩至1 600 mL,得到雪松松针多糖的粗提液。
1.2.2多糖一级醇沉工艺的优化
1.2.2.1单因素试验 将粗提液250 mL分成5等份,分别按粗提液体积和松针干质量的比例(浓缩比)1∶1、 2∶1、 3∶1、 4∶1和5∶1(mL∶g,下同)进行减压浓缩,再将每份浓缩液分成3等份,置于250 mL的三角瓶中,加入适量无水乙醇至乙醇体积分数70%,密封,室温静置醇沉12 h,3 000 r/min离心15 min,弃去上清液,沉淀用15 mL的70%乙醇洗涤,离心收集沉淀,水浴挥去残存乙醇后,于60 ℃烘干,称量,计算粗多糖得率,分析粗提液浓缩比对雪松松针多糖得率的影响[10]。在粗提液浓缩比为3∶1,醇沉时间12 h,乙醇醇沉体积分数分别为40%、 50%、 60%、 70%、 80%的条件下,计算粗多糖得率,分析醇沉体积分数对多糖得率的影响。在粗提液浓缩比为3:1,醇沉时间12 h,乙醇醇沉体积分数为71%,浓缩液温度分别为20、 40、 60和80 ℃的条件下,计算粗多糖得率,分析浓缩温度对多糖得率的影响。在粗提液浓缩比为3∶1,乙醇醇沉体积分数为71%,浓缩液温度分别为40 ℃,醇沉时间分别为4、 8、 12、 24和36 h的条件下,计算粗多糖得率,分析醇沉时间对多糖得率的影响。
1.2.2.2响应面分析法 根据单因素试验结果,固定浓缩温度为40 ℃,利用Box-Behnken中心组合对浓缩比、醇沉体积分数及醇沉时间进行3因素3水平的试验设计,依据响应面结果分析确定松针多糖最佳的一级醇沉工艺参数[10-12]。
1.2.3多糖二级醇沉体积分数的筛选 按优选的一级醇沉参数,将雪松松针粗提液浓缩,加入无水乙醇至相应的醇体积分数,摇匀,静置,离心,收集上清液,再按浓缩比1∶1浓缩,浓缩液分成5等份,分别加无水乙醇至醇体积分数分别为50%、 60%、 70%、 80%、 90%,其余操作同1.2.2.1节,以多糖得率为指标,优选二级醇沉体积分数。
1.3 雪松松针多糖脱蛋白工艺优化
1.3.1Sevage法脱蛋白 吸取二级醇沉得到的质量浓度为0.023 g/mL的雪松松针多糖溶液20 mL,加入一定体积Sevage试剂(氯仿/正丁醇体积比4∶1),振荡30 min,在6 000 r /min 下离心15 min,弃去下层有机相和中间蛋白质层,按此法脱蛋白3次,收集上清液,测定上清液中多糖和蛋白质的含量,计算多糖损失率和蛋白质清除率[13-14],以此考察合适的Sevage试剂用量,实验中多糖溶液与Sevage试剂的体积比分别为0.5∶1、 1∶1、 2∶1和3∶1。确定最佳Sevage法脱蛋白的条件后,以50 mL质量浓度0.023 g/mL雪松松针多糖溶液进行后续实验。
1.3.2三氯乙酸(TCA)法脱蛋白 吸取二级醇沉得到的质量浓度为0.023 g /mL的雪松松针多糖溶液20 mL,加入160 g/L TCA 20 mL,振荡30 min,4 ℃条件下放置12 h后,6 000 r /min 离心10 min,收集上清液。上清液用NaOH 调至中性后,测定上清液中多糖和蛋白质的含量,并计算多糖损失率和蛋白质清除率。
1.3.3脱蛋白次数的考察 吸取二级醇沉得到的质量浓度为0.023 g /mL的雪松松针多糖溶液20 mL,5份,按照1∶1的体积比加入Sevage试剂,分别给予1、 2、 3、 4、 5次脱蛋白,计算蛋白质清除率。
1.4 验证试验及计算
1.4.1多糖含量及损失率测定 称取雪松松针3份,每份300 g,按优选得到的一级、二级醇沉参数和脱蛋白工艺条件操作,冷冻干燥得纯化后的精制雪松松针多糖,采用苯酚-硫酸法[11]测定其多糖含量。
以葡萄糖质量浓度(C,g/L)为横坐标,以吸光度(A)为纵坐标,绘制标准曲线,得线性回归方程A=27.114C+0.042 3(R2=0.999 3)。精密吸取供试品溶液适量,置于具塞试管中,用蒸馏水补体积至2.00 mL,然后加入质量分数为6%的苯酚溶液1 mL,于冰水浴中加入5 mL硫酸,振荡,摇匀,于40 ℃水浴30 min,取出,放入冰水浴中终止反应。于488 nm测定A,代入标准曲线回归方程计算样品中多糖的质量,按式(1)计算多糖损失率。
x=(m1-m2)/m1×100%
(1)
式中:x—多糖损失率,%;m1—处理前多糖质量,mg;m2—处理后多糖质量,mg。
1.4.2蛋白质的含量及清除率测定 采用考马斯亮蓝法[15],精密称取BSA 25.5 mg,加水溶解并定容于25 mL容量瓶中,然后精密吸取BSA溶液0、 0.05、 0.10、 0.15、 0.20、 0.25 mL,分别置于具塞试管中,用蒸馏水补充体积至1.50 mL,配制成系列质量浓度的BSA对照品溶液。然后加入考马斯亮蓝溶液5 mL后,摇匀,静置5 min,于595 nm测定A。以C为横坐标,以A为纵坐标,绘制标准曲线,得线性回归方程:A=5.924C+0.097(R2=0.999 0)。于595 nm测定A,代入标准曲线回归方程计算样品中蛋白质的质量,按式(2)计算蛋白清除率。
y=(m3-m4)/m3×100%
(2)
式中:y—蛋白质清除率,%;m3—处理前蛋白质质量,mg;m4—处理后蛋白质质量,mg。
1.5 雪松松针多糖抗氧化性能的评价
1.5.1溶液的配制 精密称取纯化后雪松松针一级、二级醇沉多糖各40.00 mg,用水溶解并定容至10 mL容量瓶中,即得供试品溶液。
精密称取Vc 20 mg,用水溶解并定容至5 mL容量瓶中,即得Vc对照品溶液。精密称取BHT 10 mg,用无水乙醇溶解并定容至10 mL容量瓶中,即得BHT对照品溶液。精密称取DPPH试剂8 mg,用无水乙醇溶解并定容于100 mL容量瓶中,即得DPPH自由基(DPPH·)溶液。精密称取ABTS试剂0.192 2 g,用水溶解并定容至100 mL棕色容量瓶中作为A液;精密称取过硫酸钾0.067 6 g,用水溶解并定容至100 mL棕色容量瓶中作为B液;然后按2∶1的体积比将A液、B液混匀,避光12 h,备用。临用前用无水乙醇稀释至吸光度为0.6±0.1,即得ABTS自由基(ABTS·)工作液。
1.5.2清除DPPH·活性 将供试品溶液及对照品Vc、BHT溶液稀释成系列浓度0.4、 0.8、 1.2、 1.6、 2.0、 2.4、 2.8 g/L的溶液,然后分别精密移取这一系列质量浓度的供试品溶液及Vc、BHT对照品溶液各1 mL于10 mL的比色管中,各加DPPH·溶液2 mL,再加50%乙醇2 mL,摇匀,室温避光反应30 min,在517 nm处测定吸光值(A1),同时以无水乙醇为参比测定DPPH·空白溶液吸光度值(A0),平行实验3次,按式(3)计算清除率[16]。
C=(A0-A1)/A0×100%
(3)
式中:C—自由基清除率,%;A0—参比吸光值;A1—样品吸光值。
1.5.3清除ABTS·活性 将供试品溶液及对照品Vc、BHT溶液稀释成系列质量浓度40、 80、 120、 160、 200 mg/L的溶液,然后分别精密移取这些供试品溶液及Vc、BHT对照品溶液各1 mL于10 mL的比色管中,各加ABTS·工作液3 mL,摇匀,放置10 min后,在734 nm处测定A1,同时以40%乙醇为参比测定ABTS·工作液空白溶液的A0,平行实验3次,按式(3)计算清除率[16]。
2 结果与讨论
2.1 雪松松针多糖醇沉工艺条件的优化
2.1.1单因素试验结果 雪松松针多糖一级醇沉的单因素结果见图1。
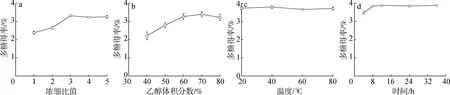
a.浓缩比concentration ratio; b.乙醇体积分数alcohol volume fraction; c.温度temperature; d.醇沉时间alcohol precipitation time
由图1(a)可知,浓缩比为1∶1~3∶1时,样品中的多糖得率逐渐增大,浓缩比值为3时多糖得率最大,之后略有下降,为此选择3∶1作为最佳浓缩比。由图1(b)可知,多糖得率随乙醇体积分数增加而增大,当乙醇体积分数为70%时其多糖得率最大,当乙醇体积分数为80%时多糖得率略有降低,因此选择70%为最佳醇沉体积分数。由图1(c)可知,浓缩液温度较低时多糖的得率较高,20 ℃与40 ℃没有显著差异,因此选择40 ℃为适宜的温度。由图1(d)可知,多糖得率随醇沉时间延长而增多,8 h后基本没有大的变化,故选择8 h为最佳醇沉时间。
2.1.2响应面分析法试验结果 根据单因素试验结果得出雪松松针多糖一级醇沉最佳条件为:粗多糖提取液浓缩比为3∶1,乙醇体积分数为70%,醇沉温度为40 ℃,醇沉时间为8 h。由于醇沉温度对多糖得率影响较小,故而在此基础上,固定醇沉温度为40 ℃,以浓缩比(A)、醇沉体积分数(B)、醇沉时间(C)为自变量,松针多糖得率(Y)为响应值,利用Box-Behnken中心组合进行3因素3水平的试验设计来确定松针多糖最佳的一级醇沉参数,响应面分析结果见表1及表2。

表1 Box-Behnken 试验设计及试验结果

表2 回归统计分析结果
利用Design-Expert 8.0.6软件对表1实验数据进行回归分析,得到二元多项回归模型为Y=3.83+0.13A+0.051B+0.035C-0.015AB-0.018AC-0.033BC-0.32A2-0.18B2-0.036C2,相关系数R2=0.975 3,说明回归方程拟合情况良好,结果可靠[17]。由表2可知,总回归方程模型的P<0.000 1,表明该模型的拟合度显著,失拟值P=0.271 8>0.05,表明此项没有显著性意义,说明数据没有异常点,可用此模型预测雪松松针多糖的醇沉参数。由表中一次项及二次项的P值可以看出,A、B、C、A2、B2对松针多糖的醇沉得率有显著性影响(P<0.05),交互项及C2项均无统计学意义。由响应面结果可以看出,各因素水平对松针多糖得率的影响大小顺序为:浓缩比>乙醇体积分数>醇沉时间。由表2和表3的分析结果证实试验模型准确可靠,可用于松针多糖的一级醇沉工艺的预测。
利用Design-Expert 8.0.6软件求解方程,得出松针多糖最佳一级醇沉条件为:浓缩比3.18∶1、乙醇体积分数71.00%、醇沉时间9.85 h,在此条件下多糖的理论得率为3.85%。考虑到实验条件的可操作性,将工艺参数调整为:浓缩比3∶1、醇沉体积分数71.00%、醇沉时间10 h。依据调整后的醇沉条件进行验证试验,平行试验3次,计算得多糖的平均得率为3.81%,与预测值相比较低,相对标准偏差为1.03%,表明采用此工艺条件准确可靠,可作为松针多糖的一级醇沉工艺。
2.1.3二级醇沉体积分数的筛选结果 雪松松针多糖二级醇沉体积分数优选结果见图2。由图可知,二级醇沉多糖的得率随乙醇体积分数的增高而增大,当乙醇体积分数为80%时多糖得率为4.49%,与乙醇体积分数90%的4.50%相差不大,为了节约溶剂,故将二级醇沉的乙醇体积分数定为80%。
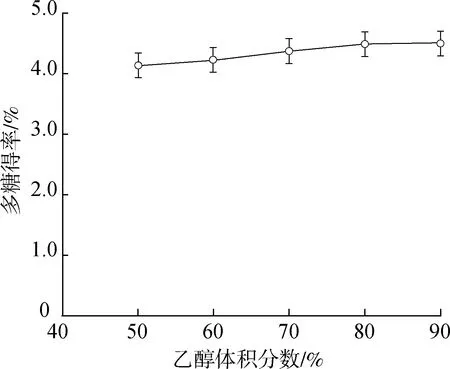
图2 乙醇体积分数对二级醇沉多糖得率的影响Fig.2 Effect of ethanol volume fraction on the polysaccharide yield of secondary alcohol precipitation
2.2 雪松松针多糖脱蛋白的工艺条件
2.2.1Sevage法和TCA法脱蛋白比较 Sevage法和TCA法脱除雪松松针多糖中的蛋白质结果表明:Sevage法蛋白质清除率为86.22%,多糖损失率为10.22%;TCA法蛋白质清除率为84.49%,多糖损失率为22.73%。说明二者蛋白质清除率相当,但Sevage法的多糖损失率较低,故选择Sevage法脱除松针多糖中的蛋白质。
2.2.2Sevage试剂用量的考察结果 由图3可见,随着Sevage试剂用量增大,蛋白质清除率相应增大;当体积比为1∶1~3∶1时,蛋白质清除率几乎相当,故选用1∶1的体积比进行多糖脱蛋白质。

图3 Sevage试剂用量考察结果
2.2.3脱蛋白次数的考察结果 由图4可见,脱除蛋白3次后,蛋白质基本完全脱除,故将脱蛋白次数定为3次。

图4 脱蛋白质次数的考察结果
3份雪松松针按优选得到的一级、二级醇沉参数和脱蛋白工艺条件操作,冷冻干燥得纯化后的精制雪松松针多糖,经UV法测得纯化后一级、二级醇沉多糖的平均质量分数以葡萄糖折算分别为35.36%、 36.62%。
2.3 雪松松针多糖抗氧化性能的评价结果
2.3.1清除DPPH·能力 研究了不同质量浓度的雪松松针多糖、Vc及BHT清除DPPH·的能力,结果见图5(a)。由图可见,质量浓度增至2.0 g/L后,清除DPPH·能力依次为Vc>二级醇沉多糖>BHT>一级醇沉多糖,此时二级醇沉多糖清除DPPH自由基能力稍强于BHT。
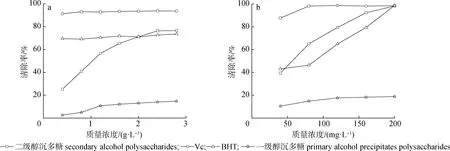
图5 雪松松针多糖对DPPH·(a)及ABTS·(b)的清除能力
2.3.2清除ABTS·能力 不同质量浓度的雪松松针多糖、Vc及BHT清除ABTS·的结果见图5(b),依次为Vc>二级醇沉多糖>BHT>一级醇沉多糖,二级醇沉多糖清除ABTS·能力强于BHT,且当质量浓度为200 mg/L时,清除ABTS·能力与Vc、BHT一致,清除率达到98%以上。
3 结 论
3.1以多糖的得率为指标,在单因素试验的基础上,利用响应面Box-Behnken模型对影响雪松松针多糖醇沉的关键因素进行考察,最终确定雪松松针多糖最佳一级醇沉工艺为粗提液体积和松针干质量的比例(浓缩比)为3∶1,乙醇体积分数71%,醇沉温度40 ℃,醇沉时间10 h,此条件下多糖得率为3.81%。收集多糖一级醇沉后的上清液再按1∶1的比例浓缩,筛选得到二级醇沉的较优条件为乙醇体积分数80%,此条件下的多糖得率为4.50%。
3.2以蛋白质清除率和多糖损失率为指标,比较了Sevage法和三氯醋酸(TCA)法对松针多糖的脱蛋白效果,结果表明:Sevage法脱蛋白效率优于TCA法,其最佳条件为Sevage试剂与多糖溶液的体积比为1∶1,脱除蛋白次数为3次。
3.3试验确定的雪松松针多糖的醇沉、脱蛋白工艺条件,经3批试验验证合理可行;UV法测脱蛋白后的一级、二级醇沉多糖平均质量分数以葡萄糖折算分别为35.36%、 36.62%。
3.4雪松松针多糖具有DPPH自由基、ABTS自由基的清除能力,其中纯化后的雪松松针80%醇沉多糖表现出良好的抗氧化活性。

