骨质疏松症患者腰椎椎体骨髓脂肪分数、腰肌指数与骨密度的相关性分析
武扬平
(贵阳市第四人民医院医学影像科 贵州 贵阳 550001)
骨质疏松症是一种骨骼疾病,其特征是骨密度减少和骨质变薄,使骨骼变得脆弱和易碎,这种疾病常常被称为“脆骨病”[1]。产生骨质疏松症主要因素包括年龄、性别、遗传因素、生活方式和营养状况。女性在更年期后由于雌激素水平下降会导致骨骼密度减少更容易患上骨质疏松症,另外长期使用激素类药物和抗癫痫药物等药物、吸烟、酗酒、缺乏运动、低钙摄入和维生素D 缺乏都会导致此病的发生[2]。患有骨质疏松症后骨折的风险极大增加,由于骨骼变得脆弱和易碎,轻微的撞击或摔倒也可能导致髋部、脊椎和手腕等部位骨折。不仅会给患者带来疼痛和不便,还可能致残、丧失生活质量,并增加死亡风险。骨质疏松症还可能导致身高变低、驼背、腰背疼痛和体态不良等问题,也可能影响内脏器官,如胃肠道、肺部和心脏等,从而增加患者的整体健康风险[3]。骨密度(bone mineral density,BMD)是指骨骼中的矿物质含量,是评估骨骼健康和骨质疏松风险的重要指标,常见的骨密度测量方法是双能X 射线吸收法(dual-emission X-ray absorptiometry,DXA)和计算机断层扫描(CT),但DXA 存在一定片面性,CT 辐射剂量较高,可能对个体的健康有一定风险[4]。研究表明,人体骨量减少,骨髓中脂肪组织会逐渐增加,腰椎椎体骨髓脂肪分数(fat fraction,FF)与骨质疏松具有十分紧密的联系,测量此水平或成为评估骨质疏松的重要指标[5]。腰大肌对人体活动中起着重要作用,随着年龄的增长,腰大肌的横截面积会逐渐减少,腰大肌的横截面积减少会影响到髋关节的功能和稳定性,增加受伤和骨质疏松的风险,腰肌指数(psoas muscle index,PMI)作为非侵入性、测量简单的指标,可以在临床上用于评估个体的整体肌肉状况和骨骼状态[6]。本研究通过检测骨质疏松症患者PMI、腰椎椎体骨髓FF 指标水平,分析其与BMD 的关系与相关性,或可为评估骨质疏松提供参考。
1 资料与方法
1.1 一般资料
采用简单便利法选取2022 年5 月—2023 年5 月行DXA、腰椎椎体骨髓FF、PMI 检查的28 例骨密度降低患者(骨量减少组)及39 例骨质疏松患者(骨质疏松组)为研究对象,纳入标准:①符合《原发性骨质疏松症诊疗指南(2017)》[7]诊断标准,即T 值(被测者的骨质密度与正常的同性别年轻人骨峰值的差别)≥-1.0表示骨量正常、-2.5 <T 值<-1.0 表示骨量减少、T值 ≤-2.5 表示骨质疏松;②具有骨质疏松相关高危因素,包括遗传因素(甲状旁腺功能亢进、类风湿关节炎等疾病),钙摄入不足,过量饮酒,长期大量喝咖啡,吸烟史;③年龄>40 岁;④行DXA、腰椎椎体骨髓FF、PMI 检查;⑤无心理障碍、心理疾病史者及表达障碍;⑥研究对象知晓研究内容并自愿签署研究知情同意书。排除标准:①配合度较差或中途退出研究者;② 其他骨质疾病,如骨髓瘤、骨转移瘤、骨软化症等;③长期使用糖皮质激素等激素类药物;④进行过腰椎手术者;⑤腰椎体骨折、变形,身体金属植入物。另选取同期入院体检的骨密度正常的健康体检者22 名(骨量正常组)作为对照,三组年龄、体质量、身高、腰围、臀围、受教育年限等对比差异无统计学意义(P>0.05)。见表1。
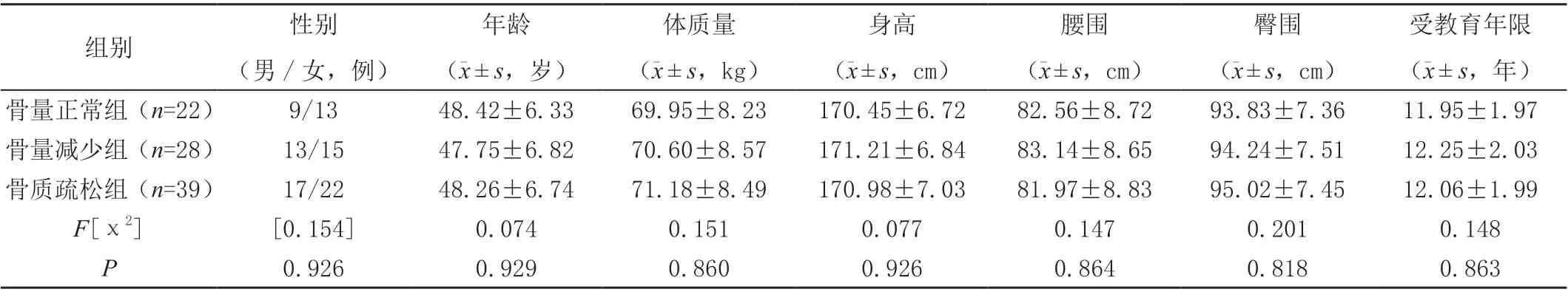
表1 三组一般资料比较
1.2 方法
DXA 检查:患者穿着轻便舒适的衣物,去除金属饰品,平躺于X 射线台上,使脊椎与台面贴合平行,采用法国迈迪有限公司双能X 射线骨密度仪MEDIX90 扫描患者腰椎L1 ~L4 椎体并检测BMD的T 值。
腰椎椎体骨髓FF 检查: 采用荷兰飞利浦Ingenia3.0T 核磁共振仪,分析扫描形成的MRI 图像,并计算出腰椎椎体骨髓脂肪分数。
PMI 检查:采用GE 医疗X 射线计算机体层摄影设备RevolutionACTs,手动追踪检测双侧腰肌横截面积,检测腰大肌横截面面积。PMI= 腰肌围面积/身高2。
1.3 观察指标
①对比三组BMD、PMI、腰椎椎体骨髓FF 的检查结果。②分析PMI、腰椎椎体骨髓FF 与BMD 的相关性。
1.4 统计学方法
采用SPSS 21.0 统计软件进行数据分析,符合正态分布的计量资料以均数±标准差(± s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;计数资料以频数(n)、百分率(%)显示,采用χ2检验;采用Pearson 相关系数评价腰椎椎体骨髓FF、PMI 与BMD 的关系,以P<0.05 为差异有统计学意义。
2 结果
2.1 三组BMD、PMI、腰椎椎体骨髓FF 比较
三组BMD、PMI、腰椎椎体骨髓FF 水平比较差异有统计学意义(P<0.05);骨质疏松组BMD、PMI 明显低于骨量减少组、骨量正常组,腰椎椎体骨髓FF 显著高于其余两组(P<0.05);骨量减少组BMD、PMI 明显低于骨量正常组,腰椎椎体骨髓FF 显著高于骨量正常组(P<0.05)。见表2。
表2 三组BMD、PMI、腰椎椎体骨髓FF 对比(± s)

表2 三组BMD、PMI、腰椎椎体骨髓FF 对比(± s)
注:骨质疏松组、骨量减少组与骨量正常组比较,①P<0.05;骨质疏松组与骨量减少组比较,②P<0.05。
腰椎椎体骨髓FF%骨量正常组(n=22) -0.56±0.137.16±1.1341.59±7.76骨量减少组(n=28) -1.54±0.366.24±1.2154.29±8.91骨质疏松组(n=39)-3.35±0.41①② 5.01±1.19①② 62.70±9.68①②F 511.73224.68738.752 P<0.001<0.001<0.001组别BMD g/cm3 PMI mm2/m2
2.2 PMI、腰椎椎体骨髓FF 与BMD 的相关性
Pearson 相关性分析显示,腰椎椎体骨髓FF 与BMD呈负相关,PMI 与BMD 呈正相关(P<0.05)。见表3。
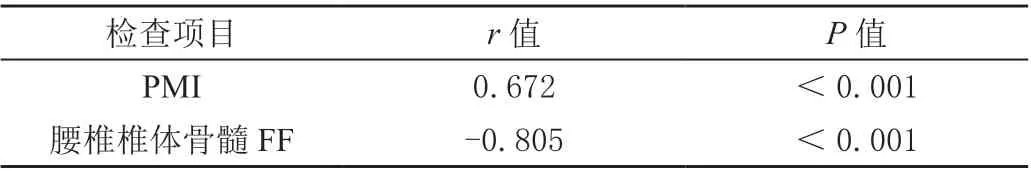
表3 PMI、腰椎椎体骨髓FF 与BMD 的相关性
3 讨论
在临床中骨质疏松表现为骨组织显微结构退变、骨小梁数量减少、骨脆性、骨折风险增加,同时骨质疏松也是导致脊椎变形、腰背疼痛、骨折的主要原因,该疾病的发生与性别、年龄等有着密切关系,伴随着年龄增加,骨骼钙质的流失,骨质疏松的发生风险也会增加[8]。骨质疏松临床表现有腰背痛、骨痛等,不仅增加自发骨折发生风险,同时也降低人体免疫功能,发病后生活质量明显下降,甚至危及生命安全。BMD 是诊断骨质疏松的主要根据,正确判断BMD 含量对骨质疏松的诊治有着重要意义。DXA 和CT 为诊断BMD 的主要手段。腰椎DXA 检查是一种常用的用于评估骨密度的非侵入性检查方法,其准确性较高。但也存在一些缺点,该方法是平面维度测量方法,会被骨骼厚度等所影响,而且这种方法无法区分骨质和软组织的质量,因此可能会导致测量误差,老年人和肥胖人群误差更为明显。此外DXA测量结果可能会受到骨骼畸形或骨折等骨骼形态变化的影响[9];CT 检查辐射剂量较高,特别是对于多次扫描的人群伤害较大,CT 产生的电离辐射可能会对细胞结构破坏,如对体内的白细胞造成损伤,使得人体免疫功能受到影响,产生血液、免疫疾病。CT 成像需要较长的扫描时间,部分患者难以耐受[10]。采用或联合其他与评估BMD 含量相关性较高的方法,提高骨质疏松的诊断效能,仍然是目前各学者临床研究的重点。
腰椎椎体骨髓FF 检查是一种用于评估骨髓脂肪含量的方法,通常用于研究骨骼健康和骨质量。脂肪细胞和成骨细胞都起源于骨髓间充质干细胞。在正常情况下,骨髓中的间充质干细胞可以分化为成骨细胞,促进骨质生成和骨骼健康,然而当成骨和成脂分化的稳态失衡时,会导致骨髓中的脂肪细胞增多,骨质生成减少,这是骨质疏松等骨骼疾病的主要病理机制之一。腰椎椎体骨髓FF 检测可以直接计算骨髓中的脂肪含量,这种方法可以从侧面提供客观反映整体骨量变化的信息,从而为骨骼疾病的诊断和治疗提供重要的参考[11-12]。本研究结果显示,骨量正常、骨量减少、骨质疏松组三组BMD、PMI、腰椎椎体骨髓FF 水平比较差异有统计学意义(P<0.05);骨质疏松组BMD、PMI 明显低于骨量减少组、骨量正常组,腰椎椎体骨髓FF 显著高于其余两组(P<0.05),表明骨质疏松人群对于较为健康人群的骨密度和肌肉含量较低,而腰椎椎体骨髓FF 水平较高。本研究通过Pearson 相关性分析显示,腰椎椎体骨髓FF 与BMD 呈负相关,PMI 与BMD 呈正相关(P<0.05),进一步表明测量腰椎椎体骨髓FF 与PMI 可侧面反映骨密度含量,从而诊断骨质疏松疾病。大量研究骨质疏松患者骨密度和骨髓FF 的结果表明,骨质疏松与骨髓脂肪含量之间存在密切的关联,人类长期活动中,骨小梁的变薄和连接中断会导致骨质疏松的发生,同时也为脂肪组织提供了填充的空间,因此,当骨质疏松程度加重时,骨髓脂肪含量也会相应增加,并呈现骨量与骨髓脂肪含量负相关的特点[13-14]。腰大肌位于腰椎区域,与骨骼肌之间存在密切的关系,腰大肌可稳定腰椎和骨盆运动,一定程度可反映全身骨骼肌的含量。骨骼肌是与骨骼系统紧密相连的肌肉组织,它对维持骨骼健康和功能至关重要。骨骼肌的运动和负荷可以刺激骨骼生长和骨密度的增加。当骨骼肌受到负荷刺激时,会产生力量和张力,这些力量会传递到骨骼刺激骨细胞的活动,促进骨骼的生长和重塑;其次,骨骼肌的力量和功能可以提供支撑和保护骨骼,减少骨骼受力的压力;同时,骨骼肌的收缩和运动可以帮助维持骨骼的稳定性,减少骨折和骨损伤。随着年龄的增长和缺乏运动,骨骼肌的质量和功能可能会下降,对骨骼的刺激和保护减少,增加骨骼的负担,进而导致骨密度降低和骨质疏松的发生和发展,因此骨质疏松患者骨量与PMI 表现为正相关的关系[15-16]。
综上所述,腰椎椎体骨髓FF、PMI 与BMD 含量的密切相关,应用PMI 和腰椎椎体骨髓FF 两个指标,或对于临床上诊断骨质疏松症有重要的应用价值。

