芦丁在大鼠体内的代谢产物鉴定与代谢途径分析
王常瞵 高明周 郭英慧 孙亚 于小钧 闫志 王杰琼 乔明琦
摘要:分析大鼠口服芦丁后血浆、尿液和粪便中的代谢产物并评价芦丁在大鼠体内的代谢途径。大鼠灌胃给予250 mg/kg[JP]芦丁后,采集血浆、尿液和粪便,以固相萃取法处理生物样品,利用超高效液相色谱-四级杆-静电场轨道阱质谱,以0.05%甲酸水(A)-0.05%甲酸乙腈(B)为流动相梯度洗脱,分别在正、负离子模式下采集各样品数据,通过高分辨提取离子流图和平行反应监测模式,结合色谱保留时间、质量测量、诊断离子等确定芦丁的代谢物并探究芦丁在大鼠体内的代谢途径。在正、负离子模式下共检测和鉴定了29种芦丁代谢产物,其主要代谢途径为甲基化、葡萄糖醛酸化、硫酸酯化及其复合反应等。建立了芦丁的整体代谢图谱,为其进一步的药效学评价及开发利用提供了参考依据,同时也为药物代谢鉴定研究提供了一种综合研究方法。
关键词:芦丁;超高效液相色谱-四级杆-静电场轨道阱质谱;代谢产物;代谢途径
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2023)05-0009-08
Identification of rutin metabolites and analysis of rutin metabolic pathway in rats
WANG Changlina,GAO Mingzhoub, GUO Yinghuia, SUN Yab, YU Xiaojunc, YAN Zhic, WANG Jieqiongc*, QIAO Mingqia*
(a. School of Traditional Chinese Medicine; b. Institute of Traditional Chinese Medicine Innovation;c. School of Pharmacy,Shandong University of Traditional Chinese Medicine, Jinan 250355, China)
Abstract∶Herein, metabolites in plasma, urine and feces of rats were analyzed after oral administration of rutin and the metabolic pathway of rutin was evaluated. After intragastric administration of 250 mg/kg rutin, plasma, urine, and feces were collected and treated via solid phase extraction. Ultra-high performance liquid chromatography-Q Exactive hybrid quadrupole-orbitrapmass spectrometry (UPLC-Q-Orbitrap MS) was used with 0.05% formic acid water (A)-0.05% formic acid acetonitrile (B) as mobile phase gradient elution. The sample data were collected in positive- and negative-ion modes. The metabolites and metabolic pathway of rutin in rats were determined via high resolution extraction ion chromatography in the parallel reaction monitoring mode, combined with chromatographic retention time, accurate mass measurement and diagnostic ions.Twenty-nine rutin metabolites were detected and identified in positive and negative ion modes,and their main metabolic pathways were methylation, glucuronidation, sulfation and their compound reaction. The study provided the overall metabolic profile of rutin, which will provide a reference for further pharmacodynamic evaluation, development, and utilization in the future and offer a comprehensive research method for drug metabolism identification.
Key words∶rutin; UPLC-Q-Orbitrap MS; metabolites; metabolic pathways
蘆丁又称为芸香苷,是一种天然的黄酮苷,广泛分布于自然界,尤以豆科植物的槐米、芸香科植物的芸香草等含量较高,常作为提取芦丁的原料[1]。芦丁具抗氧化、止血、抗癌、抗炎、抗菌、神经保护等多种药理活性[2-3],在治疗糖尿病、低脂血症和各种肿瘤方面也显示出优势[4-5]。芦丁在肠道中吸收较差,但口服后可被肠道菌群大量降解[6]。基于这一事实,我们推测芦丁在体内代谢,主要以代谢物的形式产生多种生物活性。代谢物的某些活性可能高于母体化合物,如研究发现芦丁代谢产物比母体化合物具有更强的抗血小板活性和细胞毒作用[7]。可以肯定的是,代谢产物在发挥药理作用中起着重要的作用。周鹏飞等[8]通过体外实验观察人肠道菌群对芦丁代谢的情况,认为可能的代谢途径有两种: 一种是糖苷键断裂转化为槲皮素,槲皮素经代谢转化为其他成分;另一种是不经槲皮素直接转化为其他物质,这不足以解释芦丁在体内的全面代谢及其相应的代谢途径研究。伍明江等[9]采用UPLC-Q-TOF-MS/MS,在负离子模式下从大鼠血液、尿液、粪便和胆汁中发现了一定数量的芦丁代谢物,但缺乏样品正离子模式的采集。而本研究采用超高效液相色谱-四级杆-静电场轨道阱质谱(UPLC-Q-Orbitrap MS)在正、负离子模式下对样品进行采集,并使用4~5个诊断碎片对体内代谢物进行鉴定,从而增加分析的准确性。在样品处理方面,目前大多数研究采用有机溶剂沉淀法[10-11],而本研究使用固相萃取柱分离纯化样品。研究表明固相萃取材料在用于去除污染物时是极好的[12],样品经固相萃取柱分离后,可避免后续色谱柱堵塞和污染,能够更好地保护色谱柱[13]。
近年来,超高效液相色谱-高分辨质谱联用(UPLC-HRMS)技术成功地应用于对未知化合物的代谢研究[14]。与其他检测仪器相比,UPLC-HRMS 具有分辨率高、质量精度高、质量范围宽、动态范围广等特点,在梓醇、欧前胡素等中药有效成分体内代谢过程分析中发挥着重要的作用[15-16]。本文采用UPLC-Q-Orbitrap MS系统分析了大鼠血液、尿液和粪便中芦丁的代谢产物,探究芦丁在大鼠体内的代谢途径,以期扩大含芦丁类药物的开发利用,并为相关中药的体内代谢研究提供依据。
1 仪器与材料
1.1 实验仪器
Ultimate3000-Q-Exactive静电场轨道阱液质联用仪(美国Thermo Scientific公司);TTL-DCI氮吹仪(北京同泰联科技发展有限公司);SPE C18固相萃取柱(67 mg/mL ,泰州市康之达实验器材有限公司);XS105十万分之一电子天平(瑞士Mettler Toledo公司)。
1.2 实验材料
芦丁(批号GR-137-202005,纯度≥98.0%,南京广润生物制品有限公司);乙腈和甲醇(质谱级,美国ThermoFisher公司);甲酸(色谱级,德国Merck公司)。
1.3 实验动物
本研究所用动物为SPF级健康雄性SD大鼠,共8只,体质量为180~220 g,由北京维通利华实验动物技术有限公司提供,生产许可证号为SCXK(京)2021-0011。
2 实验方法
2.1 溶液的制备
对照品溶液的制备:精密称取芦丁对照品2 mg于10 mL容量品中,加适量甲醇超声使其溶解,甲醇定容至刻度,过 0.22 μm 微孔滤膜,即得。
给药样品溶液的制备:精密称取芦丁对照品250 mg,加入10 mL 0.5%的羧甲基纤维素钠(CMC-Na)溶液配置成混悬液,即得。
2.2 动物实验
所有大鼠适应性喂养7 d后,将其随机分为空白组和药物组,每组4只。实验前禁食12 h,自由饮水。药物组大鼠按250 mg/kg剂量进行灌胃,空白组大鼠给予0.5%CMC-Na溶液(2mL)[15]。
2.3 样品收集与制备
分别于给药后0.5、1、2、4 h从大鼠眼眶静脉丛取血0.5 mL,置于肝素钠抗凝的EP管中,混合均匀,每个样品以3 500 r/min离心15 min,各组分别合并不同时间点所得的上清液,即得血浆样品。同时收集两组大鼠0~24 h的尿样,3 500 r/min 离心15 min后取上清液,即得尿液样品;收集两组大鼠0~24 h的粪便,自然晾干后碾碎,装于离心管中,即得粪便样品[17]。
采用固相萃取法对所有生物样品进行前处理。血浆和尿液样品分别加入预先使用甲醇和去离子水处理过的固相萃取柱中,然后用去离子水(3 mL)和甲醇(3 mL)依次洗涤固相萃取柱(Solid Phase Extraction Column,简称SPE柱),收集甲醇洗脱液,在氮气中室温干燥。残留物用80 μL 10%乙腈重新涡旋溶解,离心30 min(13 500 r/min,4 ℃),将得到的上清液用于后续分析。与此同时,取已干燥粉碎的粪便样品1.0 g,用去离子水(5.0 mL)超声提取15 min后过滤,将上清液加入经过处理的固相萃取柱中,然后进行上述相同的操作,得到的上清液用于进一步的仪器分析[18]。
2.4 液质联用分析条件
色谱条件:Waters ACQUITY UPLC BEHC18色谱柱(100 mm×2.1 mm, 1.7 μm),流速0.3 mL/min,柱温35 ℃;进样量5 μL。流动相为含0.05%甲酸的水(A)和含0.05%甲酸的乙腈(B),梯度洗脱条件为:0~1 min,5% B;1~3 min,5%~40% B;3~13 min,40%~65% B;13~19 min,65%~95% B;19~21 min,95% B;21~23 min,95%~5% B。
质谱条件:检测模式为正离子和负离子模式;离子源参数为氮气(纯度≥99.99%)分别作为鞘气和辅助气体,流速分别为45、10,辅助气流量10 mL/min,裂解电压为3.00 kV;毛细管温度350 ℃,离子传输管温度为320 ℃,辅助器温度为350 ℃;扫描模式:Full MS/dd-MS2;Full MS分辨率为70 000,dd-MS2分辨率17 500;质谱质量扫描范围m/z 80~1 200;碰撞能10、30、50 eV。
2.5 数据处理
收集的数据集由Thermo Xcalbur 2.2工作站记录和处理。为了获得尽可能多的碎片离子,我们选择强度在10 000以上的信号峰来鉴定代谢物。通过设置参数:C[0-30],H[0-35],O[0-20],S[0-5]和环不饱和双键数(RDB)[0-15],用公式预测器计算了选定峰的所有母离子的化学式的准确质量。准确的质量测量设置在(-5~5)×10-6的质量误差内。
3 实验结果
3.1 分析策略的建立
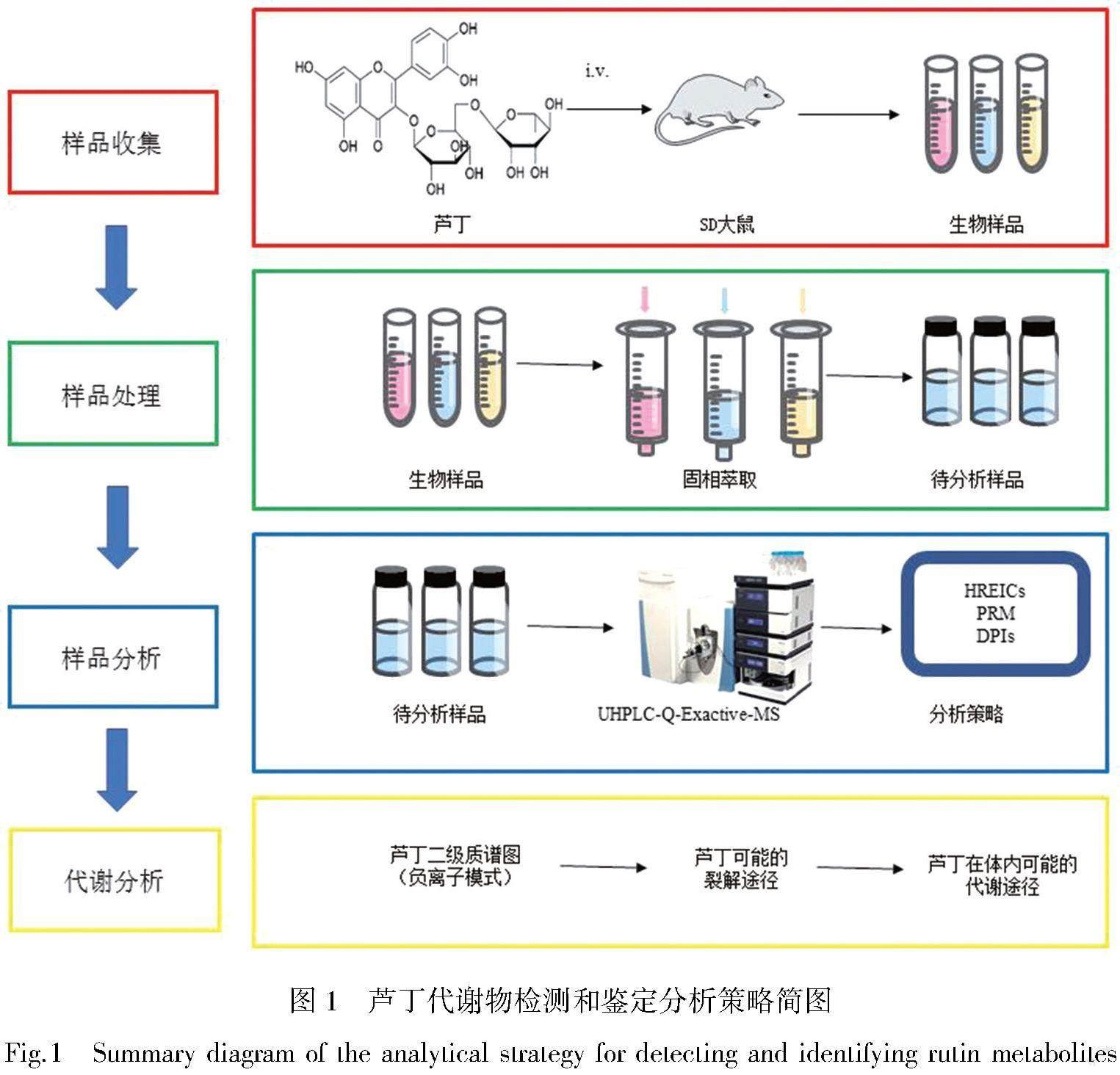
本研究建立了一套系统有效的方法,用于快速分析SD大鼠口服给药后尿液、血浆和粪便中芦丁的代谢谱。当分辨率为70 000时,首先进行全质量扫描。然后将高分辨提取离子流图(HREIC)与平行反应监测模式(PRM)相结合,在正、负离子模式下捕获原始数据中的芦丁代谢物。根据色谱保留时间、准确的质量测量、诊断离子(DPIs)等确定了芦丁的代谢物。最后,根据已鉴定的代谢物提出了芦丁的代谢途径[16]。整个分析过程以简明的示意图显示在图1中。
3.2 芦丁的裂解规律分析
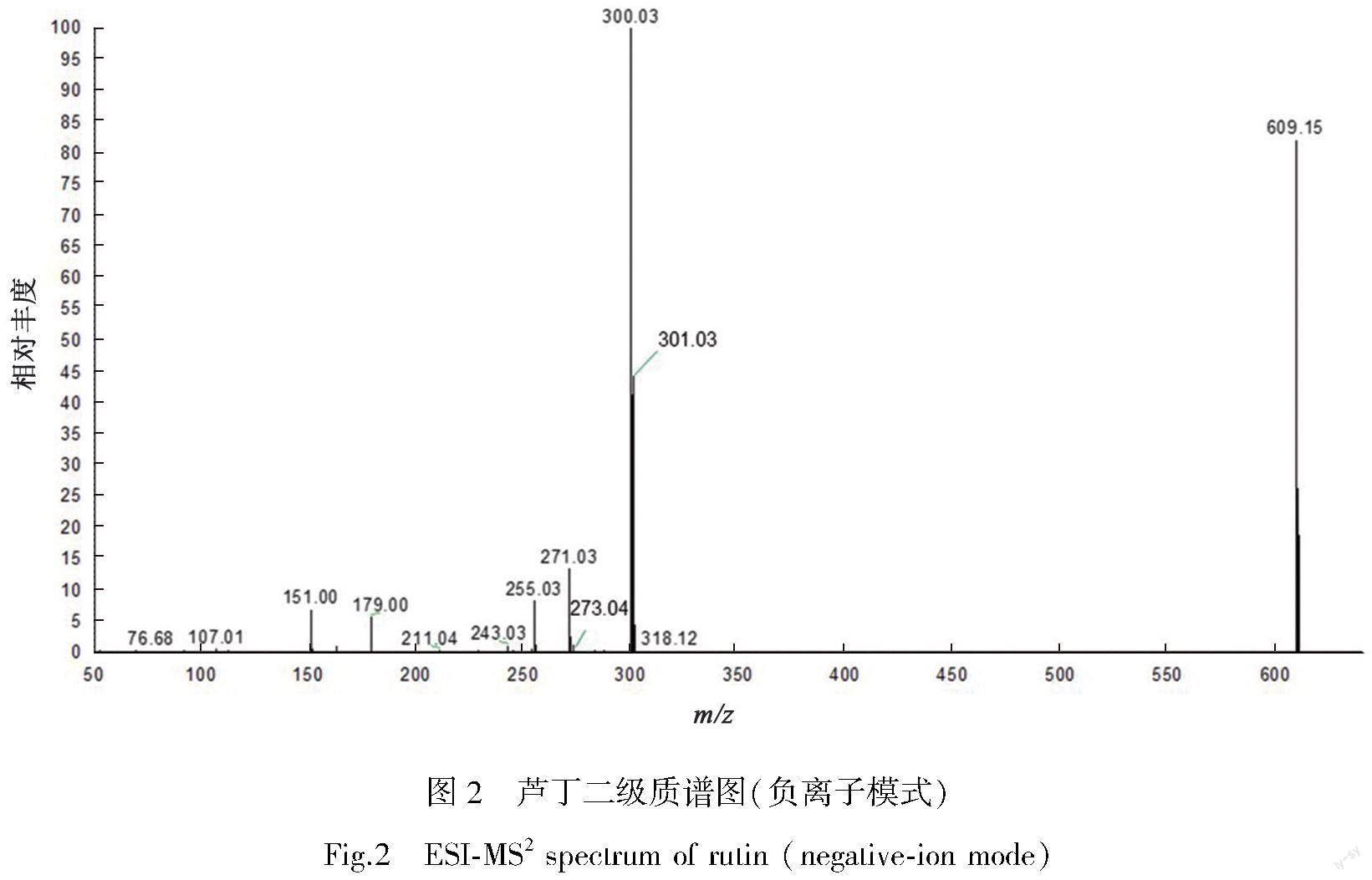
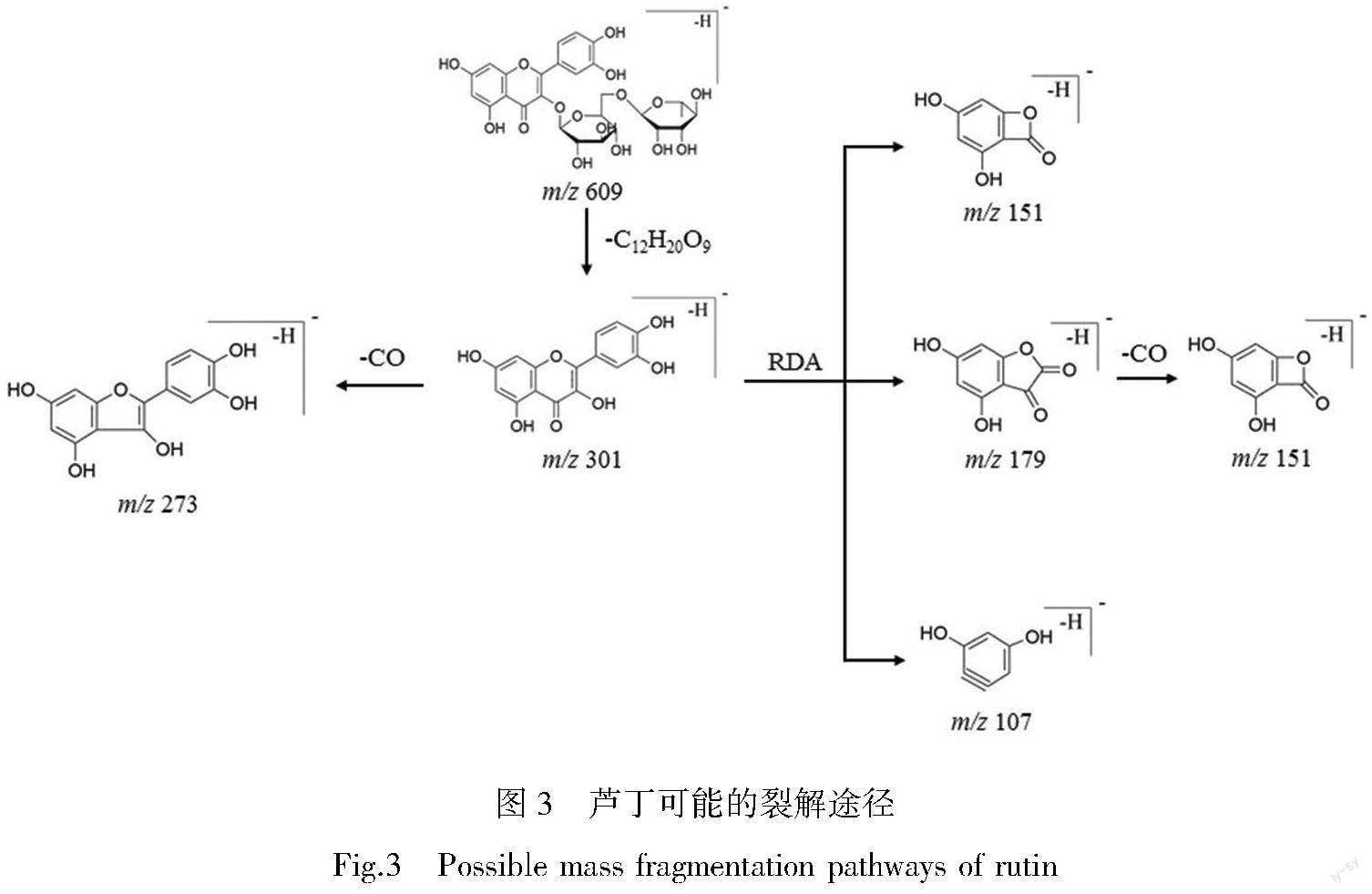
芦丁为黄酮苷类化合物,已有文献报道了该类化合物的质谱裂解规律[19-20]。其主要质谱裂解途径为糖基的中性丢失形成苷元离子[21]以及苷元离子丢失CO和发生C环的RDA裂解[22]。在负离子模式下,芦丁的准分子离子峰为m/z 609.146 48 [M-H]-,二级质谱图中可检测到碎片离子m/z 301,m/z 273,m/z 179,m/z 151,m/z 107,见图2。芦丁可能的裂解途径见图3。芦丁的特征碎片离子为m/z 301,其产生主要源于芸香糖基(C12H20O9)的中性丢失。m/z 301进一步的碎片裂解途径主要包括丢失CO和RDA裂解,從而产生m/z 273 [M-H-C12H20O9-CO]-、m/z 179[C8H3O5]-、m/z 151[C7H3O4]-、m/z 107[C6H3O2]-等一系列碎片离子[23]。
3.3 芦丁体内代谢产物分析
采用Xcalibur软件分析空白组和给药组大鼠血浆、尿液、粪便中芦丁的代谢产物,通过两组间的数据对比,初步明确芦丁代谢物。根据化合物的实验分子量和理论分子量的误差((-5~5)×10-6)以及色谱保留时间,确定代谢产物的存在。同时,诊断离子可以从上述芦丁对照品的裂解模式中推断出来。例如,根据芦丁质谱图中的m/z 609 [M-H]-、m/z 301[M-H-C12H20O9]-等位置的片段离子,推导出m/z 689 [m/z 609+SO3]-、[JP4]m/z 381[m/z 343.08+SO3]-位置诊断离子的出现,初步证实了芦丁硫酸酯化产物的身份。m/z 301[M-H-C12H20O9]-[JP]和RDA裂解片段m/z 179[C8H3O5]-、m/z 151[C7H3O4]-可以用來进一步识别芦丁硫酸酯化产物。因此,在m/z 609±x,m/z 301±x,m/z 301,m/z 151,m/z 179(x为O(16),CH2 (14),SO3(80)等取代基分子量)处的产物离子可用于代谢物的鉴定。基于上述筛选和鉴别的研究思路,共鉴定了包括原型在内的 29个代谢产物,其中在血浆、尿液、粪便中分别检测到 11、26、8个代谢产物,部分代谢产物见表1和表2(全表见OSID科学数据与内容附表1~2)。
M7在正离子模式下产生准分子离子m/z 625.177 29,保留时间为4.00 min,推测其分子式为C28H33O16,误差为0.452 ×10-6。其分子式与芦丁相比多了一个亚甲基,在正离子模式下产生[JP]m/z 317[M+H-C12H20O9]+的碎片,与芦丁丢失一个芸香糖基(C12H20O9)产生槲皮素的过程相同,推测M7为芦丁的甲基化产物。在此基础上,M26在负离子模式下的准分子离子分别为 m/z 637.177 16,推测其分子式为 C29H33O16,误差分别为0.428×10-6,其分子式与芦丁相比多了两个亚甲基。碎片离子m/z 329 [M-H-C12H20O9]-为丢失一个芸香糖基所致,结合黄酮类化合物RDA裂解碎片m/z 179 [C7H3O4+2CH2]-和m/z 207 [C8H3O5+2CH2]-,推测该化合物为二甲基芦丁且两个甲基均结合在A环上。
M2、M17和M19在负离子模式下准分子离子分别为m/z 689.103 58、m/z 689.192 08 和m/z 689.193 48,保留时间分别为3.52、4.72和5.04 min。推测可能的分子式为C27H29O19S,三者误差分别为1.015×10-6、0.396×10-6和0.811 ×10-6。与M0芦丁相比,三者均多了SO3,根据碎片离子m/z 381[M-H-C12H20O9]-、m/z 301[M-H-C12H20O9-SO3]-及RDA裂解特征碎片离子m/z 179[C8H3O5]-和m/z 151[C7H3O4]-,推测三者为芦丁的硫酸酯化产物。
M15在正、负离子模式下分别在m/z 303.049 92 (C15H11O7,误差≤5×10-6)和m/z 301.03427 (C15H9O7,误差≤5×10-6)下具有相同的理论[M+H]+/[M-H]-离子。[JP]根据碎片离子m/z 275[M+H-CO]+、m/z 273[M-H-CO]-及RDA裂解特征碎片离子m/z 179[C8H3O5]-和m/z 151[C7H3O4]-,推测其为槲皮素。
M21和M27在正离子模式下准分子离子分别为m/z 317.065 57、m/z 317.065 57,保留时间为5.17 min和6.64 min,推测其可能的分子式为C16H13O7 (误差分别为-2.962 ×10-6和-3.057 ×10-6);M28在负离子模式下准分子离子为m/z 315.051 39,推测其可能的分子式为C16H15O7(误差为4.637 ×10-6,保留时间为8.87 min)。[JP]根据正离子模式m/z 303 [M+H-CH2]+和负离子模式m/z 301 [M-H-CH2]-碎片以及RDA裂解特征碎片离子m/z 181[C8H5O5]+、179[C8H3O5]-和m/z 153[C7H5O4]+、151[C7H3O4]-,推测三者为甲基槲皮素。
M11在负离子模式下的准分子离子为m/z 329.063 40,推测其可能的分子式为C17H13O7,误差为-4.650 ×10-6,其分子式与槲皮素M15相比多了两个亚甲基。负离子模式下,根据RDA裂解碎片m/z 165 [C7H3O4+CH2]-、m/z 121 [C6H3O2+CH2]-等碎片离子可推测M11为二甲基槲皮素并且一个甲基结合在A环上。
M16在负离子模式下的准分子离子为m/z 343.082 85,推测其可能的分子式为C18H15O7,误差为3.468 ×10-6,[JP]其分子式与槲皮素M15相比多了三个亚甲基。在其二级质谱图中,根据碎片离子m/z 313[M-H-CH2O]-和m/z 299[M-H-CH2O-CH2]-以及RDA裂解碎片m/z 165 [C7H3O4+CH2]-、m/z 121 [C6H3O2+CH2]-等可推测M16为三甲基槲皮素并且一个甲基结合在A环上。
M6在负离子模式下准分子离子为m/z 477.067 32,推测其可能的分子式为C21H17O13(误差为1.998×10-6),负离子模式下,m/z 301与m/z 477相比丢失m/z 176,证明该结构中存在葡萄糖醛酸,同时根据m/z 273以及RDA裂解碎片离子m/z 151、m/z 179等推测M6为槲皮素葡萄糖醛酸。在此基础上,M4在负离子模式下的准分子离子分别为m/z 653.099 61,推测其分子式为C27H25O19,误差为3.275 ×10-6。负离子模式下,从m/z 653到m/z 477再到m/z 301连续丢失m/z 176,证明该结构中存在2个葡萄糖醛酸,同时根据m/z 151、m/z 179等RDA裂解碎片离子推测M4为槲皮素二葡萄糖醛酸。
M13与M24在负离子模式下的准分子离子分别为m/z 380.992 13和m/z 380.992 00,推测其可能的分子式为C15H9O10S,二者误差分别为2.720 ×10-6、2.379 ×10-6,保留时间分别为4.47和5.61 min。负离子模式下,m/z 301与m/z 381相比相对分子质量减少m/z 80,提示该结构中磺酸基团的存在,结合m/z 273以及m/z 151、m/z 179、m/z 107等RDA裂解碎片离子等推测其为槲皮素硫酸酯。
M8、M9、M10在负离子模式下准分子离子分别为m/z 491.082 09、m/z 491.084 16和m/z 491.083 28,推测可能的分子式为C22H19O13,三者誤差分别为0.149 ×10-6、4.382×10-6和2.572 ×10-6。负离子模式下,m/z 315与m/z 491相比丢失m/z 176,证明该结构中存在葡萄糖醛酸,同时m/z 301与m/z 315相比丢失m/z 14,证明该分子中存在甲基;在正离子模式下,M8准分子离子为m/z 493.098 24,推测可能的分子式为C22H21O13,误差为1.162 ×10-6,存在与上述相同的裂解方式,产生m/z 317、m/z 303等碎片离子,由此推测三者均为甲基槲皮素葡萄糖醛酸。
M1、M3、M23在负离子模式下准分子离子分别为m/z 667.115 42、m/z 667.115 66 和m/z 667.114 99,推测可能的分子式为C28H27O19,三者误差分别为2.783 ×10-6、4.295 ×10-6和1.392 ×10-6,保留时间分别为3.49、3.66和5.27 min。与M8、M9、M10相比,增加了m/z 176,证明了比其增加了一个葡萄糖糖醛酸。负离子模式下,从m/z 667到m/z 491再到m/z 315连续丢失m/z 176,证明该结构中存在2个葡萄糖醛酸;同时m/z 301与m/z 315相比丢失m/z 14,证明该分子中存在甲基;结合RDA裂解碎片m/z 179和m/z 151推测三者均为甲基槲皮素二葡萄糖醛酸。
M12、M14、M18和M20在负离子模式的下准分子离子分别为m/z 395.007 54、m/z 395.007 66、m/z 395.007 78和m/z 395.007 75,推测其可能的分子式为 C16H11O10S(误差分别为2.016×10-6、2.320×10-6、2.624×10-6、2.548 ×10-6,保留时间分别为4.46、4.64、4.82、5.04 min)。负离子模式下,m/z 315与m/z 395相比丢失m/z 80,证明该结构中存在磺酸基团,同时m/z 301与m/z 315相比丢失m/z 14,证明该分子中存在甲基;结合RDA裂解碎片m/z 151推测上述化合物均为甲基槲皮素硫酸酯。
M5、M22、M25在负离子模式下准分子离子分别为m/z 557.023 80、m/z 557.024 17和m/z 557.024 23,推测可能的分子式为C21H17O16S,三者误差分别为0.873 ×10-6、2.639 ×10-6和 2.814 ×10-6,保留时间分别为3.79、5.23和5.83 min。与M7相比增加1个SO3,推测相比M7增加一个磺酸基团。负离子模式下,m/z 301与m/z 477相比丢失m/z 176,证明该分子中存在葡萄糖醛酸,结合RDA裂解碎片m/z 179和m/z 151推测三者均为槲皮素葡萄糖醛酸的硫酸酯化产物。
3.4 芦丁体内代谢途径分析
芦丁在大鼠体内存在多途径代谢,其主要代谢途径见图4,其中槲皮素及槲皮素的葡萄糖醛酸结合、甲基结合等代谢途径已得到相关文献的佐证[8-9]。图中揭示了芦丁苷元槲皮素首先是由母体药物经过Ⅰ相代谢反应水解生成的,随后发生了一系列的Ⅱ相代谢反应包括葡萄糖醛酸化、甲基化、硫酸酯化等。此外,还发现了大量的复合反应,其中以Ⅱ相代谢反应为主。此外,在大鼠粪便中发现和检测到了丰富的代谢物,这表明肠道中存在肠道微生物区系,肠道可能是芦丁的主要代谢器官之一。
4 结论
本研究采用SD大鼠一次性口服芦丁的方法,研究了芦丁在正负离子模式下的尿液、血浆和粪便中的代谢规律。根据碎裂模式、准确的质量测定、色谱保留时间和相关药物生物转化知识,共发现包括原型药物在内的29种代谢物,并对其进行了表征。芦丁进入大鼠体内后,在血浆中检测到11种代谢产物,在尿液中检测到26种代谢产物,在粪便中检测到8种代谢产物,提示芦丁主要从尿液中进行排泄,尿液样本可能是鉴定芦丁代谢物的有力指标。药物进入机体后能够水解为槲皮素发生Ⅰ相代谢反应,Ⅱ相代谢反应产物以芦丁和槲皮素的甲基化产物、葡萄糖醛酸结合产物、硫酸酯化产物及复合反应产物为主。芦丁进入体内进行代谢的过程中,在血浆、尿液和粪便中均检测到芦丁原型,与文献报道一致[9]。
目前大多数的研究主要集中在芦丁本身的药理活性和作用机制中,对其体内代谢产物的药理活性研究较少。随着越来越多的药物代谢产物被鉴定和表征,可以对其进行合成并加强相应药理活性的研究,为临床安全性和扩大已知药物的应用范围提供指导,也为新药的开发提供参考。此外,对已证实的代谢产物进行药代动力学研究,提供其吸收、分布、代谢和排泄的信息,能够为临床应用提供新的治疗方案。
参考文献:
[1]马溶, 庞广昌. 芦丁对现代文明病的作用[J]. 食品科学, 2013, 34(7): 307-311.
[2]AL-DHABI N A, ARASU M V, PARK C H, et al. An up-to-date review of rutin and its biological and pharmacological activities[J]. EXCLI Journal, 2015, 14: 59-63. DOI: 10.17179/excli2014-663.
[3]MAULUDIN R, MLLER R H, KECK C M. Development of an oral rutin nanocrystal formulation[J]. International Journal of Pharmaceutics, 2009, 370(1/2): 202-209. DOI: 10.1016/j.ijpharm.2008.11.029.
[4]WEBSTER R P, GAWDE M D, BHATTACHARYA R K. Protective effect of rutin, a flavonol glycoside, on the carcinogen-induced DNA damage and repair enzymes in rats[J]. Cancer Letters, 1996, 109(1/2): 185-191. DOI: 10.1016/S0304-3835(96)04443-6.
[5]NEGAHDARI R, BOHLOULI S, SHARIFI S, et al. Therapeutic benefits of rutin and its nanoformulations[J]. Phytotherapy Research, 2021, 35(4): 1719-1738. DOI: 10.1002/ptr.6904.
[6]CARBONARO M, GRANT G. Absorption of quercetin and rutin in rat small intestine[J]. Annals of Nutrition & Metabolism, 2005, 49(3): 178-182. DOI: 10.1159/000086882.
[7]YANG J, QIAN D W, JIANG S, et al. Identification of rutin deglycosylated metabolites produced by human intestinal bacteria using UPLC-Q-TOF/MS[J]. Journal of Chromatography B,AnalyticalTechnologiesin the Biomedical and Life Sciences, 2012, 898: 95-100. DOI: 10.1016/j.jchromb.2012.04.024.
[8]周鵬飞, 王建壮, 庞小雄, 等. 离体培养人肠道菌群对芦丁代谢的研究[J]. 广东药学院学报, 2011, 27(6): 582-586. DOI: 10.3969/j.issn.1006-8783.2011.06.008.
[9]伍明江, 吴晓磊, 张德芹, 等. UPLC-Q-TOF/MS鉴定芦丁在大鼠体内的代谢产物[J]. 中国实验方剂学杂志, 2017, 23(17): 91-97. DOI: 10.13422/j.cnki.syfjx.2017170091.
[10]邓志鹏, 张喆, 周红燕, 等. 异绿原酸C大鼠体内代谢产物鉴定[J]. 世界科学技术-中医药现代化, 2022, 24(5): 2071-2078.
[11]吴励萍, 张祎盈, 冯一帆, 等. 杞菊景明颗粒在大鼠血浆、胆汁、尿液、粪便中代谢产物的鉴定[J]. 中成药, 2022, 44(6): 1725-1731. DOI: 10.3969/j.issn.1001-1528.2022.06.001.
[12]TAMS K, WACHTER-KISS E, KORMNY R. Hydrazine determination in allopurinol using derivatization and SPE for sample preparation[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 152: 25-30. DOI: 10.1016/j.jpba.2018.01.035.
[13]JAGADEESAN K K, ROSSETTI C, ABDELQADER A, et al. Filter plate-based screening of MIP SPE materials for capture of the biomarker pro-gastrin-releasing peptide[J]. SLAS Discovery: Advancing Life Sciences R & D, 2017, 22(10): 1253-1261. DOI: 10.1177/2472555216689494.
[14]WANG F, CAO G S, LI Y, et al. Characterization of forsythoside A metabolites in rats by a combination of UHPLC-LTQ-Orbitrap mass spectrometer with multiple data processing techniques[J]. Biomedical Chromatography, 2018, 32(5): e4164. DOI: 10.1002/bmc.4164.
[15]XIANG Z D, WANG S P, LI H R, et al. Detection and identification of catalpol metabolites in the rat plasma, urine and faeces using ultra-high performance liquid chromatography-Q exactive hybrid quadrupole-orbitrap high-resolution accurate mass spectrometry[J]. Current Drug Metabolism, 2021, 22(3): 173-184. DOI: 10.2174/1389200221999201125205515.
[16]崔议方, 王红, 阮健, 等. 基于UHPLC-Q-Exactive Orbitrap MS鉴定欧前胡素在大鼠体内的代谢产物[J]. 中国中药杂志, 2022, 47(15): 4202-4213. DOI: 10.19540/j.cnki.cjcmm.20220307.203.
[17]JIANG S, WANG S P, DONG P P, et al. A comprehensive profiling and identification of liquiritin metabolites in rats using ultra-high-performance liquid chromatography coupled with linear ion trap-orbitrap mass spectrometer[J]. Xenobiotica, 2021, 51(5): 564-581. DOI: 10.1080/00498254.2020.1854366.
[18]DONG P P, SHI L, WANG S P, et al. Rapid profiling and identification of vitexin metabolites in rat urine, plasma and faeces after oral administration using a UHPLC-Q-exactive orbitrap mass spectrometer coupled with multiple data-mining methods[J]. Current Drug Metabolism, 2021, 22(3): 185-197. DOI: 10.2174/1389200221999210101232841.
[19]LIU M H, TONG X, WANG J X, et al. Rapid separation and identification of multiple constituents in traditional Chinese medicine formula Shenqi Fuzheng Injection by ultra-fast liquid chromatography combined with quadrupole-time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 74: 141-155. DOI: 10.1016/j.jpba.2012.10.024.
[20]YE J B, REN G, LI W Y, et al. Characterization and identification of prenylated flavonoids from Artocarpus heterophylluslam. roots by quadrupole time-of-flight and linear trap quadrupole orbitrap mass spectrometry[J]. Molecules (Basel, Switzerland), 2019, 24(24): 4591. DOI: 10.3390/molecules24244591.
[21]LIU X C, FAN X Y, WANG X, et al. Structural characterization and screening of chemical markers of flavonoids in Lysimachiae Herba and Desmodii Styracifolii Herba by ultra high-performance liquid chromatography quadrupole time-of-flight tandem mass spectrometry based metabolomics approach[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 171: 52-64. DOI: 10.1016/j.jpba.2019.04.003.
[22]QU Y X, ZHANG C N, LIU R H, et al. Rapid characterization the chemical constituents of Bergenia purpurascens and explore potential mechanism in treating osteoarthritis by ultra high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry combined with network pharmacology[J]. Journal of Separation Science, 2020, 43(16): 3333-3348. DOI: 10.1002/jssc.201901284.
[23]葉馨源, 吴建明, 杨杰, 等. 白背三七化学成分及代表性成分质谱裂解特征的研究进展[J]. 中草药, 2021, 52(21):6687-6700. DOI: 10.7501/j.issn.0253-2670.2021.21.028.

