基于非靶向代谢组学的诃子解草乌心脏毒性机制分析
图布新,姜艳丽,乌日汉,胡伊力格其,刘锦文,韩晓静,阿都沁夫,白梅荣*
(1.内蒙古民族大学 蒙医药研发工程教育部重点实验室,内蒙古 通辽 028000;2.内蒙古医科大学蒙医药学院,内蒙古 呼和浩特 010010;3.内蒙古民族大学 护理学院,内蒙古 通辽 028000)
诃子为使君子科植物诃子TerminaliachebulaRetz.、绒毛诃子TerminaliachebulaRetz.var.tomentellaKurt.或恒河诃子TerminaliachebulaRetz.var.gangeticaRoxb.的干燥成熟果实[1],是蒙医最常用的药物,享有“额莫音·芒来、浩日音·达日嘎”的美誉[2],蒙古语意为蒙药之王和解毒之王。草乌是毛茛科系北乌头AconitumkusnezoffiiReichb.的干燥块根[2],有大毒。由诃子解草乌毒是蒙医用药特色[3]。纵观诃子解草乌毒性研究报道发现,诃子鞣质能缓和乌头碱的水解或改善线粒体功能,从而减少草乌毒性,降低不良反应[4-6]。但尚未见从代谢组学角度分析诃子解草乌心脏毒性机制的研究报道。因此,本实验以大鼠为研究对象,以草乌诃子药对为示例药物,以代谢组学方法分析诃子解草乌心脏毒性过程中的心脏内源性代谢产物变化规律,寻找诃子解草乌心脏毒性的生物标志物,为草乌的安全合理应用提供科学依据。
1 实验材料
1.1 动物
SD雄性大鼠,SPF级,体质量为(200±20)g,由辽宁长生生物技术股份有限公司提供(SCXK(辽)2021-0001)。饲养条件:室温维持(23±1)℃,光照12h,自由饮水、摄食。
1.2 药品与试剂
草乌与诃子由内蒙古民族大学附属医院蒙药制剂室提供,并由包桂花教授鉴定;纯化水(屈臣氏集团有限公司);肌酸激酶(CK)、肌酸激酶同工酶(CKMB)试剂盒均购自罗氏诊断产品(上海)有限公司。
1.3 仪器
Eppendorf N13462C型移液器(德国Eppendorf公司);TripleTOF5600+质谱仪MASS(AB SCIEXTM公司);Mikro 220R型台式高速冷冻离心机(Hettich公司);TL-48R型粉碎研磨仪(上海万柏生物科技有限公司);Nexera UHPLC LC-30A色谱UHPLC(岛津SHIMADZU公司)。
2 实验方法
2.1 动物分组及取材
取大鼠50只,按体质量随机分为正常组(ZC)、草乌高剂量组(CG,0.514 3g/kg,临床等效剂量4倍)、草乌低剂量组(CD,0.032 1g/kg,临床等效剂量1/4倍)、草乌诃子药对高剂量组(CHG,0.514 3g/kg,临床等效剂量4倍)、草乌诃子药对低剂量组(CHD,0.032 1g/kg(临床等效剂量1/4倍),每组10只。从实验第1天开始,给药组灌胃给予相应的药物溶液,每日1次,连续28d;正常组灌胃等容积生理盐水。最后一次给药后,麻醉动物,测定心率及心电图;从腹主动脉取血,3 500r/min离心15min分离血清,待测心脏功能生化指标;取部分心脏组织固定于10%甲醛溶液,待观察病理学变化;取冻存部分心脏组织待分析其心脏内源性代谢产物。
2.2 代谢物提取
分别称取心脏组织0.3g于PE管中,加入1 000μL甲醇,制备匀浆液,4℃ 12 000rpm/min离心15min,取上清过0.22μm有机滤膜,10μL进样,采用UPLC-MS检测。
2.3 UPLC-MS检测
色谱条件:采用SHIMADZU InerSustain C18色谱柱(100mm×2.1mm,2μm)。流动相A∶乙腈,B∶0.1%甲酸水溶液,流速0.3mL/min,柱温35℃,进样量10μL。洗脱梯度:95%~30% B,0~7min;30%~0% B,7~13min;0%~95% B,13~16min。
质谱参数条件:采用电喷雾电离源条件如下:离子源Gas1:50,离子源 Gas2:50,界面加热温度:500℃(正离子)和450℃(负离子),离子喷雾电压浮动5 500V(正离子)和4 400V(负离子),气帘气压力:25,TOF质量扫描范围:100~1 200Da,产物离子扫描范围:50~1 000Da,产物离子扫描累积时间0.01s,TOF MS 扫描累积时间0.2s,二级质谱采用 Information Dependent Acquisition获得,并采用High Sensitivity模式,碰撞能量:(35±15)eV,去簇电压:±60 V。
2.4 数据处理
3 结果
3.1 多元统计分析
3.1.1 心电图及心率检测结果 在给药28d后,与正常组相比较,CG组大鼠心率出现明显降低(P<0.05),见表1。心电图结果显示,与正常组相比较,CG组呈现心律失常,室早,宽大畸形的QRS波;CD组出现宽大畸形的QRS波;CHG组出现ST段压低;CHD组偶见ST段抬高。见图1。
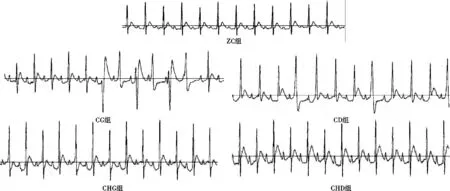
图1 各给药组大鼠的心电图

表1 草乌及草乌加诃子药对组大鼠心率的影响
3.1.2 血液生化指标检测 与ZC组比较,CG组CK、CKMB含量显著降低(P<0.05);但草乌诃子药对CK、CKMB含量无明显变化。提示,草乌具有一定的心脏毒性,诃子具有降低草乌心脏毒性作用。结果见表2。

表2 各给药组对大鼠生化指标的影响
3.1.3 心脏组织病理检测 病理检测结果显示,正常组心肌纤维排列整齐规则,胞核呈蓝色,胞质呈淡粉色,细胞结构清晰。CG组和CD组心肌纤维排列略紊乱,胞质疏松淡染,部分细胞水肿;CHG组个别心肌细胞水肿;CHD组心肌纤维排列紊乱,胞质疏松淡染。见图2。

图2 各组病理切片(HE×400)
3.1.4 PCA分析结果 PCA是可观察样品的聚集、离散程度的图像。与ZC组比较,CG和CHG组的大鼠心脏代谢物呈分离,见图3。利用MetaboAnalyst软件对各组热图进行聚类分析,发现ZC组与CG和CHG组的代谢物相对丰度有明显差异。表明,草乌高剂量可使大鼠心脏代谢物发生一定变化。见图4。
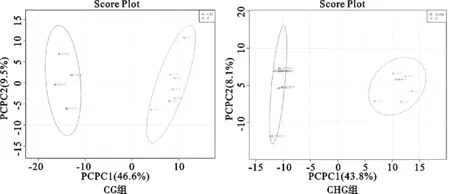
图3 高剂量组心脏代谢物 PCA分析

图4 高剂量组心脏代谢物热图
3.1.5 PLS-DA分析结果 与ZC组比较,CG和CHG组大鼠心脏代谢物能完全分离,见图5。说明CG和CHG组大鼠心脏代谢物谱有显著差异。

图5 高剂量组心脏PLS-DA分析
3.1.6 单变量分析 标红的点为具有显著差异的代谢物,提示,与ZC组比较,CG和CHG组心脏代谢物存在显著差异。见图6。

图6 高剂量组心脏火山图
3.2 差异代谢物的筛选
与ZC组比较,CG组差异代谢物共18个,其中上调代谢物4个,下调代谢物14个,详见表3。与ZC组比较,CHG组差异代谢物共25个,其中上调代谢物1个,下调代谢物24个,详见表4。

表3 CG组心脏差异代谢物鉴定结果 (VIP≥1和P<0.05)

表4 CHG组心脏差异代谢物鉴定结果 (VIP≥1和P<0.05)
3.3 通路富集分析
将差异代谢物导入MBRole 2.0分析并获得主要的代谢通路有ABC转运蛋白、精氨酸生物合成、组氨酸代谢、精氨酸和脯氨酸代谢等通路,见图7。
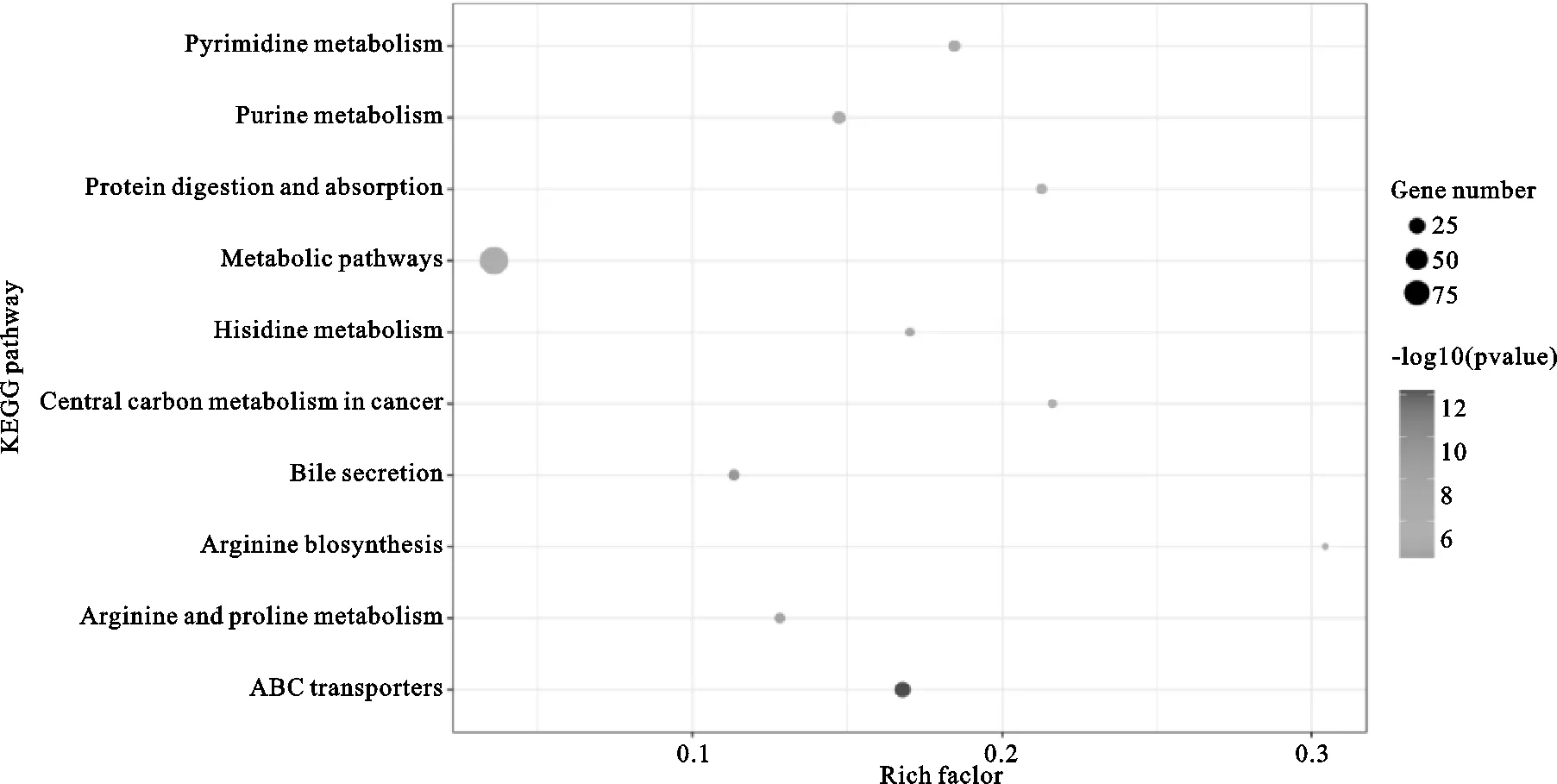
图7 心脏代谢通路
3.4 结语
本实验结果表明,诃子解草乌心脏毒性作用较明显,调节心脏N、N-二甲基精氨酸和腺苷蛋氨酸及肌酸代谢产物是诃子解草乌心脏毒性的主要机制。
3.5 讨论
NICHOLSON[7]首次提出了代谢组学的概念。代谢组学是分析药物对生物体的内源性代谢产物的表达,从小分子水平上揭示药物的疗效或毒效的分析方法[8]。近年来,代谢组学在药物心脏毒性研究,尤其在心脏损伤标志物筛选、毒性机制及心脏损伤防治等研究中已被广泛应用[9]。
CK主要分布于骨骼肌、心肌、脑甲状腺、肺组织、胃肠平滑肌中,在磷酸肌酸合成途径中起到可逆催化肌酸形成磷酸肌酸的作用。即人体合成肌酸过程为依赖甘氨酸脒基转移酶和胍基乙酸N-甲基转移酶这两种生物酶的催化作用,以甘氨酸、精氨酸和S-腺苷蛋氨酸为主要原料,合成肌酸。提示,血清CK含量的异常表达也与肌酸、甘氨酸、精氨酸和S-腺苷蛋氨酸表达异常有一定相关。
实验结果显示,草乌致心率和心电图异常,升高血清CK含量、引起明显的心肌细胞胞质疏松及细胞水肿的表征均与心脏组织中N、N-二甲基精氨酸和腺苷蛋氨酸异常升高有关;诃子解草乌心脏毒性的机制主要与降低心脏组织中肌酸有关。

