HLA-E与oHSV2 VP5蛋白相互作用研究
姚若一, 范嘉琦, 肖 雄, 周 芹, 汪 洋, 胡 翰, 刘滨磊
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
溶瘤病毒(oncolytic virus,OVs)疗法是一种癌症免疫治疗方式。溶瘤病毒可以直接原位感染和裂解肿瘤细胞,诱导肿瘤内的急性炎症,并提供病原体相关分子模式(PAMPs)和危险相关分子模式(DAMPs),其感染的肿瘤细胞的死亡会在这种免疫刺激环境中释放肿瘤相关抗原(TAAs),从而促进免疫细胞流入、抗肿瘤免疫反应和肿瘤免疫环境的重构[1]。目前,已有多种病毒被用作溶瘤病毒载体,单纯疱疹病毒(herpes simplex virus,HSV)由于其具有多种优势而被广泛应用、研究[2]。
oHSV2是在单纯疱疹病毒Ⅱ型(HSV-2)标准毒株HG52的基础上,敲除了ICP34.5和ICP47,插入编码人粒细胞巨噬细胞集落刺激因子(human granulocyte macrophage colony stimulating factor,hGM-CSF)的表达序列的新型溶瘤病毒。ICP34.5是一种神经毒性因子,可以抑制I型干扰素(IFN)反应,拮抗非分裂细胞内的PKR信号通路。ICP34.5的敲除提高了肿瘤细胞的选择性,防止神经元的感染。ICP47可以阻断TAP(与抗原加工相关的转运体)的功能,从而阻止了受感染细胞向CD8+T细胞呈递抗原。ICP47的敲除诱导了US11启动子的早期激活,增加溶瘤病毒治疗活性,还使健康细胞和肿瘤细胞都呈递病毒抗原,抑制健康组织的感染,免疫介导破坏肿瘤细胞,选择性繁殖溶瘤病毒。hGM-CSF可以促进树突状细胞的积累和成熟,改善肿瘤抗原呈递并刺激强大的T细胞反应[3]。目前,其产品OH2注射液作为多适应症单药(NCT03866525)和联合用药HX008(NCT04616443)均正在进行临床试验。
主要组织相容性复合体(major histocompatibility complex,MHC)是基因组中多态性最强的区域,并且富含编码具有免疫学意义的分子的基因[4]。人的MHC被称为人类白细胞抗原(human leucocyte antigens,HLA)基因复合体,可分为HLAⅠ、HLAⅡ、HLAⅢ[5]。HLAⅠ类基因通常分为两类:经典类(Ⅰa类),包括HLA-A、HLA-B和HLA-C,具有明显的多态性;非经典类(Ⅰb类),包括HLA-E、HLA-F、HLA-G等,不显示或仅显示有限的多态性[6]。HLA Ⅰ a分子可被杀伤细胞免疫球蛋白样受体(killer cell immnoglobulin-like receptor,KIR)识别,而HLAⅠb分子主要通过同源二聚体NKG2D和异二聚体CD94-NKG2受体介导识别[7]。
在肿瘤细胞表面,HLA Ⅰ a类分子的表达通常下调甚至丢失,从而逃避细胞毒性T淋巴细胞(CTL)对其的识别和特异性杀伤。理论上,自然杀伤(NK)细胞可以杀伤缺乏HLAⅠ分子的肿瘤细胞。但实际上,它们之所以能逃避NK细胞的攻击,此现象可能与HLA Ⅰ b分子在肿瘤细胞表面的表达有关[8]。
人类白细胞抗原E(HLA-E)是功能和作用途径较为明确的HLAⅠb类分子,具有组织分布狭窄但细胞表面表达较低的特征,几乎在所有成人细胞表面低水平表达。不过,已有多项研究证实了HLA-E在许多类型的人类肿瘤细胞的表面过表达。HLA-E是CD94/NKG2A的主要配体,该受体在来自外周血的超过50%的CD56bright或CD56dimNK细胞及CD8+T细胞的一些亚群上表达[9],是一种抑制性受体。HLA-E与CD94/NKG2A结合后,SHP-1磷酸酶被招募到NKG2A的酪氨酸磷酸化的免疫受体酪氨酸抑制基序(ITIM),然后将抑制信号传递给免疫效应细胞,最终产生抑制作用[10]。因此,HLA-E在肿瘤细胞上的上调表达,对NK细胞和CD8+T细胞发挥抗肿瘤功能是不利的。
前期研究发现,UV-oHSV2的处理可以使BGC823、LoVo和U87MG细胞上的HLA-E上调表达。在体外实验中,经过HLA-E抗体预处理的BGC823细胞被杀伤效果更明显。在皮下荷瘤裸鼠瘤内给药模型,和腹腔荷瘤裸鼠腹腔给药模型中,药物中添加HLA-E抗体均可以减小小鼠肿瘤体积,并延长小鼠的生存期。基于此,本文进行oHSV2与HLA-E的相互作用研究,并运用激光共聚焦实验进行初步验证。
1 材料与方法
1.1 实验材料和试剂
溶瘤病毒oHSV2由本实验团队基因改造,并进行生产、纯化。293T细胞,BGC823细胞由本实验团队保存。大肠杆菌DH5α感受态细胞,BL21(DE3)感受态细胞由本实验团队制备。质粒载体pGEX-6p-1、EGFP-C1由本实验团队保存,pCMV-N-DsRed购于碧云天生物。
总RNA提取、通用型DNA纯化回收、无内毒素质粒小提中量试剂盒均于TIANGEN购买。限制性内切酶于NEB购买。非连接酶依赖型单片段快速克隆试剂盒、2×Phanta®Max Master Mix(Dye Plus)于Vazyme购买。GST标签蛋白纯化试剂盒于碧云天生物购买。HLA-E抗体、HRP标记的山羊抗兔二抗于proteintech购买。DAPI、4%多聚甲醛于biosharp购买。
1.2 细胞培养、总RNA提取
细胞均用DMEM/F12(添加10%FBS)培养基,在5% CO2,37℃的细胞培养箱中培养。总RNA提取步骤依据试剂盒说明书。
1.3 质粒构建
目的基因PCR体系配制及反应程序依据说明书。所用到的引物见表1。

表1 引物信息
质粒载体双酶切,反应体系:质粒2000 ng,内切酶各4 μL,cutsmart buffer 20 μL,补加DEPC水至200 μL。反应条件:37℃,2 h。
以上体系用试剂盒回收后进行同源臂连接。连接反应产物转化DH5α感受态细胞,涂板。第二天挑取单菌落,进行菌落PCR鉴定。
1.4 GST-HLA-E融合蛋白的表达与纯化
将pGEX-6p-1-HLA-E质粒转化DE3感受态,以1∶100接种于LB液体培养基(含100 mg/L Amp),37℃摇菌;然后加入IPTG,20℃低温诱导表达过夜。接下来4℃离心收集菌体,超声破碎15 min;再次4℃离心后的上清使用GST标签蛋白纯化试剂盒进行纯化。
1.5 质粒提取、转染及总蛋白提取
质粒提取步骤依据试剂盒说明书。
293T细胞在六孔板中培养。当细胞密度达到70%左右时,更换细胞培养液,均匀加入转染体系(质粒2.5 μg,lipo8000转染试剂4 μL,MEMα培养基补至125 μL),培养24 h。弃培养基,用RIPA(强)裂解液冰上裂解细胞20 min,转至1.5 mL EP管,13000 r/min,4℃离心15 min收集上清,加入SDS-PAGE蛋白上样缓冲液煮沸变性。
1.6 western blot
蛋白样品经电泳分离后,使用半干法转膜(电压15 V),将蛋白转到NC膜上。然后膜用5%的脱脂奶粉室温封闭1 h,一抗(1∶1000)4℃孵育过夜,二抗(1∶10000)室温孵育1 h。最后在膜上滴加ECL显色液进行显影。
1.7 激光共聚焦实验
293T细胞在玻底培养皿中培养,pCMV-N-DsRed-HLA-E质粒和EGFP-C1-UL19质粒、pCMV-N-DsRed-UL19质粒和EGFP-C1-HLA-E质粒分别1∶1共转染。转染24 h后,用4%多聚甲醛室温固定细胞15 min,再用DAPI(1 μg/mL)室温避光染核10 min。最后加入抗荧光淬灭剂,在激光共聚焦显微镜下观察VP5与HLA-E的共定位情况。
2 结果
2.1 原核表达载体的构建
提取BGC823细胞总RNA,反转录为cDNA,以cDNA为模板扩增HLA-E基因(1~600 bp),琼脂糖凝胶电泳显示扩增出的条带在约600 bp处,与目的基因大小相符(图1)。然后将回收的DNA与原核表达载体pGEX-6p-1连接,连接反应产物转化DH5α感受态细胞,挑取11个Amp抗性菌落为模板进行菌落PCR鉴定,均扩增成功,条带位置与目的基因相符(图2)。再从中挑取3个送公司测序,测序得到的基因序列同GenBank中发布的标准序列一致。提取质粒后进行双酶切鉴定(图3),证明pGEX-6p-1-HLA-E质粒构建成功。
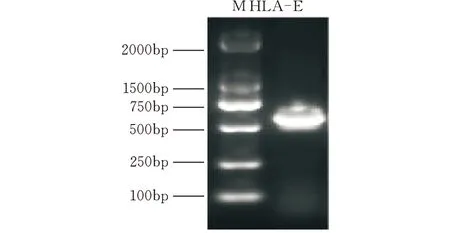
图1 PCR扩增HLA-E基因
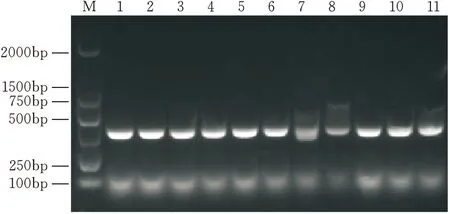
图2 菌落PCR筛选pGEX-6p-1-HLA-E重组子
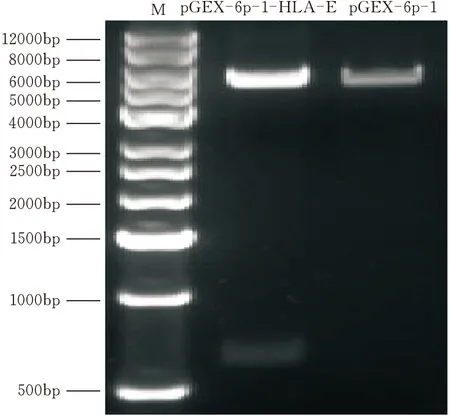
图3 pGEX-6p-1-HLA-E(EcoR Ⅰ、Not Ⅰ)双酶切
2.2 GST-HLA-E融合蛋白的纯化
破碎后的上清与GSH-琼脂糖珠孵育,收集孵育后的上清和洗脱(共4次)下来的蛋白样品,加入蛋白上样缓冲液煮沸变性,然后通过SDS-PAGE分离。考马斯亮蓝染液染色(图4)和western blot(图5)显示的结果一致,GST-HLA-E蛋白在45 kDa上方。
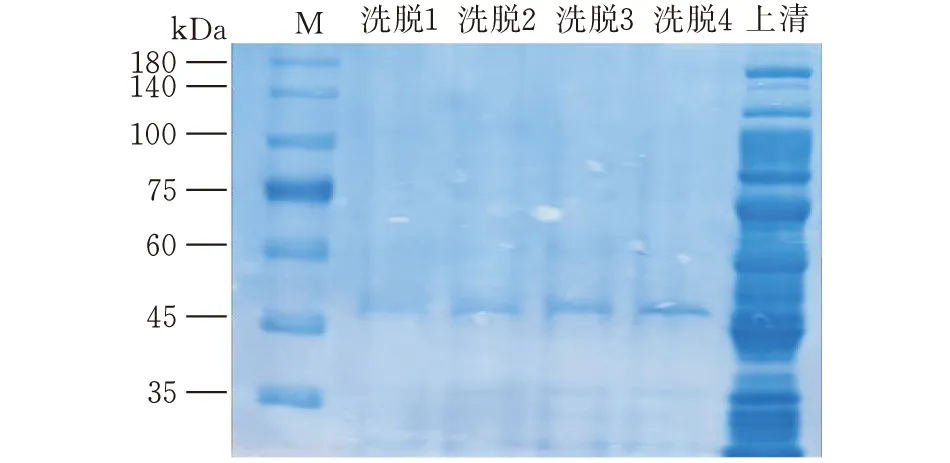
图4 考马斯亮蓝染色
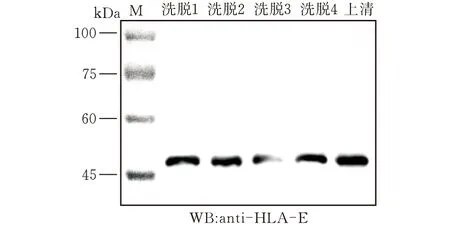
图5 western blot验证纯化蛋白HLA-E的表达
2.3 GST pull-down及质谱鉴定
先使纯化后的GST-HLA-E蛋白结合在GSH-琼脂糖珠上,然后与oHSV2(RIPA强裂解液裂解)蛋白孵育,洗掉其中不与HLA-E结合的杂蛋白,保留剩余的样品。质谱分析结果为oHSV2的主要衣壳蛋白VP5与HLA-E相互作用(图6)。
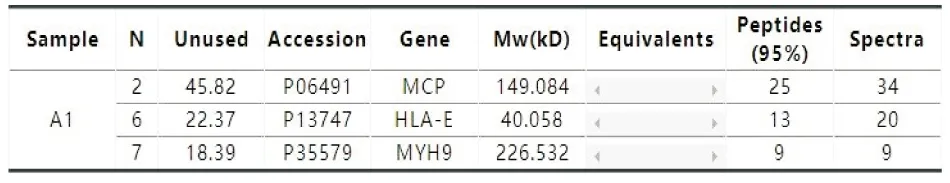
图6 质谱分析结果
2.4 HLA-E荧光质粒构建
PCR扩增见2.1。回收的DNA产物与载体EGFP-C1、pCMV-N-DsRed连接,连接反应产物转化DH5α感受态细胞。挑取10个Kana抗性菌落为模板进行菌落PCR鉴定,均扩增成功(图7)。各挑取3个重组子送公司测序,测序得到的基因序列同GenBank中发布的标准序列一致。提取质粒后,将质粒转染293T细胞,然后在体视荧光显微镜下观察,均发荧光(图8),同时将细胞裂解取上清进行western blot分析,可以检测到HLA-E(图9),证明EGFP-C1-HLA-E、pCMV-N-DsRed-HLA-E质粒构建成功。
图7 菌落PCR筛选EGFP-C1-HLA-E、pCMV-N-DsRed-HLA-E重组子

图8 体视荧光显微镜下转染HLA-E荧光质粒的细胞
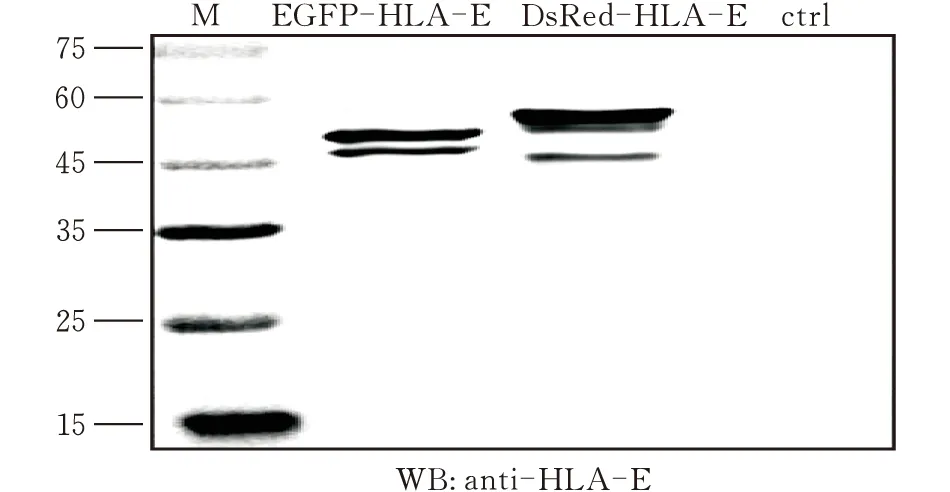
图9 western blot验证荧光质粒HLA-E的表达
2.5 UL19荧光质粒构建
提取oHSV2病毒DNA,以其为模板PCR扩增UL19基因(1~1002 bp),琼脂糖凝胶电泳结果如图10所示。

图10 PCR扩增UL19基因
将回收产物与载体EGFP-C1、pCMV-N-DsRed连接,连接反应产物转化DH5α感受态细胞。各挑取10个Kana抗性菌落为模板进行菌落PCR鉴定,均扩增成功(图11)。

图11 菌落PCR筛选EGFP-C1-UL19、pCMV-N-DsRed-UL19重组子
各挑取3个重组子送公司测序,测序得到的基因序列同GenBank中发布的标准序列一致。提取质粒后进行双酶切鉴定(图12)。同时质粒转染293T细胞,在体视荧光显微镜下看到均发荧光(图13)。证明EGFP-C1-UL19、pCMV-N-DsRed-UL19质粒构建成功。
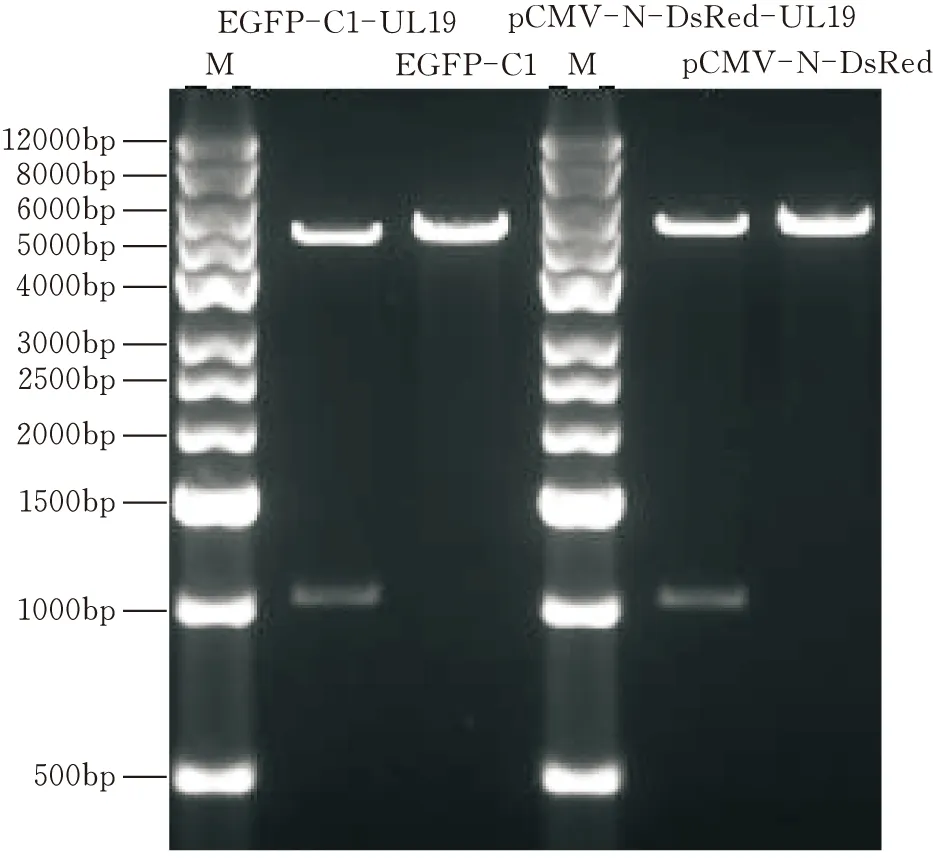
图12 EGFP-C1-UL19(Kpn Ⅰ、BamH Ⅰ);pCMV-N-DsRed-UL19(EcoR Ⅰ、Xho Ⅰ)双酶切

图13 体视荧光显微镜下转染UL19荧光质粒的细胞
2.6 激光共聚焦实验验证HLA-E与VP5蛋白相互作用
HLA-E和UL19荧光质粒1∶1共转染293T细胞,细胞经过固定、染核处理后,在激光共聚焦显微镜下观察。结果显示,无论质粒带何种荧光标签,荧光均在细胞质中分布,在荧光叠加后,可以观察到HLA-E和VP5蛋白在细胞质中的共定位(图14)。
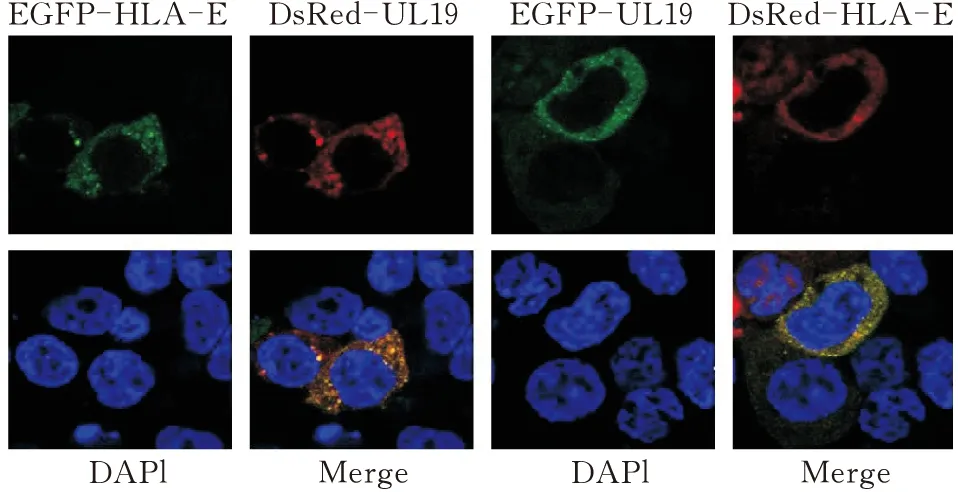
图14 激光共聚焦实验验证HLA-E与VP5蛋白相互作用
3 结论
已有研究报道HCMV(人巨细胞病毒)、HCV(丙型肝炎病毒)也存在病毒感染引起HLA-E表达上调的现象。HCMV感染细胞后,通过其糖蛋白UL40产生的多肽与HLA-E结合,上调HLA-E在细胞表面的表达,然后通过CD94/NKG2A受体,从而逃脱NK细胞的裂解[11]。Nattermann等在HCV中也发现了类似的机制,HCV导致HLA-E上调,通过其与CD94/NKG2A的相互作用,从而抑制NK细胞的裂解功能[12]。但EBV(Epstein-Barr病毒)能够产生一种多肽绑定HLA-E分子,破坏NKG2A的识别,导致NK细胞的激活[13]。我们前期也发现oHSV2在体外上调部分肿瘤细胞系表面HLA-E的表达水平。为了研究oHSV2是否也能与HLA-E结合,从而通过CD94/NKG2A调控NK细胞激活或抑制,本文应用GST pull-down和质谱技术筛选出了oHSV2的VP5蛋白(由UL19基因编码)为HLA-E的相互作用蛋白,并进行了初步验证。
HSV-1/HSV-2 UL19基因编码的VP5蛋白是病毒的主要衣壳蛋白,是一种晚期(leaky-late)表达蛋白,在感染复制周期中晚期最高表达[14]。冷冻电子显微镜下观察到HSV-2(MS株)衣壳结构由大约3000个蛋白质组成,分为3种类型:六邻体(hexons)、五邻体(pentons)和三联体(triplexes)。六邻体和五邻体都包含VP5(六邻体还包含VP26);三联体包括VP23和VP19C。VP5蛋白形成了广泛的分子间网络,包括多个二硫键(总共约1500个)和非共价相互作用,与VP26蛋白和三联体支撑衣壳稳定和装配[15]。
我们截取UL19基因前1002 bp构建了红/绿荧光质粒,与HLA-E的荧光质粒共转染293T细胞,通过激光共聚焦显微镜的观察,发现它们在细胞质中有共定位。但这只是初步的验证,后期将进行免疫共沉淀(co-IP)和双分子荧光互补(BiFC)实验作进一步验证。

