有氧运动对ApoE-/-小鼠生物钟基因Cry1表达的影响及其抗动脉粥样硬化机制
程金凤 孙大康 王倩倩 李洋 甄萌萌 程艳丽
1滨州医学院附属医院,滨州 256600;2滨州医学院附属医院医学研究中心,滨州 256600;3临邑县人民医院,德州 251500;4滨州医学院附属医院心血管内科,滨州 256600
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症过程,脂质沉积和炎性反应是AS发病机制中重要的危险因素[1]。高密度脂蛋白(high density lipoprotein,HDL)的血清含量降低,总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)和低密度脂蛋白(low density lipoprotein,LDL)含量升高是促进AS发生的不利因素。在这些脂质中,LDL发挥着关键作用[2-3]。AS病变的发展开始于LDL对血管内膜渗透,积聚在内膜下的LDL被氧化为氧化型低密度脂蛋白(oxidized low density lipoprotein,OxLDL),导致和加剧内皮损伤;血液中的单核细胞迁移至损伤的动脉血管壁并黏附在内皮细胞,转化为巨噬细胞,巨噬细胞吞噬OxLDL后形成泡沫细胞,进而形成最早的粥样硬化病变脂质条纹[4-5]。AS斑块中的局部炎症主要由表达促炎介质的活化巨噬细胞介导[6],在AS病变中,活化的巨噬细胞吞噬OxLDL后,最终会分泌白细胞介素1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎细胞因子,后者促进黏附分子的表达,刺激白细胞的募集,并破坏斑块的稳定性,加剧AS发展[7-10]。
运动对抑制动脉粥样硬化性心血管疾病的进展有显著效果[11-13],可能与其改善糖尿病、高血压和高脂血症等AS相关危险因素有关[14],但是其确切的作用机制尚未完全阐明。生物钟基因可参与调控AS的病理过程,其中,生物钟基因Cry1(Cryptochrome 1)在AS过程中发挥保护作用,它可以通过调节机体的炎症、血压、糖脂代谢以及内皮细胞功能来影响AS的进展[15]。
我们课题组的转录组测序结果(尚未发表)发现,跑台运动可以提高小鼠主动脉组织中Cry1基因的mRNA表达水平。据此我们提出假设,有氧运动可能通过诱导Cry1基因表达,进而调节脂质代谢及炎性反应,从而抑制AS的进程。本实验中,我们用ApoE-/-小鼠建立AS模型,探讨运动诱导的抗AS作用与Cry1基因表达之间的潜在联系。
材料与方法
1.实验动物
8周龄SPF级雄性ApoE-/-小鼠22只购买于北京维通利华实验动物技术有限公司,许可证号为:SCXK(京)2021-0006。动物饲养及实验操作过程已通过滨州医学院附属医院动物伦理委员会审批(20211101-95),采用国家标准啮齿类动物饲料饲养,动物饲养符合每笼3~5只。饲养条件:通风条件良好,温度:(25±1)℃,湿度:(55±5)%,每天12 h轮换照明。
2.实验方法
研究实施时间:2022年3月至2022年11月。ApoE-/-小鼠随机分为模型组(11只)和运动组(11只)。普通饲料适应性喂养1周后换用高脂饲料(40%脂肪+1.25%胆固醇)。模型组小鼠不干预其活动,运动组小鼠跑台运动12周,5 d/周。运动方案如下:第1周适应阶段,由6 m/min、30 min逐渐增加至12 m/min、60 min,之后进行稳定的运动量(12 m/min、60 min)。所有小鼠给予自由饮水,每2周对小鼠进行称重并记录其变化情况。
3.取材
运动结束并禁食12 h,用4%水合氯醛(0.01 ml/g)腹腔注射麻醉小鼠,血液样本通过摘取眼球收集,离心后收集上清。经PBS溶液灌流后,游离主动脉弓至髂动脉分叉处的整段主动脉血管组织。将每组5只ApoE-/-小鼠的主动脉血管组织置于4%多聚甲醛固定液(paraformaldehyde,PFA)中,用于后续苏木精-伊红(HE)染色、油红O染色及免疫组织化学染色;每组6只ApoE-/-小鼠取整段血管组织存于-80 ℃冰箱,用于后续real-time PCR分析。
4.炎症因子及血脂水平测定
酶联免疫吸附试验(ELISA)检测小鼠血清中IL-1β、IL-6、TNF-α的浓度,试剂盒由上海酶联生物科技有限公司提供;比色法检测小鼠血清中TC、TG、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的浓度,试剂盒由南京建成生物工程研究所提供。测定严格按照说明书操作。
5.HE染色
组织经固定、脱水透明、浸蜡包埋后进行切片。厚度为4 µm,每隔10张取1张进行HE染色。切片按顺序放入二甲苯Ⅰ 10 min、二甲苯Ⅱ 10 min、无水乙醇Ⅰ 5 min、95%乙醇5 min、80%乙醇5 min、70%乙醇5 min,苏木素浸泡2 min,分化液分化30 s,伊红染色30 s,切片依次放入梯度酒精各3 s、二甲苯Ⅰ、二甲苯Ⅱ各1 min进行脱水透明,中性树胶封片。显微镜图像采集,使用Image-Pro Plus 6.0软件进行斑块面积定量分析。
6.油红O染色
组织固定脱水后使用OCT包埋制备冰冻切片,切片厚度为10 µm,每隔10张取1张进行油红O染色。切片复温干燥30 min,4% PFA固定10 min,蒸馏水洗,60%异丙醇浸润5 min,油红O染液浸润10 min,蒸馏水洗,60%异丙醇溶液分化3 min,mayer苏木素染液染色3 s,流水冲洗返蓝,用甘油明胶进行封片,显微镜镜检并进行后续分析。
7.real-time PCR分析
用RNAiso Plus试剂从组织中提取总RNA,并按照逆转录试剂盒指示合成cDNA。按照CFX96 Real-Time PCR Detection system的操作方法,反应体系20 µl,扩增过程包括以下:95 ℃ 30 s,PCR反应,40 cycles,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s。采用2-△△CT方法计算GAPDH、Cry1的相对表达量,见表1。

表1 目的基因的引物序列
8.免疫组化
常规制备石蜡切片,切片放入60 ℃烤箱中60 min,经二甲苯梯度脱蜡、各浓度乙醇溶液梯度脱水后,乙二胺四乙酸(EDTA)溶液高压热修复,滴加3%过氧化氢(H2O2)溶液孵育20 min,防止非特异性染色,山羊血清封闭,37 ℃孵育30 min,一抗(Cry1 1∶100),4 ℃冰箱过夜。二抗37 ℃孵育30 min,二氨基联苯胺(DAB)显色,阳性区域呈棕黄色。苏木素复染,酒精脱水,中性树胶封片。显微镜图像采集,用Image-Pro Plus 6.0软件进行平均光密度分析。
9.统计学分析
使用SPSS 25.0软件操作,计量资料符合正态分布,以均数±标准差表示,运用独立样本t检验或单因素方差分析进行统计学分析,P<0.05表示差异有统计学意义。
结果
1.有氧运动对ApoE-/-小鼠主动脉Cry1基因表达的影响
由图1可知,运动组小鼠Cry1基因的mRNA表达水平明显高于模型组(P<0.01),表明有氧运动可以上调小鼠主动脉组织中Cry1基因的表达水平。此外,我们通过免疫组织化学染色进一步验证了我们的假设,运动组小鼠主动脉组织中棕黄色颗粒较模型组表达增多(P<0.01)。
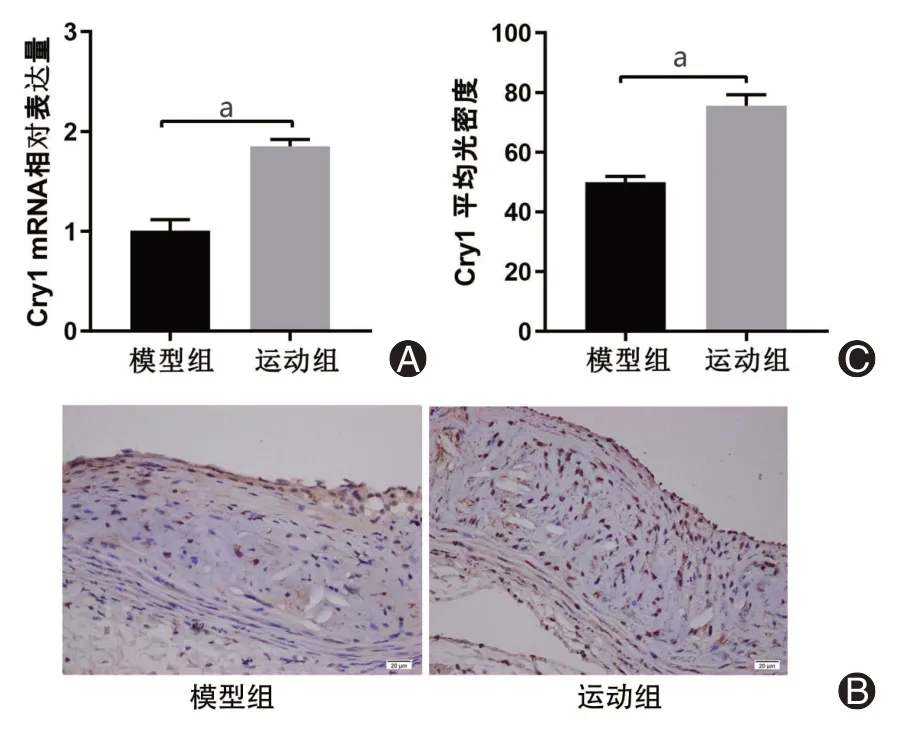
图1 有氧运动对ApoE-/-小鼠主动脉Cry1基因表达的影响。A:小鼠主动脉Cry1基因mRNA表达情况;B、C:小鼠主动脉Cry1蛋白表达情况及其平均光密度分析(免疫组织化学染色×400)
2.有氧运动对ApoE-/-小鼠血脂及炎性细胞因子的影响
与模型组小鼠相比,运动组小鼠经血清TC、TG、LDL-C水平降低(均P<0.01),HDL-C水平显著升高(P<0.01),见表2;运动组小鼠炎性因子的水平较模型组显著降低(均P<0.01),见表3。
表2 两组ApoE-/-小鼠血脂水平比较(mmol/L,)
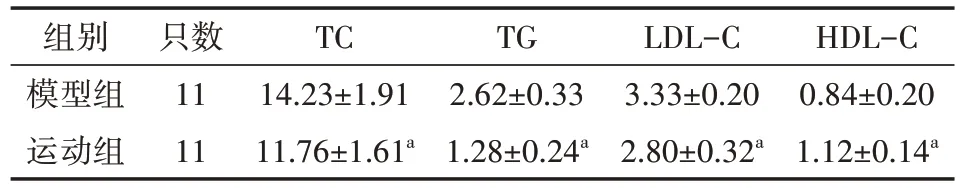
表2 两组ApoE-/-小鼠血脂水平比较(mmol/L,)
注:两组小鼠普通饲料适应性喂养1周后换用高脂饲料(40%脂肪+1.25%胆固醇),模型组小鼠不干预其活动,运动组小鼠跑台运动12周,5 d/周;TC为总胆固醇,TG为三酰甘油,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇;与模型组比较,aP<0.01
HDL-C 0.84±0.20 1.12±0.14a组别模型组运动组只数11 11 TC 14.23±1.91 11.76±1.61a TG 2.62±0.33 1.28±0.24a LDL-C 3.33±0.20 2.80±0.32a
表3 两组ApoE-/-小鼠炎症因子水平比较(ng/L,)

表3 两组ApoE-/-小鼠炎症因子水平比较(ng/L,)
注:两组小鼠普通饲料适应性喂养1周后换用高脂饲料(40%脂肪+1.25%胆固醇),模型组小鼠不干预其活动,运动组小鼠跑台运动12周,5 d/周;IL为白细胞介素,TNF为肿瘤坏死因子;与模型组比较,aP<0.01
TNF-α 484.47±41.75 441.89±22.53a组别模型组运动组只数11 11 IL-1β 95.67±7.51 86.56±6.78a IL-6 109.62±7.01 68.44±8.40a
3.有氧运抑制ApoE-/-小鼠AS斑块的形成
通过HE染色(图2)可知,模型组小鼠主动脉内膜下有泡沫细胞形成,并且伴随有脂质及胆固醇结晶的大量沉积,脂质斑块明显。而运动组斑块面积明显减少,斑块内胆固醇结晶、泡沫细胞聚集情况有所减轻,AS斑块占主动脉管腔横截面的面积百分比也明显降低(P<0.01),见图3。由油红O染色可知,模型组AS斑块形成明显,脂质沉积情况显著,12周跑台运动后,运动组主动脉斑块内的脂质含量明显降低(P<0.01),见图4。
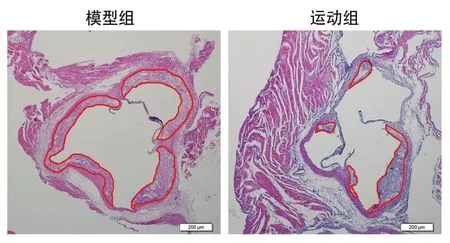
图2 两组ApoE-/-小鼠主动脉根部横断面HE染色(×200)
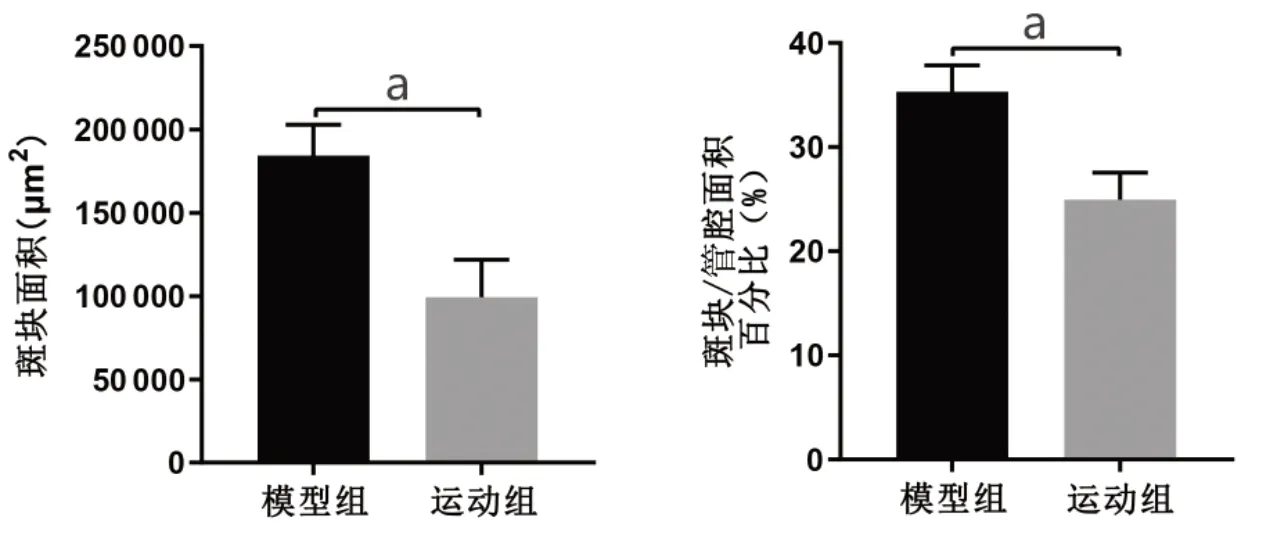
图3 两组ApoE-/-小鼠主动脉横断面斑块面积定量分析
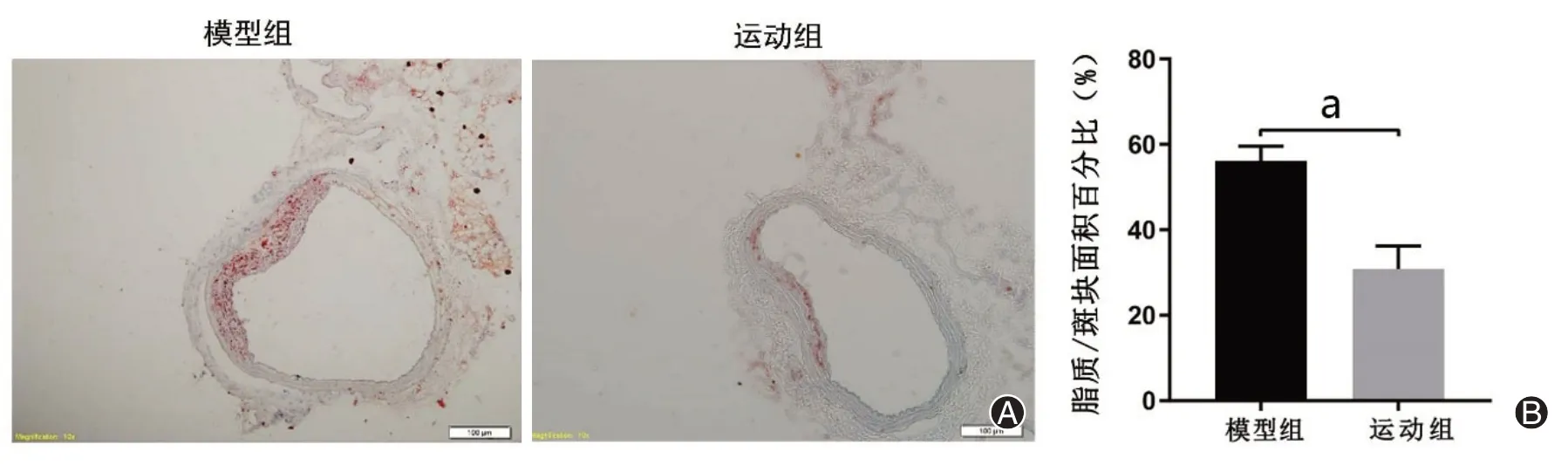
图4 两组ApoE-/-小鼠主动脉横断面油红O染色(×100)(A)及斑块内脂质含量定量分析(B)
4.有氧运动对ApoE-/-小鼠体质量的影响
实验开始时,模型组和运动组ApoE-/-小鼠的体质量大致相同,差异均无统计学意义(均P>0.05)。随着运动实验的进行,两组喂养高脂饮食的ApoE-/-小鼠体质量逐渐增加,并且在第8周开始出现显著差异(P<0.01),如图5所示。
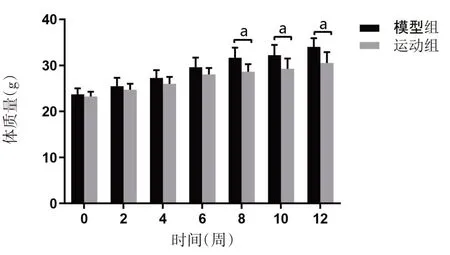
图5 有氧运动对ApoE-/-小鼠体质量的影响
讨论
运动可以抑制AS的进展[16-17],但其确切机制尚未完全阐明。随着研究的进一步深入,生物钟基因Cry1成为抑制AS形成的重要因素[15,18]。但有氧运动与Cry1基因之间的联系尚无相关研究。
1.有氧运动对ApoE-/-小鼠主动脉生物钟基因Cry1表达的影响
我们对被广泛应用于AS模型的ApoE-/-小鼠进行运动干预。参考运动干预影响ApoE-/-小鼠AS的相关研究资料,大多数研究者采用12~15 m/min、30~60 min/次的方案,本试验确定了12 m/min、60 min/次的运动方案。在本研究中,有氧运动显著提高了小鼠主动脉组织中Cry1基因的表达。由于Cry1基因在AS的发展中具有抑制作用,因此,我们推测有氧运动诱导的抗AS作用可能与Cry1基因表达的上调有关。
2.有氧运动诱导的Cry1基因表达升高通过调节炎性反应及脂质代谢抑制AS的形成
炎性反应会损伤血管组织,引起AS斑块破裂和血栓形成[19-20],是AS发生发展的重要危险因素。IL-1β、IL-6、TNF-α等促炎细胞因子在AS相关炎症中发挥着重要作用。IL-1β被视为临床治疗AS中抗炎治疗的潜在靶点。研究发现,与对照组小鼠相比,给予IL-1β拮抗剂干预的ApoE-/-小鼠主动脉血管斑块面积减小,抑制了AS的进展[21]。IL-6参与调节急性期炎性反应和慢性炎症[22],在临床研究中发现,冠心病患者血液样本中IL-6的水平高于健康对照组[23],并且冠心病患者病情的严重程度与IL-6水平呈正相关[24]。TNF-α也参与AS的发展,与ApoE-/-小鼠相比,TNF-α、ApoE双敲除基因小鼠(TNF-α-/-,ApoE-/-)的AS斑块面积更小,表明抑制TNF-α具有AS保护作用[25]。因此,降低这些炎性细胞因子的水平是AS抗炎治疗的一个重要部分。在本研究中,运动组小鼠血清TNF-α、IL-1β和IL-6水平均显著低于模型组,与Sun等[17]的研究结果一致。
在本研究中,我们评估了跑台运动对AS斑块形成的影响。模型组小鼠主动脉病理切片出现典型的AS表现。模型组主动脉切片显示血管壁厚薄不均匀,存在大量泡沫细胞和AS斑块,这一现象与Wu等[26]的研究相一致。与模型组小鼠相比,相同高脂饮食条件下的运动组小鼠经12周的跑台运动干预后,其体质量和主动脉斑块面积都有所下降。运动组小鼠主动脉管壁上仍有斑块形成,但其脂质核心较小。并且,油红O染色结果也显示,运动组AS斑块内的脂质沉积量小于模型组。我们还测量了小鼠血清中的血脂水平,运动组小鼠血清TC、TG、LDL-C水平下降,血清HDL-C水平升高。但是在Wu等[26]的研究中,运动干预对小鼠血清TC、TG浓度的影响程度小,这与我们的实验结果相矛盾。我们分析造成这种结果主要是由于两个实验过程中的运动模式、喂养时间和饮食配方不同。
本研究证明了跑台运动的抗AS和抗炎作用,并且运动可以上调Cry1基因在动脉壁中的表达,阻碍ApoE-/-小鼠AS的进展。Narasimamurthy等[27]发现,在Cry-/-小鼠中,炎症因子IL-6和TNF-α的表达显著增加,这是因为生物钟基因Cry1可以直接与腺苷酸环化酶结合抑制环磷酸腺苷(cyclic adenosine monophosphatec,cAMP)的产生,从而抑制蛋白激酶A(protein kinase A,PKA)诱导的p65磷酸化,进而抑制核因子(NF)-κB的激活降低炎性反应。当生物钟基因Cry1缺失时可能会释放其对cAMP产生的抑制作用,最终导致炎性反应的增加。然而,通过尾静脉注射Cry1基因重组腺病毒载体使Cry1基因在ApoE-/-小鼠中高表达时,通过调节TLR/NF-κB通路,显著降低了TNF-α、IL-1β和IL-6促炎因子的表达,缓解了AS的发生。此外,生物钟基因Cry1过表达也减小了ApoE-/-小鼠的AS斑块面积和TC、TG和LDL-C的浓度[18]。结合本实验运动上调Cry1基因表达的结果,我们认为有氧运动诱导的Cry1基因表达升高是运动抑制AS形成的可能调控机制之一。有氧运动通过提高主动脉血管壁中生物钟基因Cry1的表达,来发挥其抗炎及脂质调节的作用,进而抑制AS的进展。
有氧运动可以提高小鼠主动脉管壁生物钟基因Cry1的表达水平,降低血脂及相关炎性因子的浓度,并抑制AS斑块的形成,提示有氧运动的抗AS作用可能与其上调小鼠主动脉血管壁生物钟基因Cry1的表达有关。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明程金凤:酝酿和设计实验,实施研究,采集数据,分析/解释数据,起草文章,统计分析;孙大康:对文章的知识性内容作批评性审阅,行政、技术或材料支持,指导;王倩倩、李洋、甄萌萌:行政、技术或材料支持;程艳丽:对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导

