基于X型结构的DNA荧光传感器检测黄曲霉毒素B1
乔梦想,白 天,吕泽平,卫 敏*
1.河南工业大学 粮油食品学院,河南 郑州 450001
2.河南省食品和盐业检验技术研究院,河南 郑州 450008
黄曲霉毒素是一类由黄曲霉和寄生曲霉产生的有害代谢产物[1],主要包括黄曲霉毒素B1(AFB1)、B2、G1、G2以及两种代谢产物M1、M2[2],其中AFB1毒性最强,具有致畸、致癌和致突变作用等[3],已被国际癌症机构归为Ⅰ类致癌物[4-5]。AFB1通过广泛地污染粮食如玉米、小麦、花生等[6-7]从而威胁到人类的健康。AFB1对热稳定,一旦污染了农产品,经过常规热处理和巴氏杀菌等食品加工过程无法完全去除[8]。我国规定玉米、花生等食品中AFB1的含量不得超过2 μg/kg[9]。因此,建立一种灵敏、快速、特异性高的分析技术用于AFB1的检测对于食品安全和人类健康至关重要。
目前,检测AFB1的传统方法包括高效液相色谱法(HPLC)、高效液相色谱-串联质谱(HPLC-MS)以及酶联免疫吸附方法(ELISA)等[10-12]。基于色谱的检测方法虽然稳定性好,准确性和灵敏度也较高,但因仪器昂贵、样品前处理较为复杂以及对试验人员的操作水平要求高等缺点无法满足食品安全快速检测的要求。基于免疫分析的方法虽操作简单,但是由于抗体制备较为复杂、成本高,且在运输和储存过程中不易保存的缺点限制了其实际应用[13]。适配体是一种人工合成的单链寡核苷酸,是通过对一些小分子的配体进行指数富集(SELEX)的系统进化获得的,对其靶标具有特异性识别能力[14-15]。与抗体相比,因其具有合成成本低、易于修饰等优点已成为抗体的理想替代物[16]。近年来已有许多基于AFB1适配体的检测方法,包括比色法、电化学法、表面增强拉曼散射法和荧光法等[17-20]。DNA纳米技术是一种能够将DNA分子进行组装和制造的技术,通过精确设计DNA序列,可以制造出各种形态和尺寸的纳米结构[21]。因此,基于DNA纳米结构与荧光材料的结合,使适配体在荧光生物传感器研究领域中有广阔的应用前景。
随着传感技术的不断发展,越来越多的传感策略被应用于传感器的构建中,提升其稳定性、灵敏度等性能,实现对目标物质的检测。目前,已有基于不同DNA纳米结构的生物传感器被开发出来用于真菌毒素的检测,如四面体和八面体纳米结构[22-23]。然而,一些DNA纳米结构在传感器实际构建过程较为复杂,不利于实现快速检测。X型DNA纳米骨架仅需要2条DNA单链完成构建,暴露出4条末端可以同时与4条适配体进行互补配对,具有良好的刚性和稳定性,但目前未用于真菌毒素的检测研究。在生物传感器的构建过程中通常涉及分离步骤,由于DNA属于比重较小的物质,在分离过程中不易操作,利用磁珠的磁分离特性进行分离操作简单,可起到降低背景信号、增强灵敏度的作用。
为了提高对AFB1的检测效率,作者设计了可同时接入4条AFB1适配体的X型DNA纳米骨架结构,利用高亲和力和高特异性的适配体对AFB1进行识别,采用FAM荧光基团作为荧光信号,利用快速磁分离技术,构建了基于X型结构的DNA荧光传感器用于AFB1的检测研究。该荧光适配体传感器为利用DNA纳米结构检测真菌毒素提供了有力的技术支撑。
1 材料与方法
1.1 材料与试剂
试验所使用的核酸序列均来自生工生物工程(上海)股份有限公司,AFB1适配体(FAM-Apt)序列为5′-FAM-TGC ACG TGT TGT CTC TCT GTG TCT CGT GC-3′,DNA1的序列为5′-GCA CGA GAC ACA GAG AGA TTT TTT TTT TTT TTC TAC CCT CAA CCT CAA CTC CAT TTG CAC GAG ACA CAG AGA GAT TTT TTT TTT TTT T-Bio-3′,DNA2的序列为5′-GCA CGA GAC ACA GAG AGA TTT TTT TTT TTT TTT GGA GTT GAG GTT GAG GGT AGT TTG CAC GAG ACA CAG AGA GA-3′;链霉亲和素包被的磁珠(SA-MBs,粒径300 nm、10 mg/mL):苏州海狸生物医学工程有限公司;红茶、玉米:市售;玉米粉质控样(TOIXN-JTZK-019):河南省食品和盐业检验技术研究院。盐酸、氯化钠、三(羟甲基)氨基甲烷(Tris):天津市科密欧化学试剂有限公司;乙二胺四乙酸(EDTA):洛阳市化学试剂厂;AFB1、赭曲霉毒素A(OTA)、呕吐毒素(DON):Sigma-Aldrich公司;T-2毒素、DNA Marker A、琼脂糖、TEB缓冲液:生工生物工程(上海)股份有限公司;绿如蓝核酸染料:北京天恩泽基因科技有限公司;6×DNA上样缓冲液:北京索莱宝科技有限公司;玉米赤酶烯酮(ZEN):国家粮食和物资储备局科学研究院;伏马菌素B1(FB1)、AFB2:Acros公司;所用化学试剂均为分析纯,所用水均为灭菌超纯水。
1.2 仪器
水浴恒温振荡器:上海跃进医疗器械有限公司;EL06053220荧光光度计:美国瓦里安公司;Tanon-2500凝胶成像仪、HE-120电泳仪:上海天能科技有限公司。
1.3 试验方法
1.3.1 X型DNA荧光传感器的制备及AFB1的检测
分别取10 μL 0.25 μmol/L DNA1和10 μL 0.25 μmol/L DNA2加入离心管混合均匀,在37 ℃条件下孵育1 h,加入1.50 μL 10 mg/mL用SA包被的MBs再次孵育1 h即得到DNA1/DNA2-MBs结构复合物。将10 μL、1 μmol/L FAM-Apt与10 μL缓冲溶液加入离心管中孵育40 min作为对照组。同时,将10 μL 1 μmol/L FAM-Apt与10 μL 不同浓度的AFB1加入不同离心管中孵育40 min。当AFB1不存在时,FAM-Apt通过碱基互补配对可以分别连接到DNA1/DNA2-MBs结构中游离的单链部分,形成完整的X型DNA纳米结构。该结构可同时接入4条FAM-Apt链。当AFB1存在时,AFB1先与其适配体结合,形成AFB1/FAM-Apt复合物,游离在上清液中。通过测定上清液中荧光信号强度的变化,实现对AFB1的快速测定。使用荧光分光光度计在室温下进行荧光扫描时,设置发射波长为510~600 nm,记录在490 nm激发波长下的荧光光谱。
1.3.2 试验参数条件优化及性能评价
根据1.3.1制备X型DNA荧光传感器检测AFB1时,分别选择用SA包被的不同体积(0.5、1.0、1.5、2.0、2.5 μL)的10 mg/mL MBs再次孵育1 h得到DNA1/DNA2-MBs结构复合物,选择MBs最佳体积进行后续试验。
按照1.3.1得到DNA1/DNA2-MBs结构复合物,将10 μL 1 μmol/L FAM-Apt与10 μL 50 ng/mL AFB1加入离心管中,选择对AFB1的不同孵育时间(20、30、40、50、60 min)进行优化。
固定X骨架浓度为0.25 μmol/L,将FAM-Apt与X骨架按浓度比(3∶1、3.5∶1、4∶1、4.5∶1、5∶1)分别与10 μL 50 ng/mL AFB1加入离心管中孵育最佳时间,选择最佳浓度比进行后续试验。
将10 μL 1 μmol/L FAM-Apt分别与10 μL 500 ng/mL干扰毒素、10 μL 50 ng/mL AFB1加入离心管中孵育最佳时间,磁分离后取上清液进行检测,对传感器特异性进行评价。
1.3.3 实际样品处理
玉米粉样品的处理:将玉米样品研磨成粉,取0.50 g分别加入0.50 mL不同浓度的AFB1标准液并混合均匀,然后在室温条件下干燥。将干燥后的样品与5 mL的甲醇-水(体积比7∶3)萃取溶剂充分混合,放置于振荡器中振荡30 min后12 000 r/min离心10 min,用0.45 μm有机滤膜过滤获得上清液。使用Tris-HCl缓冲液(pH 7.40)将滤液稀释。分别制备AFB1质量浓度为0、0.10、1、10 ng/mL的加标玉米粉样品。
红茶样品的处理:取0.50 mL红茶分别加入0.50 mL不同浓度的AFB1标准液,混合均匀,用0.45 μm水系滤膜过滤获得上清液。使用Tris-HCl缓冲液(pH 7.40)将滤液稀释。分别制备AFB1质量浓度为0、0.10、1、10 ng/mL 的加标红茶样品。
1.4 数据处理
使用OriginPro 2021软件、Adobe Illustrator 2022软件处理试验数据。
2 结果与分析
2.1 X型DNA荧光适配体传感器的电泳表征
由图1可知,泳道1—3都是单链DNA,每条DNA的迁移速度与其所含的碱基个数相对应,碱基数目越多,迁移越慢。泳道4为DNA1和DNA2的自组装双链,由于DNA双链的形成导致分子质量增加,相比于单链DNA其迁移速度变慢。由于双链碱基能嵌入更多的染料,因此该条带比单链DNA的更亮。泳道5的迁移速度最慢,说明FAM-Apt、DNA1和DNA2通过碱基互补配对成功形成了X型DNA纳米结构。当体系中形成复杂的DNA多链结构之后,条带的迁移位置可能会发生与DNA Marker迁移率不完全一致的情况[24-26]。

注:M条带代表DNA分子质量标准Marker A(25~500 bp),泳道1—5的条带分别为FAM-Apt、DNA1、DNA2、DNA1/DNA2、X型DNA纳米结构;单链DNA浓度为4 μmol/L。图1 琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoresis analysis
2.2 X型DNA荧光传感器检测AFB1的可行性分析
由图2可知,当AFB1不存在时,FAM的荧光强度最大值较低,为172.28,说明FAM-Apt成功接入DNA1/DNA2-MBs形成X型结构。当50 ng/mL AFB1存在时,FAM的荧光强度明显升高至279.72,说明AFB1与其适配体成功结合,形成AFB1/FAM-Apt复合物,游离在上清液中,从而获得了较强的荧光信号。结果表明,所制备的X型DNA传感器能够实现对AFB1的检测。

图2 X型DNA传感器的荧光光谱图Fig.2 Fluorescence spectra of X-shaped DNA sensors under different conditions
2.3 X型DNA荧光传感器的试验条件优化
由图3(a)和图3(b)可知,随着MBs体积的逐渐增加,相对荧光强度(ΔF)也逐渐增加,在MBs体积为1.5 μL时达到最高;随着MBs体积的继续增加,过量的MBs影响了传感器的检测能力,造成ΔF下降,因此选择MBs最佳体积为1.50 μL。
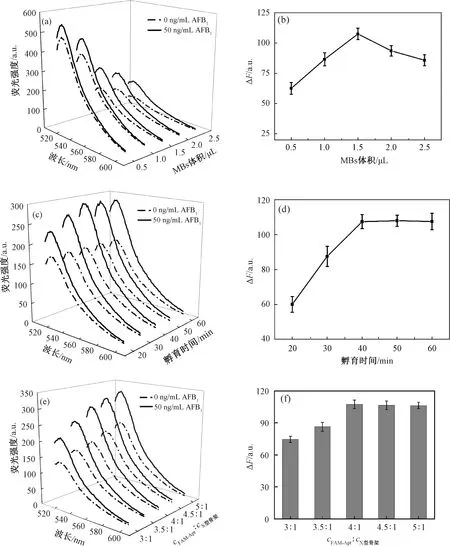
注:(a)(c)(e)分别为不同MBs的体积、孵育时间、FAM-Apt与X型骨架浓度比对X型DNA传感器荧光强度影响的光谱图;(b)(d)(f)分别是它们对ΔF的影响。图3 试验条件的优化Fig.3 Optimization of experimental conditions
由图3(c)和图3(d)可知,在反应的初始阶段,ΔF随着时间的增加而增加,当AFB1的孵育时间为40 min时,ΔF达到最大,孵育时间继续增加,ΔF无明显变化。说明当孵育时间为40 min时,AFB1的适配体与AFB1之间的特异性结合作用达到饱和,因此选择AFB1的最佳孵育时间为40 min。
由图3(e)和图3(f)可知,将X型骨架浓度固定为0.25 μmol/L,当FAM-Apt的浓度为0.75~1 μmol/L时,ΔF随着FAM-Apt浓度的增加而增加,并在1 μmol/L时ΔF达到最大,FAM-Apt浓度继续增加,ΔF变化不明显。说明当FAM-Apt与X型骨架浓度比为4∶1时,FAM-Apt与X型骨架达到饱和状态,因此选择FAM-Apt与X型骨架最佳浓度比为4∶1。
2.4 X型DNA荧光传感器对AFB1的检测研究
在最佳检测条件下,研究了AFB1浓度与传感器ΔF之间的关系,并建立了标准曲线。图4(a)为X型DNA传感器检测AFB1的光谱图。在AFB1质量浓度为0.05~500 ng/mL时,传感器的荧光强度随着AFB1质量浓度的增加而增加。对AFB1质量浓度取对数后,lg(ρAFB1)与传感器的ΔF在0.05~100 ng/mL的线性范围内,有良好的线性相关性(图4(b)),线性方程为ΔF=56.53+30.62lg(ρAFB1),R2=0.99,根据国际纯粹与应用化学联合会(IUPAC)的推荐方法计算得到检出限(LOD)为9 pg/mL。为了验证所开发的传感器的分析性能,将X型DNA传感器与其他已报道的传感器进行了比较(表1)。可以看出,本试验设计的传感器具有灵敏度高、LOD低的优点。
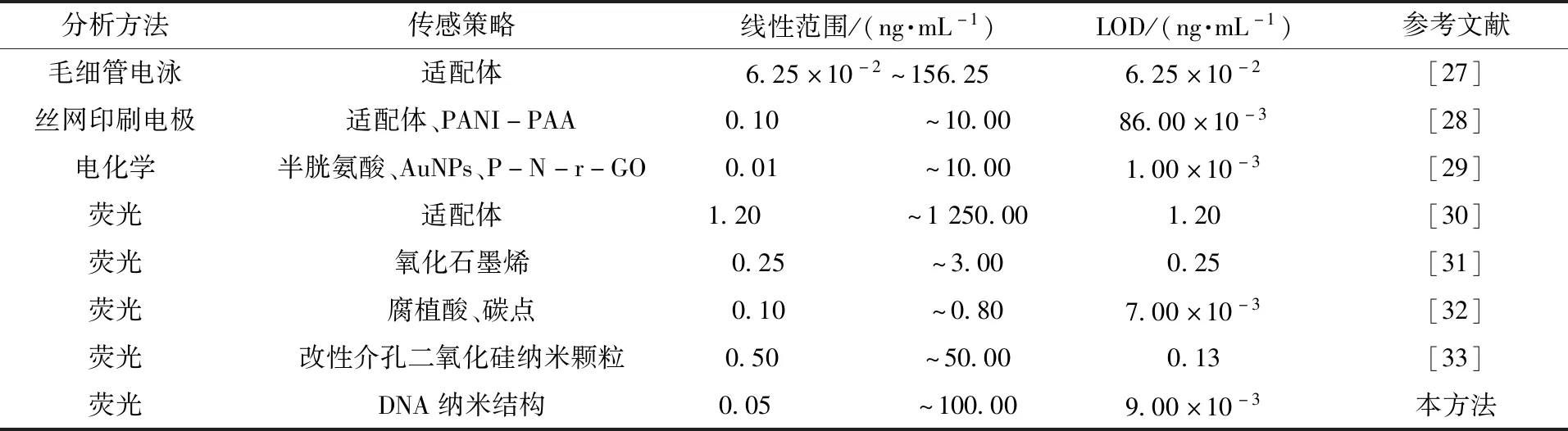
表1 传感器与其他检测AFB1的方法比较Table 1 Comparison of sensors with other methods for detecting AFB1
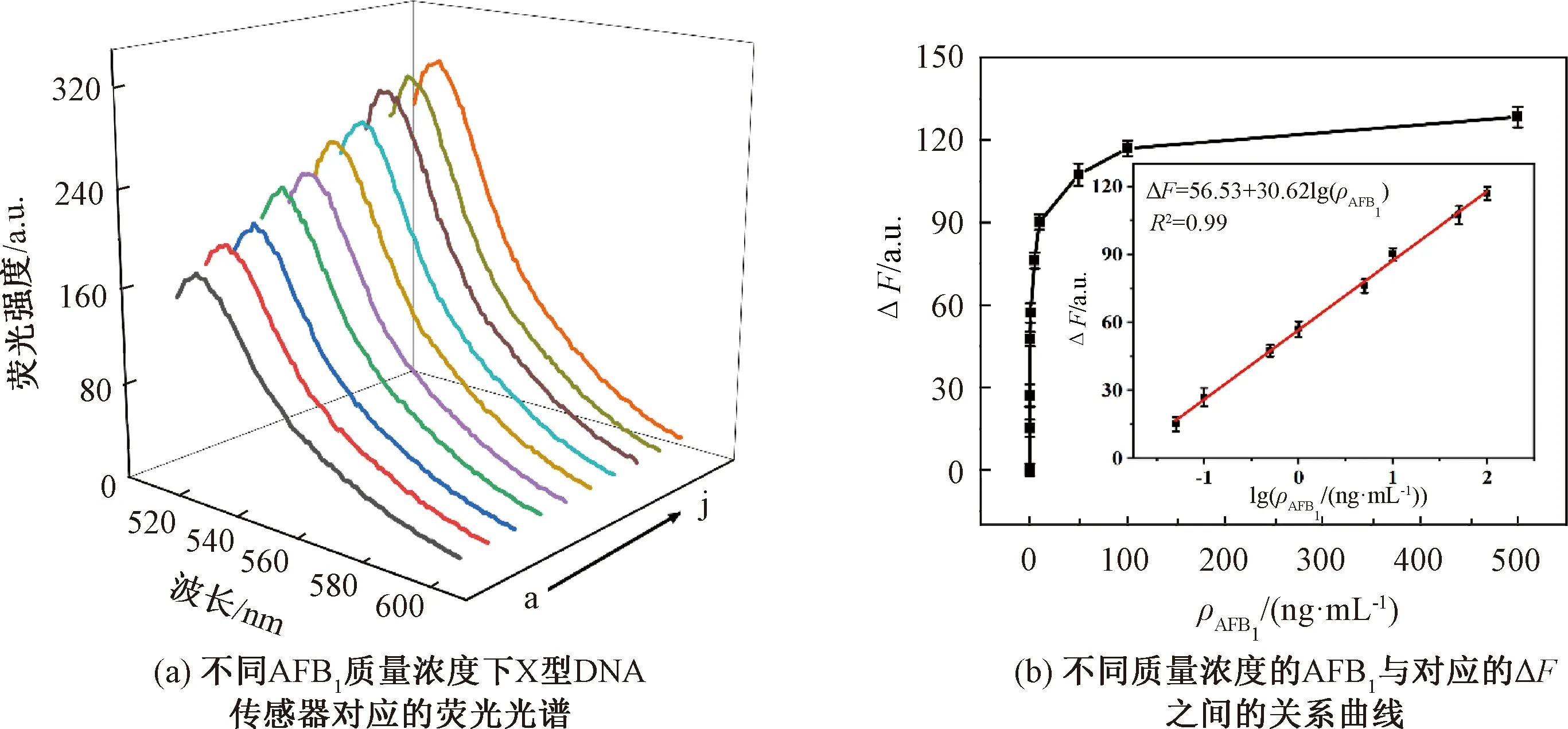
注:(a)图中由a到j,AFB1的质量浓度依次为 0、0.05、0.10、0.50、1、5、10、50、100、500 ng/mL;(b)内插图为ΔF与lg (ρAFB1)的线性关系曲线(AFB1的质量浓度为0.05、0.10、0.50、1、5、10、50、100 ng/mL)。图4 传感器检测AFB1的标准曲线及对应的荧光光谱Fig.4 Standard curve and corresponding fluorescence spectrum of AFB1 detection by fluorescent sensor
2.5 X型DNA荧光传感器的检测性能研究
利用不同的干扰毒素(FB1、ZEN、T-2、DON、AFB2、OTA)对X型DNA传感器的特异性进行了评估,在传感器制备过程中加入干扰毒素的条件与目标物AFB1(质量浓度50 ng/mL)完全相同,其质量浓度为AFB1质量浓度的10倍,结果如图5(a)所示。可以看出,单一的其他干扰毒素对传感器的ΔF影响较小,当其他干扰毒素与AFB1共存时,ΔF与空白相比明显上升,且与AFB1单独存在时的ΔF无明显差异。说明该传感器具有良好的特异性。
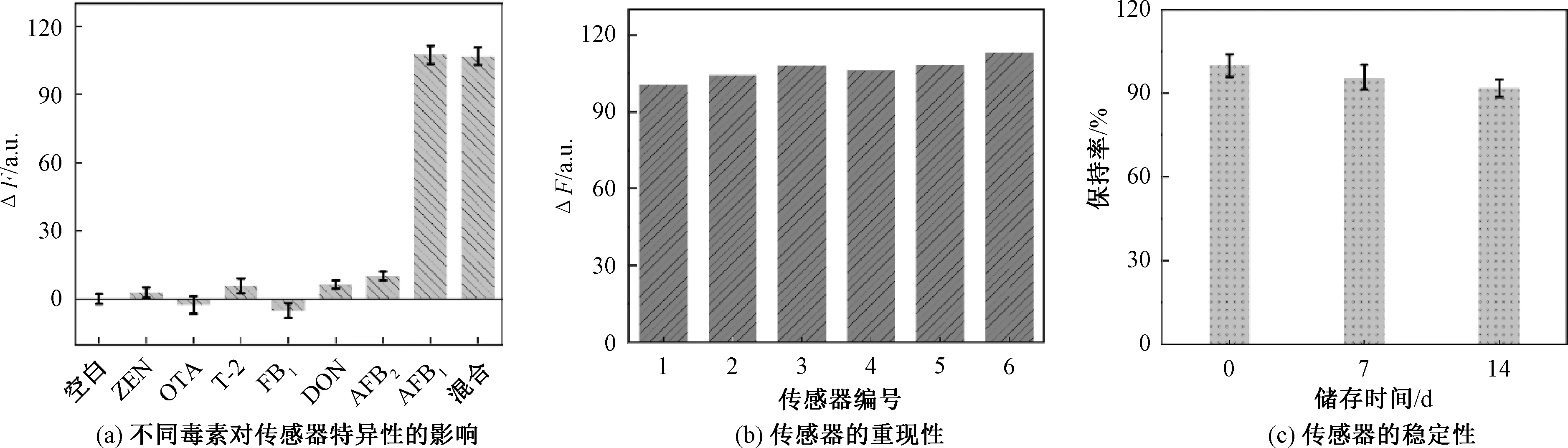
注:(a)中混合毒素为FB1、ZEN、T-2、DON、AFB2、OTA及AFB1的混合溶液;(b)(c)中AFB1质量浓度为50 ng/mL。图5 传感器的性能研究Fig.5 Detection performance study of sensors
在相同检测条件下,测定了6个独立传感器的荧光响应值(图5(b)),RSD为3.60%,说明X型DNA荧光传感器具有良好的重现性。在相同检测条件下,按照1.3.1的方法制备传感器,并在4 ℃下储存。储存7 d后,传感器的荧光强度保持在95%以上,储存14 d后,荧光强度仍保持在90%以上(图5(c)),说明制备的X型DNA荧光传感器具有良好的稳定性。
2.6 实际样品检测
通过在实际样品中添加标准AFB1进行回收率试验[34-35]评价该传感器的准确性。对红茶和玉米粉样品进行了加标检测,AFB1的添加量分别为0、0.10、1、10 ng/mL。由表2可知,红茶和玉米粉样品中AFB1的平均回收率为92.60%~107.30%和92.10%~104.40%,RSD均低于15%,表明所制备的传感器具有较高的准确性。同时,采用HPLC测定玉米粉质控样品中AFB1,测定结果为0.14 ng/mL,采用本文荧光传感器测定结果为0.15 ng/mL,进一步验证了传感器的准确性。采用t检验进行分析,测定玉米粉中AFB1,计算得到t为0.52<4.303(理论值),说明在95%的置信水平下本方法与HPLC无显著性差异。由此可知,所制备的X型DNA传感器在食品安全检测领域具有较好的实际应用潜力。
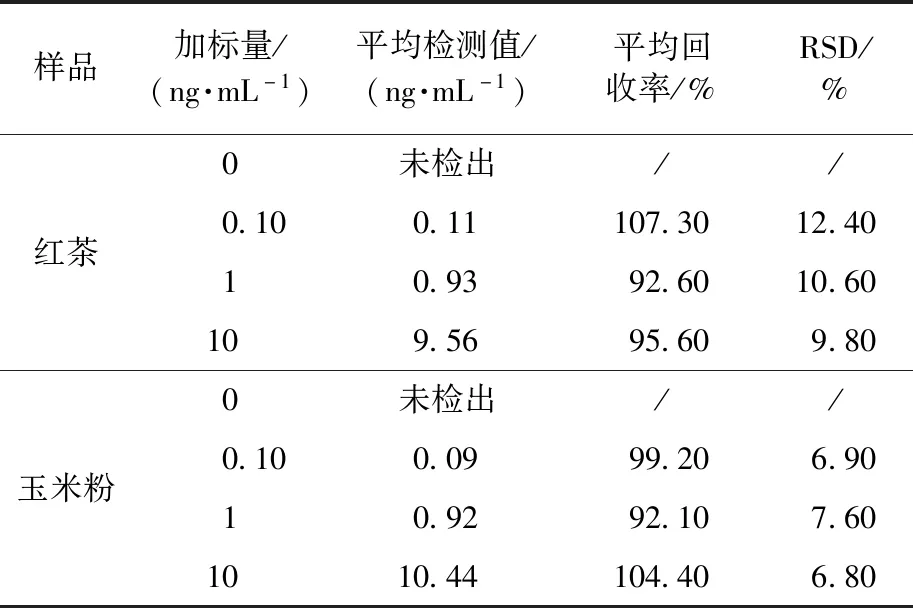
表2 实际样品的检测结果 (n=3)Table 2 Detection results of real samples (n=3)
3 结论
制备了一种基于X型DNA纳米结构的荧光传感器检测AFB1,所设计的X型DNA纳米结构可同时接入4条FAM-Apt,当AFB1存在时将优先与FAM-Apt结合,游离于上清液中,采用磁分离的方法,可以实现对AFB1的高效检测。最优试验条件下,在AFB1质量浓度为0.05~100 ng/mL时,线性方程为ΔF=56.53+30.62lg(ρAFB1)(R2=0.99),LOD为9 pg/mL。特异性研究结果表明该传感器选择性良好。对红茶和玉米粉进行了加标测试,平均回收率为92.60%~107.30%和92.10%~104.40%,RSD均低于15%,表明该传感器对实际样品的检测具有较高的准确性。此外,该传感器有望与纸基相结合,构建高通量纸基传感器实现对AFB1快速检测,使其能更好地应用于现场检测。

