虾青素的运载体系研究进展
孟豪杰,潘 丽*,刘彦君,李 茜,郭雨禾,张傲涵
1.河南工业大学 国家粮食和物资储备局粮油食品工程技术研究中心/河南省重点实验室,河南 郑州 450001
2.中粮(郑州)粮油工业有限公司,河南 郑州 450016
虾青素(Astaxanthin,ATX)是一种天然类胡萝卜素,广泛存在于水生生物、真菌生物及动物羽毛中[1]。由于天然虾青素具有强抗氧化性和多种生理功能,因此在医药、食品和化妆品等领域被广泛应用。但虾青素化学性质不稳定,在加工、贮藏和运输途中容易受环境的影响从而丧失生物活性。此外,虾青素水溶性差,在消化液中的低溶解度以及与肠道中胆碱、脂类等的结合会影响虾青素的生物利用度,限制了其在食品工业中的应用[2]。因此,研究开发稳定的虾青素运载体系对提高其生物利用度具有重要意义。
国内外研究发现通过运载体系对虾青素进行包埋,可有效地降低环境因素对虾青素的影响,控制其靶向释放,提高其稳定性和生物利用度[3]。传统乳液运载体系能有效解决虾青素水溶性差的问题,在传统乳液的基础上发展而来的Pickering乳液和多重乳液等新型乳液运载体系,可以显著提高虾青素的化学及储藏稳定性[4-5]。以生物大分子做壁材对虾青素进行包埋形成的微胶囊和纳米颗粒,保护虾青素的同时可以提高其生物利用度[6-7]。此外,由磷脂合成的脂质体和固液混合脂质合成的纳米结构脂质载体都具有较高的药物负载能力[8-9]。
然而,每种运载体系均存在不同程度的缺陷,乳液运载容易受到温度、pH值等外界条件的影响从而导致虾青素泄漏,脂质体是热力学不稳定体系,存在易聚集、氧化及芯材泄漏等问题。选择虾青素运载体系时需要考虑具体的应用场景和目的,同时,还需要进行大量的实验研究来验证不同运载体系的效果和适用性。本文对多种运载体系的构建方法、技术手段及运载效率进行了分析,对比不同运载体系的优缺点,整理出虾青素运载体系的优化思路,以期为虾青素的实际应用提供理论参考。
1 虾青素简介
1.1 虾青素结构与性质
虾青素,又名虾黄质,常温下天然虾青素呈红色固体粉末状,不溶于水,易溶于二氯甲烷、氯仿等有机溶剂[10]。虾青素是一种酮式类胡萝卜素,也是非维生素A原的类胡萝卜素,化学名称为3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,分子式为C40H52O4[1]。
虾青素在肉及内脏中主要以游离形式存在,而在红酵母和雨生红球藻中主要以酯化形式存在。游离态的虾青素结构中存在着共轭双键和不饱和的酮基与羟基,导致其极不稳定,易被氧化,而虾青素可以通过其末端的羟基与脂肪酸形成酯键以酯化态的形式来提高稳定性[11]。
1.2 虾青素的生理功能
虾青素有多种生理功能,如抗氧化、提高机体免疫力、预防癌症和心血管疾病、抗炎、抗肿瘤等[2]。虾青素抗氧化活性是玉米黄质、叶黄素、角黄素和β-胡萝卜素的10倍,是α-生育酚的100倍[12]。虾青素可以增强免疫力,可能与虾青素的抗氧化活性相关。单线态氧会促进动物体内自由基的生成,而自由基会影响巨噬细胞、T淋巴细胞及B淋巴细胞的完整性。虾青素可以淬灭单线态氧,清除氧自由基,稳定免疫细胞膜结构,通过保护各种免疫细胞的完整性增强免疫力。在细胞免疫方面,虾青素可以促进小鼠脾淋巴细胞增殖;在体液免疫方面,虾青素可以提高血清溶血素水平,促进抗体产生[13];在抗癌方面,虾青素不仅可以诱导癌细胞凋亡、促进癌细胞自噬,还可以抑制癌细胞增殖、转移与分化,调控癌细胞周期[1]。
2 虾青素运载体系
虾青素在食品、药品、化妆品、动物饲料等行业中都有广泛的应用,通过不同运载体系对虾青素进行包埋,可以提高其稳定性与生物利用度。依据粒径大小,可以将虾青素运载体系分为微米级运载体系和纳米级运载体系。根据包埋虾青素的壁材、技术方法和最终形态不同,虾青素运载体系可分为乳液(Nanoemulsion)、微胶囊(Microcapsule)、纳米颗粒(Nanoparticle)、脂质体(Liposome)和纳米结构脂质(Nanostructured lipid carrier,NLC)载体[14],示意图见图1。
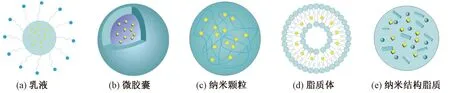
图1 不同运载体系示意图Fig.1 Different delivery systems for loading astaxanthin
2.1 乳液
乳液是将生物活性物质溶解在有机相或水相中,在外力的作用下将水相与有机相混合,通过乳化剂降低界面张力,形成稳定的胶体体系。乳液运载体系包埋可以防止生物活性物质被降解,提高其稳定性和生物利用度[15]。传统乳液对活性物质进行包埋容易泄漏,导致包埋率较低,且在储藏期间容易出现分层和凝絮现象,不利于长期储存。为了解决这些问题,研究人员已开发出了多种新型乳液运载体系,如微乳液、纳米乳液、多层乳液、Pickering乳液和非水纳米乳液。
微乳液通常指将油、水和表面活性剂混合在一起形成的热力学稳定体系[16]。Li等[17]使用共晶溶剂、吐温80和水组成新型微乳液负载虾青素,显著提高了虾青素的溶解度和抗氧化活性。纳米乳液是由两种不混溶液体组成的胶体分散体系,与传统乳液相比,纳米乳液对虾青素的包封率更高,主要是由于纳米乳液粒径较小,分散程度与虾青素嵌入疏水内层的概率都有所增加,进而能够提高虾青素的生物利用度与生物稳定性[14]。Shanmugapriya等[18]采用自发乳化和超声乳化制备的虾青素-α生育酚纳米乳液液滴粒径分别为189~216 nm和106~213 nm,两种方法制备的纳米乳液都具有良好的稳定性,并且在抗癌、伤口愈合和抗菌方面都有显著效果。在食品行业制备乳液的过程中,食品级生物兼容性强的生物大分子乳化剂将逐渐取代化学合成乳化剂。吴婉仪等[19]以大豆卵磷脂为乳化剂,采用高压均质法制备的负载虾青素的纳米乳液粒径为238.84 nm,虾青素的负载率达到了90.41%。在乳液制备的过程中加入不同的稳定剂,如增稠剂、加重剂、质地改性剂及凝胶剂等可以增强乳液的稳定性[20],Xia等[21]将棕榈蜡与二十二烷醇以质量比1∶4组合后得到复合凝胶剂,制备了负载虾青素的复合油凝胶纳米乳液,与单凝胶型凝胶相比,虾青素的生物利用度明显提高。非水纳米乳液是使用油相取代乳液常用的水相形成油包油乳液,Sun等[22]使用高压均化技术用甘油代替水相,解决了传统乳液水相中氧溶解导致虾青素降解的问题。多层乳液是由带相反电荷的乳化剂通过静电相互作用稳定乳液体系,通过用多层可食用生物聚合物包覆脂滴,提高乳液的理化稳定性[23-24]。Liu等[4]使用脂滴、壳聚糖和果胶对虾青素进行多层包覆制备多层乳液,结果表明,多层包覆改善了虾青素的化学稳定性,储存期间虾青素在多层乳液中的降解速率为传统乳液的1/4~1/3。Pickering乳液是使用固体颗粒作为乳化剂,通过降低油水之间的界面能,从而形成的一种具有强抗聚集、低乳液毒性的稳定乳液[25]。Zhang等[5]将食品级的鳕鱼蛋白-壳聚糖纳米复合物作为乳化剂制备了高内相Pickering乳液,由于静电作用,鳕鱼蛋白-壳聚糖组成的纳米复合物比鳕鱼蛋白颗粒具有更强的乳化能力,显著提高了虾青素的化学稳定性,虾青素的生物利用度达到了49%。
综上,乳液体系运载虾青素的研究可以侧重于以下4个方面:控制包埋虾青素的脂滴粒径,小粒径脂滴可以加快虾青素的释放和溶解,提高虾青素的生物利用度;在乳液制备的过程中根据实际应用的不同需求选择稳定剂,提高乳液稳定性;选用食品级和生物相容性好的乳化剂可以拓展虾青素的应用范围;优化乳液工艺或开发新型乳液运载体系。
2.2 微胶囊
微胶囊主要由芯材和壁材两部分组成,用高分子材料(壁材)包埋所需物质(芯材)形成微小粒子的过程称为微胶囊化。微胶囊化可以使液态成分转化为固态,并在使用时保持良好的液相反应性,还具有延长芯材的储存时间、掩盖气味和提高稳定性等特点。微胶囊的包埋效果主要取决于壁材和制备工艺。目前在食品行业中,喷雾干燥、冷冻干燥、复合凝聚、空气悬浮和分子包埋是常用的微胶囊制备方法[26-27]。
Yang等[27]以5种不同的蛋白质基质作为壁材制备虾青素微胶囊,结果表明5种蛋白壁材均能显著提高虾青素的生物利用度,以乳清蛋白为壁材制备的微胶囊不仅生物利用度最高,而且有效提高了虾青素的稳定性及水溶性。康雪帆等[28]使用木糖和葡萄糖接枝改性过的玉米醇溶蛋白作为壁材,制备虾青素微胶囊,与未改性的玉米醇溶蛋白相比,虾青素的包埋率提高了10%。Shen等[29]分别以乳清分离蛋白-可溶性玉米纤维与酪蛋白酸钠-可溶性玉米纤维两种材料为壁材,采用喷雾干燥法制备虾青素微胶囊,两种壁材体系的微胶囊化效率都达到了95%,说明这两种亲水基质都适合包埋虾青素,在功能性食品中有广阔的应用前景。方溶熙等[30]使用疏水性深共晶溶剂溶解虾青素制备微胶囊,解决了虾青素微胶囊有机溶剂残留的问题。Morales等[31]对多层乳液进行喷雾干燥制备的虾青素微胶囊具有高溶解度、低水分和高包封率等优点。喷雾干燥法成本低、耗时短、工业生产效率高,是当前制备微胶囊的主要工艺。然而,制备微胶囊时,较高的干燥温度和过度的蒸发会导致其表面出现裂缝,降低微胶囊的稳定性[28]。冷冻干燥可以避免喷雾干燥因温度产生的问题,Feng等[32]通过冷冻干燥制备虾青素微胶囊,提高了虾青素的溶解性、稳定性和抗氧化活性。复合凝聚法制备微胶囊主要是利用带有相反电荷的两种或多种高分子材料作为壁材,把芯材分散到壁材溶液中,在适宜状态下发生交联后再和芯材凝聚形成微胶囊[33]。Zhou等[6]选择乳清蛋白和阿拉伯胶作为壁材,通过复合凝聚法制备的虾青素微胶囊显著提高了虾青素的生物利用度。
微胶囊技术可以有效地保护虾青素,在食品、医药和化妆品等领域已经初步应用。对于微胶囊而言,壁材的选择尤为重要,不同的壁材决定着产品的物化性质及芯材的释放效果[31]。因此,壁材的选择、开发或优化工艺是未来微胶囊研究的主要方向。
2.3 纳米颗粒
纳米颗粒运载体系是纳米运载体系中的一种,通过纳米颗粒对生物活性物质成分进行包埋并递送,从而实现对生物活性成分的传递和控释[34]。
Sorasitthiyanukarn等[7]采用油水乳化-离子凝胶法制备了负载虾青素的壳寡糖/藻酸盐纳米颗粒(ATX-coanps),与游离虾青素相比,包埋后虾青素的稳定性、生物利用度和抗氧化活性均显著提高。Hu等[35]利用硬脂酸-壳聚糖偶联物、酪蛋白酸钠和氧化葡聚糖制备了复合纳米颗粒,其平均粒径为120 nm,分布均匀,具有较高的封装率,并且包埋后的虾青素水分散性显著提高。Edelman等[3]将溶解在乙醇中的虾青素滴加到马铃薯蛋白中形成马铃薯蛋白-虾青素纳米颗粒,经模拟胃肠道消化后,包埋后的虾青素保留率达78%,生物利用度是未包封的11倍。Chen等[36]利用三苯基溴化膦修饰糖基化蛋白,制备了新型纳米颗粒,体外试验表明,新型虾青素纳米颗粒能显著保护细胞免受氧化损伤,维持正常的线粒体膜电位水平。Kaga等[37]采用超临界流体分散法制备聚乙烯吡咯烷酮-虾青素纳米颗粒,发现压力对颗粒粒径有显著影响,在较高的密度下,由于快速混合和传质,颗粒粒径随压力的增大而减小。
纳米颗粒负载虾青素通常利用生物大分子作为载体,如多糖、蛋白质和蛋白质-多糖复合物,蛋白质和多糖这种天然存在的生物大分子具有良好的生物相容性和生物可降解性等优点。然而,环境条件的改变(如pH值、温度、离子强度等)会影响这些生物大分子之间的相互作用,进而影响纳米颗粒的稳定性[34],寻找新型生物大分子作为载体制备纳米颗粒或许是提高虾青素生物利用度的有效途径。
2.4 脂质体
脂质体是由磷脂在水中聚集形成的双分子层结构的囊泡[38],其结构与细胞膜类似。作为负载营养素的运输载体,脂质体具有良好的生物相容性,可以保护被包裹的营养素不被氧化,提高其稳定性和生物利用度。脂质体的独特优点在于由磷脂构成的双层膜,磷脂分子在形成脂质体时会在双分子层内部排列疏水基团,脂质体内外排列亲水性基团。亲水性的头部在囊泡的内外表面,囊泡内部可以包埋亲水性物质,亲脂性的尾端可以形成疏水区包埋亲脂性物质。
Pan等[39]以大豆磷脂为原料,采用薄膜分散-超声技术将虾青素包埋在纳米脂质体中,研究表明负载虾青素的纳米脂质体具有包封率高、粒径小、粒径分布均匀等优点,经纳米脂质体包裹后的虾青素热稳定性明显增强,水分散性显著提高。虾青素脂质体在储藏期间易发生降解与沉淀,对其进行修饰和改性可以有效地提高虾青素脂质体的稳定性。Qiang等[40]以蛋黄卵磷脂和胆固醇为原料,采用薄膜分散-超声法制备虾青素脂质体,然后用壳聚糖盐酸盐(Chitosan hydrochloride,CH)和乳铁蛋白(Lactoferrin,LF)对脂质体进行修饰,CH和LF通过静电作用在脂质体表面进行包覆,增强了CH-ATX脂质体和LF-ATX脂质体的理化性质和稳定性。Pan等[41]利用乳清分离蛋白涂层包覆虾青素脂质体,与未包覆的脂质体相比,包覆的虾青素脂质体的热稳定性明显增强。此外,乳清分离蛋白包覆的虾青素脂质体在加热和光照作用下的物理稳定性也得到了提高。常见制备脂质体的方法除了薄膜水化法还有反向蒸发法和乙醇注入法。反向蒸发法制备脂质体是通过将活性物质溶于缓冲液,在洗膜的过程中实现对活性物质的包埋,进而形成脂质体。该方法制备的脂质体包封率高、稳定性好,适用于包埋水溶性物质,但易受离子强度影响,在一定条件下,离子强度增大,包封率会随之降低[42]。李啟彬等[43]采用反向蒸发法制备细菌素QY-C与虾青素复合纳米脂质体,虾青素的包封率达到了80%以上。乙醇注入法制备脂质体是通过注射器将油相以滴加的方式加入水相中,然后进行水化,蒸发去除有机溶剂后,再通过超声等方法形成脂质体。因乙醇注入法制备工艺简单,是目前制备脂质体的主要方法,但该方法制备的脂质体包封率相对较低。杨安平等[44]采用乙醇注入法制备虾青素脂质体,制备工艺优化后,平均包封率为(35.28±0.93)%。脂质体制备过程中会加入胆固醇用于提高脂质体膜稳定性,但是胆固醇摄入过多对人体健康会产生一定的危害,而利用类固醇制备脂质体可以避免胆固醇的负面作用。常振刚等[45]和Srihera等[8]分别选择植物甾醇油酸酯和海参硫酸甾醇代替胆固醇制备虾青素脂质体,包封率均达到了93%以上。
薄膜分散-超声技术是实验室制备虾青素脂质体的常用方法,具有粒径小、包封率高、稳定性强等优点。未来关于脂质体负载虾青素的研究重点可以放在以下几个方面:对脂质体进行修饰提高虾青素的稳定性,使用类固醇取代胆固醇从而拓宽虾青素的应用范围,优化和开发新工艺确保虾青素具有较高包封率的同时适合工业化生产。
2.5 纳米结构脂质
纳米结构脂质是基于固体脂质纳米颗粒运载体系进一步改进得到,它的基质是由液体脂质和固体脂质混合制成,其结构中的甘油三酯脂肪酸链和固体脂质链之间存在间隙,从而提高了载药率。又因为固体脂质熔化需要一定的温度,而固液混合脂质可以降低脂质的熔点,所以纳米结构脂质是一种应用更加广泛的运载体系[46]。
Rodriguez-Ruiz等[47]以葵花籽油为液体脂质,采用热均化法合成虾青素纳米脂质,提高了虾青素稳定性和抗氧化活性。Geng等[48]以硬脂酸、单硬脂酸甘油酯等作为固体脂质,豆油、肉豆蔻酸异丙酯作为液体脂质采用乳化超声法制备新型的虾青素纳米结构脂质,具有粒径小、粒径分布均匀、封装效率高及稳定性好等特点。高红[49]采用均质乳化-探头超声法制备虾青素纳米脂质,对其工艺进行优化后得到的脂质载体平均包封率为81.36%。Huang等[50]通过高压均质法制备了虾青素纳米脂质,然后将其加入海藻酸微凝胶中进行二次包覆,显著提高了虾青素的化学稳定性。毛昕宇[9]采用热高压均质法制备了包封率为94.8%的虾青素纳米脂质,具有明显缓释效果。
制备纳米结构脂质载体方法主要有微乳液法、溶剂扩散法、乳化超声法和高压均质法等,而用于包埋虾青素的方法主要有乳化超声法和高压均质法。乳化超声法因工艺条件限制,多用于实验室制备。高压均质法制备工艺简单,适合工业化生产,但制备过程中过高的温度、过度的均质化压力和均化次数等因素都不利于乳液的稳定性,同样会影响到工业化生产的成本及效率[9]。制备工艺和油相的选择是影响纳米结构脂质载体的重要因素,因此,对纳米脂质载体进行修饰、改善制备工艺条件或选用多种复合脂质都将有助于提高虾青素的生物利用度。
虾青素运载体系优缺点及改进方法见表1。

表1 运载体系优缺点及改进方法Table 1 Advantages,disadvantages and improvement methods of the delivery systems
3 结论及展望
由于虾青素优异的生理功能,其在食品、药品、化妆品等领域的应用需求逐渐增大,根据不同的需求选择运载体系,可以使虾青素发挥出优异的生理功能。将虾青素溶于油相中制备成乳液可以有效解决水溶性差的问题。通过多糖或者蛋白质等生物大分子对乳液进行包封,形成的微胶囊能显著提高虾青素的稳定性。纳米结构脂质同时使用固体和液体脂质提高纳米结构脂质的载药率。脂质体具有良好的生物相容性和高包封率等特点,是极具发展潜力的一种运载体系。目前有关虾青素运载体系的研究多集中在包封率和稳定性上,未来的研究需要着重于载药率、靶向性及毒理学安全性,从而实现虾青素的高效利用。关于优化虾青素运载体系的研究可着重于以下3个方面:运载工艺条件的优化、运载体系修饰、多种运载体系有效的结合,从而开发出更稳定、高效且适合工业化生产的虾青素运载体系。

