经血间充质干细胞及其培养液对化疗致早发性卵巢功能不全小鼠的治疗作用
余柯达,毛佳婷,柴娟,包云,师帅
(金华市人民医院生殖医学中心,金华 321000)
早发性卵巢功能不全(POI)是一种常见内分泌疾病,会导致女性不孕,其具有病因复杂及临床异质性高等特点。POI临床表现为女性在40岁之前发生闭经,血清卵泡刺激素(FSH)升高、雌激素(E2)下降。POI的病因目前尚不完全明确,与遗传缺陷、自身免疫和化疗损伤等诱因有关[1]。近年来育龄女性癌症的发病率逐年上升,化疗暴露成为了POI的重要诱因[2]。环磷酰胺(CTX)是临床常用于恶性肿瘤治疗的烷化剂,会损伤女性的生殖系统,导致POI的发生[3]。目前对POI的治疗手段极为有限,临床上以激素替代疗法(HRT)为主,但无法恢复患者的卵巢功能和生育能力[4]。因此如何安全有效地改善POI患者的卵巢功能、恢复其生育能力是目前临床上急需解决的重要问题。
近年来,研究发现间充质干细胞(MSCs)移植可有效改善 POI模型动物的卵巢功能及生育能力[5-9],成为了生殖内分泌研究领域的热点。有研究者从经血中新发现了一种MSCs——经血间充质干细胞(MenSCs)[10-11]。相较于其他MSCs,MenSCs具有取材易、来源广、含量多等优点,且来源于人体废弃物,无伦理问题,具有广阔的基础研究和临床应用潜力[12]。本研究探讨了MenSCs及其培养液(MenSCs-CM)对CTX诱导的POI小鼠模型卵巢功能的修复作用,为临床POI的治疗提供新的方法。
资料和方法
一、研究对象
1.实验动物与细胞:健康ICR雌性小鼠,6周龄,SPF级,体质量约27 g,购自杭州子源实验动物科技有限公司[生产许可证号:SCXK(浙)2019-0004],在恒温恒湿环境下饲养,提供12 h光照/12 h黑暗环境,正常昼夜节律自由饮食。所有实验操作经医院实验动物管理与使用委员会核准通过。
MenSCs原代细胞由本实验室从女性志愿者经血中分离培养得到[13]。
2.主要试剂和仪器:CTX(Sigma,美国);卵泡刺激素(FSH)ELISA试剂盒(上海江莱生物),雌二醇(E2)ELISA试剂盒(上海江莱生物);苏木精(Sigma,美国),伊红(Sigma,美国);TUNEL检测试剂盒(Roche,美国)。全波长酶标仪(MD,美国);低速自动平衡离心机(湖南湘仪);轮转式切片机(LEICA,德国);病理组织漂烘仪(常州市郝思琳);显微镜(OLYMPUS,日本);隔水式恒温培养箱(上海跃进)。
二、研究方法
1.MenSCs/MenSCs-CM制备[13]:选择生长状态最好的第4代MenSCs,用无血清培养基(Gibco,美国)培养3 d(37℃,5% CO2),收集培养基,此时的培养基即为MenSCs-CM。贴壁的MenSCs用胰蛋白酶(Gibco,美国)消化,无血清培养基洗涤后制成浓度为l×106/ml单细胞悬液,即MenSCs。
2.分组及治疗:ICR雌性小鼠经阴道脱落细胞涂片检查确定小鼠动情周期正常后,随机分为4组:对照组(n=30)、POI组(n=30)、POI+MenSCs组(n=30)和POI+MenSCs-CM组(n=30)。POI组、POI+MenSCs组和POI+MenSCs-CM组给予CTX 50 mg/kg/d腹腔注射,连续注射15 d,构建POI模型[14],对照组腹腔注射同体积的生理盐水。在POI模型建立的第7天对POI+MenSCs组和POI+MenSCs-CM组小鼠分别尾静脉注入0.6 ml的MenSCs或MenSCs-CM治疗,对照组和POI组小鼠注射相等体积的无血清培养基,尾静脉注射后第3天再注射1次。分别于治疗后第7天和第14天进行取材检测。
3.取材:所有小鼠在取材前两天进行孕马血清促性腺激素(PMSG,苏州苏牧)注射,使各组的动情周期一致。小鼠处死前,称取其体重,摘眼球取血,分离血清。处死小鼠后从卵囊内取出卵巢,称取两侧卵巢重量,计算卵巢脏器系数,卵巢脏器系数=卵巢重量/体重×100%。
4.血清FSH、E2测定:用ELISA法测定血清FSH、E2的含量,操作步骤严格按照试剂盒说明书进行。
5.HE染色观察卵巢形态:小鼠卵巢在4%多聚甲醛中固定过夜,脱水后用石蜡包埋,行常规HE染色,在显微镜下观察卵巢组织和卵泡形态,计数各级卵泡(原始卵泡、初级卵泡、次级卵泡、窦状卵泡和闭锁卵泡)[15]。
6. TUNEL法检测卵巢组织中细胞凋亡:应用试剂盒观察卵巢组织中细胞凋亡情况,阳性细胞的细胞核为棕黄色或棕褐色染色,计算卵巢组织细胞凋亡指数,凋亡指数=阳性细胞数/总细胞数×100%。
7.小鼠生育能力的观察:在治疗后第7天将雌鼠与证实可育的雄鼠按1∶1进行合笼饲养10 d,观察小鼠的怀孕和幼崽情况,记录每窝小鼠的产仔数,并称取幼崽出生时的体重。
三、统计学分析
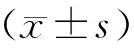
结 果
一、各组小鼠卵巢脏器系数和血清性激素检测结果
治疗第7天,POI组的卵巢脏器系数显著低于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著高于POI组(P<0.05);治疗第14天,各组的卵巢脏器系数变化趋势与治疗第7天一致(图1A)。治疗第7天和第14天,POI组的血清FSH水平显著高于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著低于POI组(P<0.05),POI+MenSCs组显著低于POI+MenSCs-CM组(P<0.05,图1B)。治疗第7天,POI组的血清E2水平显著低于对照组(P<0.05),POI+MenSCs组、POI+MenSCs-CM组与POI组组间比较均无显著差异性(P>0.05);治疗第14天,POI+MenSCs组和POI+MenSCs-CM组的血清E2水平均显著高于POI组(P<0.05),POI+MenSCs组显著高于POI+MenSCs-CM组(P<0.05,图1C)。
A:小鼠的卵巢脏器系数;B:血清FSH水平;C:血清E2水平。7 d和14 d分别代表治疗7、14 d后;组间相互比较,*P<0.05。图1 各组小鼠的卵巢脏器系数、血清FSH和E2结果
二、各组小鼠卵巢组织形态学观察和卵泡计数结果
HE染色结果显示,对照组卵巢结构完整,可见正常发育、结构整齐、大小不一的各级卵泡;POI组卵泡数量较对照组明显减少,且大部分发育不良,可见闭锁卵泡;POI+MenSCs组和POI+MenSCs-CM组的卵巢组织较POI组各级卵泡数量增加,闭锁卵泡明显减少(图2)。

图2 各组小鼠卵巢组织形态学观察(HE染色,bar=250 μm)
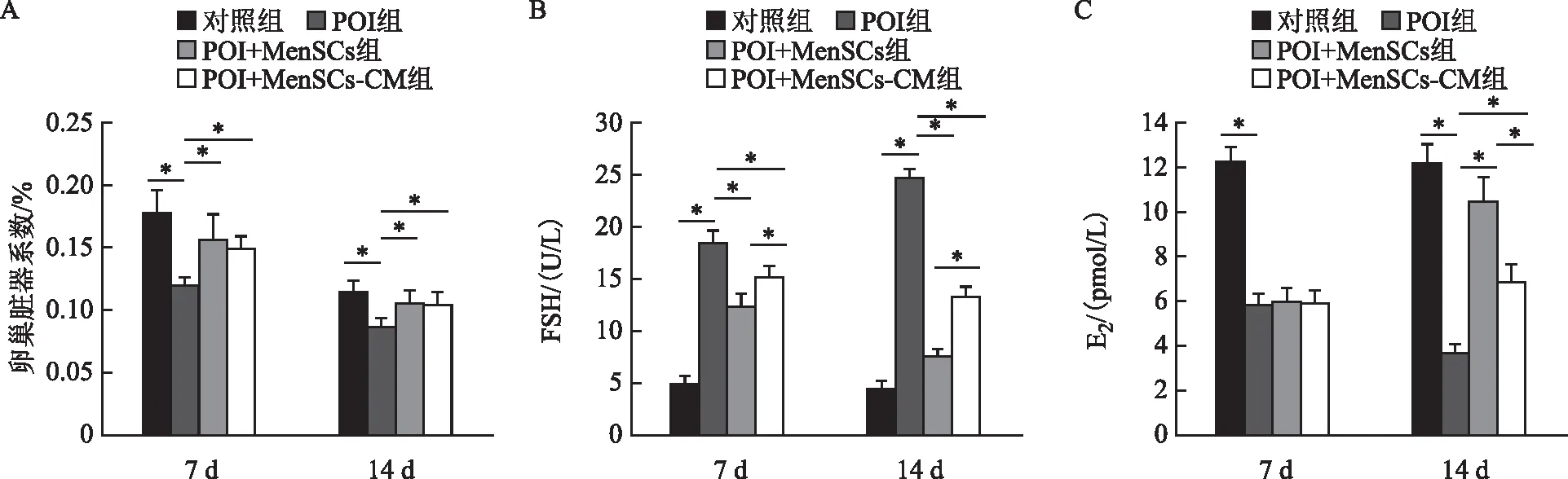
卵巢组织卵泡计数结果显示,治疗第7天和第14天,POI组的原始卵泡、初级卵泡、次级卵泡和窦状卵泡的数量均显著少于对照组(P<0.05),闭锁卵泡数显著多于对照组(P<0.05);POI+MenSCs组和POI+MenSCs-CM组的原始卵泡、初级卵泡、次级卵泡和窦状卵泡数量均显著多于POI组(P<0.05),闭锁卵泡数显著少于POI组(P<0.05);POI+MenSCs组的初级卵泡、次级卵泡和窦状卵泡数量均显著多于POI+MenSCs-CM组(P<0.05),闭锁卵泡数显著少于POI+MenSCs-CM组(P<0.05)(图3)。
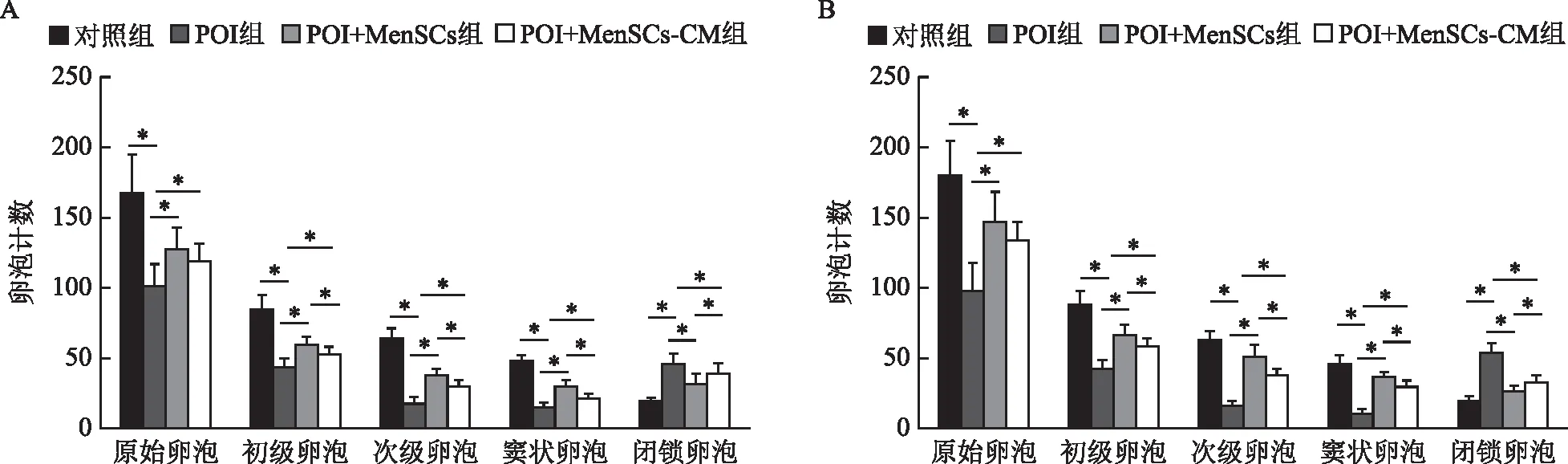
A:治疗7 d后;B:治疗14 d后。组间相互比较,*P<0.05。图3 各组小鼠卵巢组织中各级卵泡计数
三、各组小鼠卵巢组织细胞凋亡水平比较
卵巢组织细胞凋亡结果显示,凋亡细胞大部分为成熟卵泡周边及内部的颗粒细胞(GCs)(图4)。治疗第7天和第14天,POI组的凋亡指数显著高于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著低于POI组(均P<0.05),POI+MenSCs组显著低于POI+MenSCs-CM组(P<0.05)(图5)。
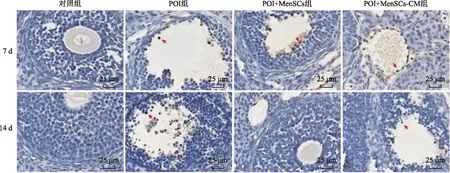
红色箭头指示凋亡细胞。图4 各组小鼠卵巢组织细胞凋亡结果(TUNEL染色,bar=25 μm)
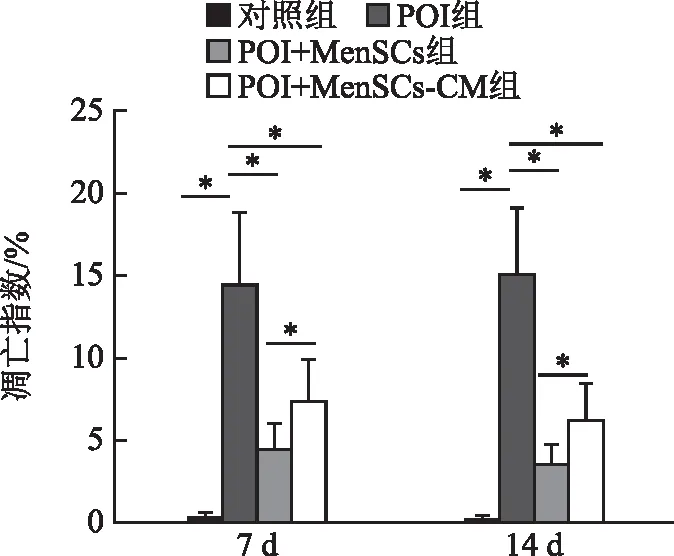
7 d和14 d分别代表治疗7、14 d后;组间相互比较,*P<0.05。图5 各组小鼠卵巢组织细胞凋亡指数
四、各组小鼠生育能力比较
小鼠交配实验结果显示,POI组的幼崽数显著少于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著多于POI组(P<0.05)。各组小鼠的幼崽体重变化趋势与幼崽数一致(图6)。

A:产仔数量统计图;B:幼崽体重统计图。组间相互比较,*P<0.05。图6 各组小鼠产仔数量和幼崽体重情况
讨 论
MSCs作为一种成体干细胞,具有强大的增殖和自我更新能力,其广泛存在于骨髓、脂肪和脐带等组织中[16]。MSCs移植治疗为组织修复和功能重建开拓了崭新的方向。2007年有研究者首次从女性经血中分离得到并鉴定了MenSCs[11]。MenSCs来源于女性经血,经血是一种人体废弃物,没有伦理上的相关问题,且意味着可以不断地从同一个女性志愿者的经血中获得具有相同遗传背景的MenSCs,为其理论基础研究和临床应用转化提供了极大的便利。本研究所用从经血中分离得到的MenSCs,具有MSCs典型的形态、细胞表面标志物和生物学特性[13]。
MSCs具有自我更新、可塑性强、低免疫原性等特点,在组织功能重建,机体损伤修复和免疫调节等方面具有重要应用价值,是现代生物医学领域中的热点之一[17-18]。本研究结果发现MenSCs尾静脉注射治疗化疗所致POI模型小鼠后,卵巢脏器系数增加,血清FSH和E2水平恢复,GCs凋亡显著减少,生育能力(产仔数和幼崽体重)得到提高,使POI模型小鼠的卵巢结构和功能损伤得到修复。与骨髓间充质干细胞(BMSCs)[5]、羊膜间充质干细胞(AMSCs)[7]、绒毛膜间充质干细胞(CPMSCs)[8]和脐带间充质干细胞(UCMSCs)[9]等MSCs对化疗所致POI治疗方面具有一致的效果。表明MSCs移植可改变局部组织反应及其内分泌激素的分泌,改善激素水平,促进卵泡发育,抑制卵巢过多卵泡闭锁和GCs凋亡,提高卵巢储备能力,从而修复卵巢功能。但由于移植MSCs治疗化疗所致POI具有恶变和医源性感染的风险,以及免疫排斥和稳定安全性等问题,严重限制了其在POI治疗上的进一步发展。
关于目前MSCs治疗POI的主要机制,多数研究认为是其通过旁分泌作用来修复、调节、治疗卵巢功能。有研究表明BMSCs[19]、UCMSCs[9]和AMSCs[20]尾静脉注射POI模型鼠后卵巢功能得以恢复,均未观察到MSCs向卵巢细胞分化,更多的是通过旁分泌途径来抑制GCs凋亡,改善卵巢局部微环境,进而恢复卵巢功能。本研究将MenSCs-CM通过尾静脉注射POI模型小鼠,发现其与MenSCs有一致的治疗效果,对血清性激素水平(FSH、E2)恢复和GCs凋亡的改善作用稍差于MenSCs,但对生育能力(产仔数和幼崽体重)的提升作用与MenSCs无显著差异性。
MSCs在培养过程中会分泌细胞因子和胞外囊泡(EVs)。MSCs分泌的细胞因子,例如血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)和肝细胞生长因子(HGF),在恢复卵巢功能中起重要作用[21]。Li等[8]研究认为MSCs对POI卵巢的修复作用,是通过其分泌的多种细胞因子组合共同发挥作用,而非单个细胞因子。目前研究表明细胞因子无法充分表现MSCs的功效[22],EVs是旁分泌机制中的重要组成部分,主要由外泌体和微囊泡组成,携带具有生物活性的蛋白质、mRNAs和microRNAs(miRNAs)等,参与细胞间的通讯和信号传导,在组织再生中发挥着重要的作用[23-24]。体外和体内研究均表明MSCs分泌的EVs可有效抑制GCs的凋亡,目前已有研究表明MSCs分泌的EVs携带的miR-144-5p、miR-23a、miR-27a、miR-17-5P和miR-320可调控不同通路来抑制GCs的凋亡,恢复POI卵巢功能[25-28]。上述研究表明MSCs分泌的EVs通过自身携带的物质可以起到与MSCs类似甚至同样的治疗效果。
我们的实验仍存在一定的局限性。本研究仅初步探讨了MenSCs及其培养液对化疗所致POI模型小鼠卵巢功能和生育能力的改善作用,并未对MenSCs治疗POI的具体有效分泌产物和分子机制进行探究。因此,接下来MenSCs治疗POI的研究,我们将从MenSCs分泌的EVs以及对卵巢功能相关关键通路进行更深入的研究。

