蜡样透明带卵母细胞患者ICSI助孕活产1例病例报道并文献复习
赵敏,张耀
(电子科技大学医学院附属绵阳医院 绵阳市中心医院,绵阳 621000)
一、病例资料
女方35岁,男方34岁,2019年5月因未避孕未孕2年来我科就诊。
双方初婚,性生活正常。女方2012年患腮腺炎。患者平素月经周期规则,月经初潮13岁,月经周期3~6 d/30~32 d,量中,无痛经。身高158 cm,体重54 kg,体质量指数21.6 kg/m2。自然周期监测排卵有优势卵泡发育及排卵,指导同房,未孕。2019年9月12日在我院行子宫输卵管造影示双侧输卵管通畅;基础窦卵泡5个;抗苗勒管激素(AMH)水平0.984 ng/ml;基础性激素水平检测:雌二醇(E2)117.44 pmol/L、孕酮(P)0.636 noml/L、睾酮0.62 nom/L、黄体生成素(LH)1.79 U/L、卵泡刺激素(FSH)9.89 U/L、泌乳素(PRL)0.62 nmol/L;宫颈液基细胞学结果:无明确意义的非典型鳞状细胞(ASCUS),HPV阴性。男方既往无致孕史,精液分析示畸形精子症。诊断:(1)原发性不孕;(2)卵巢储备功能减退;(3)男方畸形精子症。
2021年1月因卵巢储备功能减退、男方畸形精子症在我科行人工授精助孕治疗1个周期,未孕。2021年4月在我院行第一周期体外受精-胚胎移植(IVF-ET)助孕,因卵巢储备功能减退,给予辅酶Q10、脱氢表雄甾酮(DHEA)、生长激素预处理,拮抗剂方案促排卵,重组人FSH(金塞恒;长春金赛药业)300 U启动,人绒毛膜促性腺激素(HCG)注射日E21 596.45 pmol/L、LH 0.76 U/L、P 0.95 nom/L,获卵3枚;进行IVF短时受精,授精浓度为(5~10)×103条精子/卵母细胞,4 h后去除颗粒细胞观察,其中2枚第1次减数分裂中期(MI)、1枚生发泡期(GV)卵,均见蜡样透明带;20 h后观察受精情况,无正常受精。
2021年7月我院行第二周期助孕,卵泡期高孕激素状态下方案(PPOS)促排卵,拟行ICSI。HCG注射日E2998.24 pmol/L、LH 2.97 U/L、P 0.38 nom/L,获MI卵1枚,见蜡样透明带,未行ICSI。
2021年9月我院行第三周期助孕,黄体期促排卵方案。HCG注射日E22 337.39 pmol/L、LH 6.34 U/L、P 0.64 nom/L,获第2次减数分裂中期(MⅡ)卵3枚,均见蜡样透明带(图1),卵周间隙小。为3枚MⅡ卵母细胞行常规ICSI,行ICSI时透明带弹性欠佳,形成2原核(2PN)胚胎2枚[细胞数/分级/碎片率(%)分别为6/2/0、7/2/5](图2),全胚冷冻。患者要求攒胚胎,于2021年12月在我院行第四周期助孕,黄体期促排卵方案,HCG注射日E22 021 pmol/L、LH 0.62 U/L、P 5.41 nom/L,获MI期卵3枚,均见蜡样透明带。与患者夫妇沟通病情及卵母细胞情况,患者要求为2枚MI卵母细胞行常规ICSI,形成2PN 1枚(7/2/8)、3PN 1枚,全胚冷冻。共冷冻保存3枚2PN卵裂期胚胎。
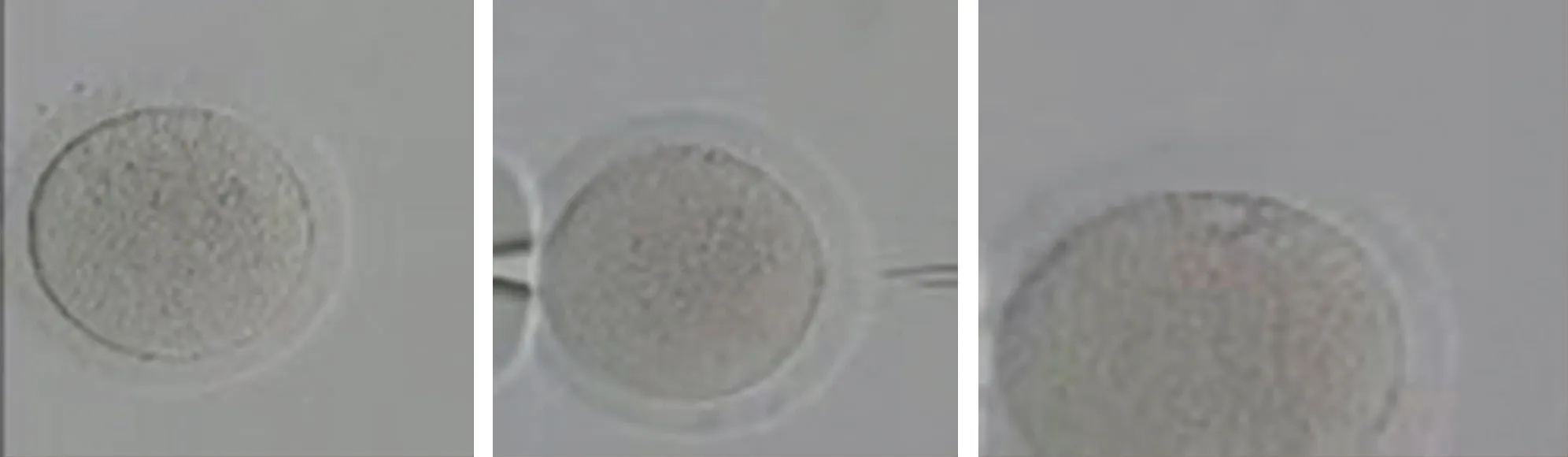
3个卵母细胞均为MⅡ期,周围均可见蜡样透明带。图1 患者第三助孕周期取卵日获得的3枚卵母细胞
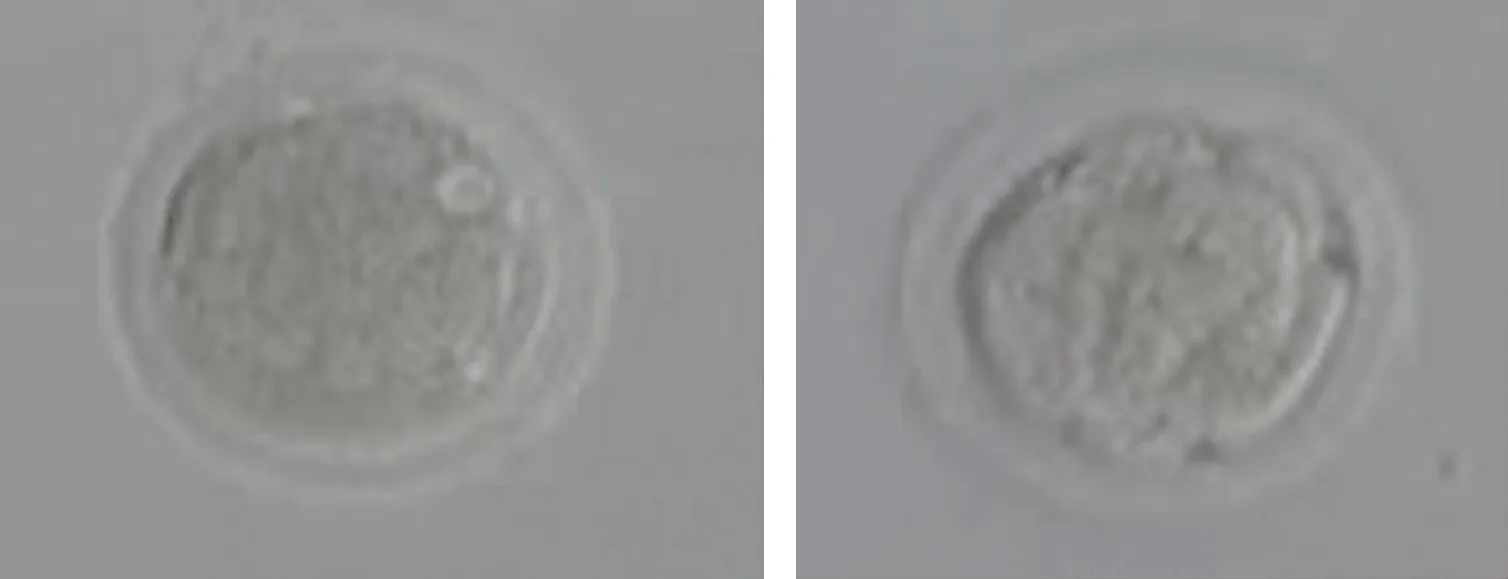
细胞数/分级/碎片率(%)分别为6/2/0(左)、7/2/5(右)。图2 患者第三助孕周期形成的两枚2PN来源的卵裂期胚胎
2022年3月行降调节人工周期准备内膜,复苏移植2枚卵裂期胚胎(6/2/0、7/2/5)。扳机日内膜厚度10 mm,A型内膜。胚胎行激光辅助孵化(削薄范围约透明带的1/4,削薄厚度约50%),获临床妊娠,孕期顺利,于2022年12月19日孕40+1周剖宫产分娩一女活婴,新生儿体重3 300 g、身长50 cm,外观无畸形。
二、讨论
在体外受精周期中,卵母细胞的形态和结构与卵母细胞的发育、受精和后期胚胎质量及妊娠结局息息相关。透明带(zonapellucida,ZP)是卵母细胞的外层,厚度均匀一致,在10~31 μm之间,表面光滑,无锯齿样改变,对卵母细胞及早期胚胎起到保护作用,在精卵识别、精卵结合、阻止多精受精及维护早期胚胎微环境上起到重要的作用。
透明带是由ZP1、ZP2、ZP3和ZP4四种糖蛋白组成的细胞外基质,任何结构或功能的改变都可能导致透明带异常和女性不孕症[1-2]。精子进入透明带后首先与 ZP3 结合并发生顶体反应、透明带反应,从而阻止多精受精。ZP3 单核苷酸多态位点不同的基因型与受精失败相关,ZP3基因的突变可能导致女性不孕[2]。发生顶体反应后的精子与ZP2结合,穿透透明带,如果ZP2基因剪接位点突变引起在ZP2 mRNA中插入额外的61 bp序列,ZP2蛋白减少,影响受精[2]。ZP1变异可导致卵母细胞退化,卵母细胞成熟缺陷,出现不受精[3]。ZP4是精子受体,与精子结合后引发下游信号转导机制的发生,ZP4基因敲除的雌性兔透明带较薄且不规则,影响胚胎发育能力[4]。
有研究显示,透明带的厚度<18.6 μm时,卵母细胞的受精效果最好,如果透明带厚度>22 μm应该采用ICSI才能获得较好的受精结局[5]。常规体外受精一般在受精后 16~18 h剥除卵子周围的颗粒细胞观察才发现透明带形态异常。蜡样透明带在异常透明带中较为常见,蜡样透明带卵母细胞在常规体外受精中可能出现受精失败或低受精。实验室观察到精子可以与蜡样透明带结合,但不能穿透透明带进入细胞质完成受精,因此受精障碍是这类患者不孕的根本原因。ICSI受精是蜡样透明带患者最佳的治疗策略,可避免受精失败或低受精,利于改善临床妊娠结局[6]。
胚胎发育的每个阶段需要有适当的基因表达才能获得高质量的胚胎,从而成功着床并临床妊娠。胚胎形态异常可能与体外受精治疗期间的基因表达有关[7]。ICSI受精过程中观察到蜡样透明带卵母细胞的弹性差、脆性高,推测蜡样透明带的蛋白质结构可能发生了改变。透明带基因的缺失或突变是导致结构和功能异常的最常见原因。最近研究显示ZP1、ZP2和ZP3中的突变会导致异常透明带形成[8-10],蜡样透明带的发生可能与ZP基因的异常表达有关。
目前,体外受精获得的卵母细胞质量一般通过形态、受精能力、着床前胚胎发育过程和分娩活产来评价。然而,不能依据任何形态特征预测卵母细胞是否能正常发育成可利用胚胎的能力[11],不同的透明带异常可能出现不同的助孕结果。在体外受精过程中蜡样透明带卵母细胞的发育能力较正常透明带卵母细胞明显降低,形成的胚胎质量差,最终优质胚胎率和妊娠率过低,但蜡样透明带卵母细胞进行ICSI受精后仍有可能发育成为健康的后代[6]。周围有蜡样透明带的卵母细胞,无论表面光滑还是毛刺状,均较正常形态卵母细胞更容易出现精卵不结合、受精失败的情况[12]。蜡样透明带卵母细胞可采用补救ICSI或常规ICSI受精,但补救ICSI受精率明显低于常规ICSI受精,这是由于补救ICSI错过了卵母细胞的最佳受精时间。延迟受精对后续胚胎发育和妊娠结局并没有产生明显影响[6],但也有报道蜡样透明带卵母细胞补救ICSI受精后优质胚胎率较常规 ICSI受精者降低[13]。蜡样透明带卵母细胞常规ICSI受精后获得的优质胚胎率和囊胚形成率与正常形态卵母细胞无明显差异,但累积妊娠率低于正常形态卵母细胞,流产率增高[13]。由此可见蜡样透明带卵母细胞虽然可经过ICSI受精正常发育形成卵裂期胚胎和囊胚,但胚胎发育潜力明显降低,推测透明带异常对卵母细胞发育潜力可能造成负面影响。
徐鸿毅等[12]研究发现虽然ICSI提高了卵母细胞受精概率,但不同形态的蜡样透明带卵母细胞可能表现出不同的临床结局,表面呈毛刺状的蜡样透明带卵母细胞 ICSI 受精后可以使部分患者获得临床妊娠,但表面光滑的蜡样透明带卵母细胞成熟度更差,表面光滑、无卵周间隙、极体不明显的蜡样透明带卵母细胞ICSI 受精并不能改善胚胎质量和妊娠结局。由于蜡样透明带卵母细胞以及所形成胚胎的质量差,囊胚培养很难形成囊胚,选择卵裂期胚胎进行移植是最佳策略[12]。本例患者共进行了4个周期卵巢刺激,其中2个周期有可利用胚胎形成,均为优质卵裂期胚胎,冻融胚胎后移植2枚卵裂期胚胎获得临床妊娠并分娩活产。
在IVF/ICSI治疗周期观察到的异常透明带可能与外部因素如刺激方案有关,或与内部因素包括遗传分子缺陷、年龄和体内相关激素水平有关。本例患者为原发不孕,共进行了4个周期卵巢刺激,采用不同卵巢刺激方案,所获卵母细胞均可见蜡样透明带。既往有学者报道10例患者共20个卵巢刺激周期,不同的IVF/ICSI周期采用不同的卵巢刺激方案,但重复可见相同的蜡样透明带[6],据此推测卵母细胞中蜡样透明带变化与卵巢刺激方案无直接相关,而可能是由于患者自身因素所致。此外,卵母细胞中蜡样透明带变化与女性年龄和激素水平没有相关性,相关调查推测职业和生活环境不会直接导致卵母细胞的蜡样透明带形成[6]。
综上所述,受精障碍是蜡样透明带卵母细胞患者受精失败和不孕的根本原因,但尚不能依据患者临床表现提前预知;补救ICSI和常规ICSI均可使蜡样透明带卵母细胞受精、胚胎发育并获得健康的后代。在既往体外受精周期中出现蜡样透明带卵母细胞者,再次治疗周期中常规ICSI受精是最佳治疗策略,能获得更理想的临床妊娠结局。

