褪黑激素埋植剂对发情期水貂卵巢形态、卵泡发育及血清主要生殖激素的影响
宫洪杰,毕晓燕,崔凯,高惠,马泽芳*
(1. 青岛农业大学动物科技学院,山东 青岛 266109;2. 山东省乳山市夏村镇畜牧兽医站,山东 乳山 264500)
水貂是一种季节性繁殖动物,其性腺的发育、衰退及生殖机能活动都存在明显的季节性变化规律,这主要受光照周期变化的调控[1-2]。而光照周期变化主要通过调节松果体中褪黑激素(melatonin,MLT)的合成与分泌,使体内内分泌系统发生改变,进而调控体内生殖激素的合成与分泌,从而通过调节生殖功能来实现季节性繁殖[3-4]。Allain等[5]研究表明,给不同生理阶段水貂埋植MLT后,能明显促进公貂睾丸重量的增加、母貂各级卵泡的提前发育以及血清促性腺激素释放激素(gonadotropin releasing hormone,GnRH)、孕酮(progesterone,P4)、促卵泡素(follicle stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)和雌二醇(estradiol,E2)的提前分泌[5-7]。晏子越等[8]给配种准备期母貂埋植172 d MLT后发现,能促使卵巢发育、可视卵泡、原始卵泡和初级卵泡数量的增多及有腔卵泡的发育。然而,有关MLT对发情期母貂卵巢发育和血清主要生殖激素影响的研究尚未见报道。本试验基于MLT埋植剂的埋植时间,埋植239 d后的水貂正处于配种阶段,而此时也处于发情期,因此,通过对比埋植239 d MLT和未埋植MLT发情期水貂卵巢形态学、卵泡发育及血清主要生殖激素含量的差异性变化,探讨MLT埋植剂对水貂卵巢形态学和卵泡发育的影响机制,为MLT埋植剂技术应用于水貂生产实践提供重要的理论依据。
1 材料与方法
1.1 试验动物及试验设计
试验地为山东省诸城市某水貂养殖场。随机选取2~2.5月龄、健康、体重均匀(870±5)g的雌性红眼白水貂200只,随机平均分为对照组和试验组,每组100个重复,每个重复1只。试验组于试验开始当天使用MLT皮下埋植器在水貂颈部皮下埋植MLT埋植剂,1粒/只(每粒含MLT 18 mg),对照组不做任何处理。试验共进行239 d(2020年7月7日至2021年3月3日)。
1.2 饲养管理
水貂于南北走向的棚舍单笼饲养。试验期内采用自然光照,每天由专人定时饲喂2次,使用饮水器自动饮水,其日粮参照水貂养殖生产中的经验标准执行,基础日粮组成及营养水平见表1。
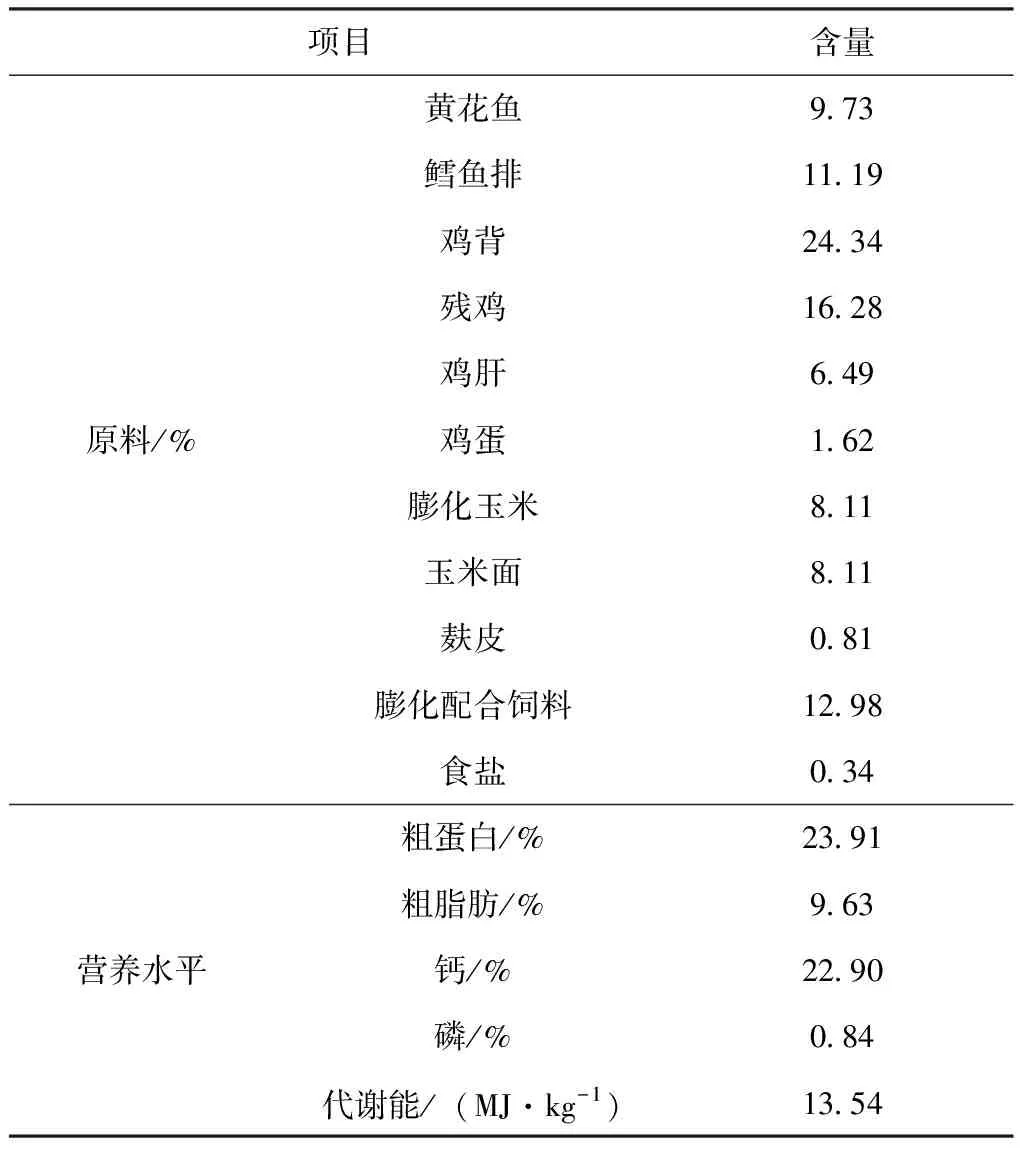
表1 基础日粮组成及营养水平(按干物质计算)
1.3 测定指标与方法
于试验结束当天随机选取对照组和试验组水貂各4只,先找到试验组水貂的MLT埋植剂颗粒后,再进行心脏采血5 mL/只,4 ℃静置30 min以上后,使用3 000 r/min的离心机(S1010E)离心5 min后分离血清,-20 ℃保存。
心脏采血处死水貂剥皮后,采集右侧卵巢,测量形态学指标后将卵巢放于有10%中性甲醛溶液中固定。
1.3.1 卵巢形态指标及测量方法
用电子天平称量卵巢的重量。用游标卡尺测量卵巢的长径、宽径和厚径,并计算体积。
1.3.2 卵泡发育指标及测定方法
随机选取固定于10%中性甲醛溶液中已固定48 h的右侧卵巢每组各3枚,经洗涤、脱水、透明处理后进行石蜡包埋,并使用手摇式组织切片机(Leica RM2235),以5 μm的厚度进行连续切片,每隔6张切片选取1张,每枚卵巢共选取5张切片,共计30张,经HE染色后封片,使用光学显微镜(BK系列生物显微镜)观察各级卵泡的显微结构,记录各级卵泡数量,用目镜测微尺测量各级卵泡和卵母细胞的直径及透明带厚度,并用显微照相机拍照。
卵泡的分类方法借鉴李云龙等[9]对卵泡的分类方法,即根据卵泡大小、透明带的形成、卵泡腔出现的时间以及卵母细胞的发育程度,将卵泡分为原始卵泡、初级卵泡、次级卵泡、三级卵泡和成熟卵泡5种类型。
1.3.3 血清主要生殖激素指标及测定方法
从2个组水貂的待测血清样本中各取血清10 μL,使用酶标仪(Tecan Infinite F50),采用酶联免疫吸附试验(ELISA)法进行血清FSH、LH、E2、P4含量的测定。以上4种ELISA试剂盒(水貂专用)均购自上海,试验操作按照说明书进行,并根据各激素标准曲线计算FSH、LH、E2、P4在血清中的含量。
1.4 数据处理
所有试验数据均用Miscrosoft Excel进行处理,利用SPSS 22.0统计软件对所得的试验数据采用独立样本t检验。试验结果用“平均值±标准误”表示,P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 卵巢形态
由表2可知,试验组水貂的卵巢长度、宽度、厚度及重量均显著高于对照组(P<0.05),体积极显著高于对照组(P<0.01),说明MLT埋植剂埋植239 d对卵巢的形态发育有促进作用。
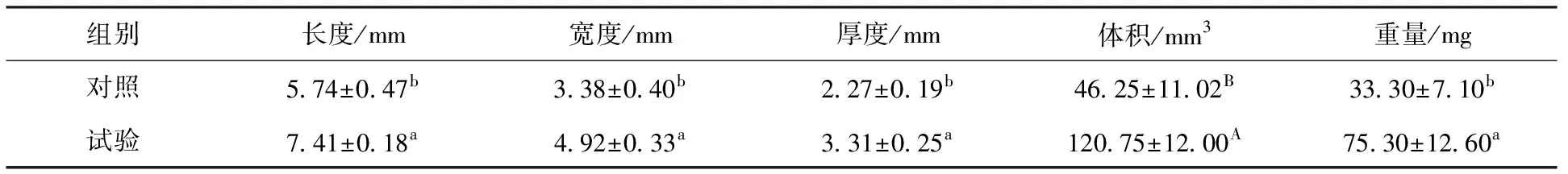
表2 水貂卵巢形态统计结果(n=4)
2.2 各级卵泡显微结构观察结果
由图1可见,原始卵泡数量多、体积小,由中央一个初级卵母细胞及周围一层完整或不完整的扁平或立方卵泡细胞构成,没有卵泡膜和透明带。由图2可见,初级卵泡的初级卵母细胞体积不断增大,周围由单层扁平变为立方或柱状细胞的卵泡颗粒细胞围绕,层数增殖为1~3层,逐渐形成不完整的卵泡膜,但未出现卵泡腔,在初级卵母细胞和卵泡细胞之间开始出现薄而不完整的透明带。由图3可见,次级卵泡的初级卵母细胞周围颗粒细胞变为复层立方或柱状细胞,增殖为3层以上,透明带发育完整,在卵泡细胞间逐渐出现大小不等的腔隙。由图4可见,三级卵泡的初级卵母细胞周围颗粒细胞层数进一步增加,透明带增厚,形成放射冠,卵泡中出现新月形的卵泡腔,卵母细胞及其周围颗粒细胞逐渐被挤至卵泡腔一侧,并与卵泡细胞一起突出卵泡腔形成卵丘,卵泡膜明显。由图5可见,成熟卵泡的初级卵母细胞完成第一次成熟分裂,成为次级卵母细胞,卵泡体积显著增大,卵泡壁变薄,卵母细胞与卵泡壁之间的颗粒细胞层变窄,仅为2~3层,此时透明带达到最厚。由此得出,从原始卵泡、初级卵泡、次级卵泡、三级卵泡到成熟卵泡,各阶段卵泡的显微结构均没有显著差异,说明MLT埋植剂埋植239 d对各级卵泡的显微结构均没有影响。

a. 对照组(未埋植MLT);b. 试验组(埋植239 d MLT);PO. 初级卵母细胞;FC. 卵泡细胞。下同

ZP. 透明带;下同

GC. 颗粒细胞;下同

CO. 卵丘;GL. 颗粒层;FA. 卵泡腔。下同

SO. 次级卵母细胞;CR. 放射冠;C. 卵泡液
2.3 各级卵泡和卵母细胞数量、直径及透明带厚度
2个组均有45个原始卵泡、30个初级卵泡、12个次级卵泡、6个三级卵泡,其中试验组有3个成熟卵泡,而对照组仅有1个成熟卵泡。由表3可见各组测量的结果,试验组与对照组相比,试验组水貂卵等的原始卵泡和卵母细胞的直径、三级卵泡直径显著增大(P<0.05),而初级卵泡和次级卵泡及其卵母细胞的直径差异均不显著(P>0.05)。2个组均在初级卵泡阶段开始出现透明带,次级卵泡阶段发育完整且随卵泡成熟透明带厚度逐渐增厚,但仅在三级卵泡阶段透明带厚度差异显著(P<0.05)。

表3 水貂各级卵泡和卵母细胞数量、直径及透明带厚度比较
2.4 血清主要生殖激素含量
由表4可见,试验组与对照组相比,血清FSH、LH、E2和P4的含量差异均不显著(P>0.05)。由此说明,MLT埋植剂埋植239 d对血清FSH、LH、E2和P4含量均没有影响。

表4 水貂血清主要生殖激素含量比较(n=4)
3 讨论
3.1 MLT埋植剂对卵巢形态的影响
试验结果表明,MLT埋植剂埋植239 d对卵巢的形态发育有促进作用。这可能与其繁殖活性和光照时间缩短调控MLT的分泌量有关,光照信号通过作用于视网膜,经下丘脑视交叉上核(suprachiasmatic nucleus,SCN)的中枢生物钟调控,感知环境昼夜节律的变化,即在夜间促进MLT分泌,在日间抑制MLT分泌[10]。另据Viguie等[11]报道,季节性繁殖动物切除松果体并长期注射MLT,能促使GnRH和LH等激素脉冲释放并激活其生殖活性。因此,本试验埋植MLT埋植剂239 d相当于模拟短日照时MLT的分泌模式,直接促使体内MLT的分泌量持续增加,通过下丘脑-垂体-性腺轴(hypothalamus-pituitary-gonadal axis,HPGA)调节下丘脑分泌GnRH,进而影响生殖系统功能,促进卵巢发育[12]。这与MLT能促进山羊[13]、梅花鹿[14]等动物卵巢卵泡发育的试验结果相一致。
3.2 MLT埋植剂对各级卵泡显微结构的影响
卵泡是由卵母细胞和其周围的颗粒细胞及卵泡膜细胞组成,是卵巢皮质内的基本结构单元等[15]。本试验结果表明,MLT埋植剂埋植239 d对各级卵泡的显微结构均没有影响。这与赵英等[16]报道MLT对休情期银黑狐各级卵泡的显微结构没有影响的结果一致。这可能与样品的采集时间有关,样品采集时水貂正处于发情阶段,试验组水貂卵巢的发育程度可能刚好达到了与对照组水貂发情期相一致的状态和水平。另据李德河[17]报道,母貂于7月初埋植18 mg/只MLT后,第1个月内MLT释放量平均为9.840 mg,第2个月内释放量平均为2.448 mg,第3个月内释放量平均为0.861 mg,第4个月直至第8个月平均月释放量为0.269 mg。由此说明,试验结果可能与MLT的埋植时间、释放量和分泌量有关。从MLT埋植剂埋植在水貂体内后,MLT的释放量随埋植时间的增加而逐渐减少,MLT分泌量也逐渐减少,以致于不能引起2个组各级卵泡显微结构明显的变化,具体机制还需进一步研究。
3.3 MLT埋植剂对卵泡发育的影响
MLT埋植剂显著增加了原始卵泡和卵母细胞的直径、三级卵泡直径及其透明带厚度,表明MLT埋植剂埋植239 d对原始卵泡和三级卵泡的发育有一定促进作用,这与赵英等[16]给休情期银黑狐埋植MLT后能促进有腔卵泡发育的结果一致。本试验2个组均在初级卵泡阶段开始出现较薄且不完整的透明带,次级卵泡阶段发育完整且随卵泡成熟透明带逐渐增厚,这与川金丝猴[18]、牦牛[19]、蓝狐[20]、天府黑兔[21]等相似,与牛和山羊[22]、东北梅花鹿[23]等透明带出现在次级卵泡阶段不同,这可能与动物种属差异有关。本试验中试验组与对照组相比,初级卵泡、次级卵泡、成熟卵泡及其卵母细胞的直径和其透明带厚度差异均不显著,说明此时试验组水貂的卵泡发育程度也达到了正常发情时的相同状态,可能与MLT在卵泡不同发育阶段对FSH、LH、E2、P4等性腺激素的调节有关[24]。另据Tamura等[25]和堵吉等[26]报道,排卵前卵泡液中MLT含量比血清中高,且卵巢颗粒细胞中有褪黑激素受体(melatonin receptor,MR)存在。而在卵泡成熟的各个阶段,MLT均能通过HPGA的MR直接调节卵泡内FSH、LH、E2、P4等性腺激素的合成与分泌,从而影响卵泡的发育[27]。因此,MLT的埋植时间、分泌量及其调控性腺激素的分泌作用均有可能影响卵巢形态学和内部卵泡的发育。
3.4 MLT埋植剂对血清主要生殖激素的影响
试验结果表明,MLT埋植剂埋植239 d对血清FSH、LH、E2和P4含量没有影响。马友记等[28-29]分别给体外培养的绵羊垂体细胞和卵泡颗粒细胞添加不同剂量MLT进行刺激,发现各组FSH、LH和P4含量差异均不显著,与本试验的结果一致。这可能与MLT的释放量和分泌量有关,MLT是调节光照与生殖系统关系中重要的激素信号且光照变化能引起MLT分泌模式的改变[30-31]。据李德河[17]报道,母貂于7月初埋植18 mg/只MLT后,第4个月直至第8个月平均月释放量为0.269 mg。MLT长期处理增加了脑络氨酸羟化酶mRNA的表达,使视前区多巴胺能系统激活,抑制FSH和LH的合成和释放,而在HPGA和GnRH释放细胞中,MLT抑制了GnRH mRNA的表达,使FSHβ和LHβ mRNA的表达降低,进而减少了血浆中性腺激素水平[32-33]。因此,FSH、LH、E2和P4的合成和分泌与MLT的释放量密切相关。一方面可能由于埋植剂中的MLT枯竭所致,MLT埋植剂长期作用于机体,在体内缓慢释放,使血清MLT含量升高,随着释放量逐渐减少直至枯竭,同时受体内内源性MLT负反馈调节的影响,致使血清MLT含量降低,从而间接影响水貂血清FSH和LH等生殖激素的含量;另一方面可能由于MLT迅速的外周代谢所致,使血清MLT含量降低,进而减少性腺激素水平[34]。
4 结论
水貂于7月初埋植MLT埋植剂(18 mg/只)239 d后,对发情期水貂卵巢的重量和体积及原始卵泡和三级卵泡的提前发育均有促进作用,但对初级卵泡、次级卵泡、成熟卵泡及其卵母细胞的直径和其透明带厚度均没有影响;对血清FSH、LH、E2和P4含量没有影响。

