纳米混悬制剂在兽药中的研究进展
毛倩倩,王丽,周祥莹,赵志宏,路庭欢,张岩
(青岛蔚蓝生物股份有限公司/青岛康地恩动物药业有限公司,山东 青岛 266109)
纳米混悬技术(nano-suspension)是20世纪末开始研究并迅速发展起来的一种新型纳米给药技术,基于其开发的纳米混悬液是药物纳米粒子借助少量表面活性剂的稳定作用形成的胶体分散体系,也可称为纳米晶体[1]。纳米混悬液可以是最终产品,也可以是制剂的中间体,根据给药途径(口服给药、注射给药、黏膜给药等)进一步加工成合适的剂型(注射剂、片剂、凝胶剂等)[2]。与普通的混悬制剂相比,纳米混悬制剂的最大特点是粒径小、载药量高,能显著提高药物溶解度、增加溶出速率、提高难溶性药物的生物利用度,同时混悬制剂中的纳米粒还可通过进一步修饰,实现长循环和靶向给药,降低给药剂量和不良反应[3-4]。近年来,纳米混悬制剂在兽药领域的研究与应用日益广泛和深入,有着巨大的发展前景。本文就纳米混悬制剂的制备方法及给药途径进行概述,以期为纳米混悬制剂在兽药领域的研发提供参考。
1 兽用纳米混悬液的制备方法
纳米混悬制备技术有3种:“自上而下”(Top-down)技术、“自下而上”(Bottom-up)技术和联用技术(图1)[5]。“自上而下”技术是通过机械力将原料药研磨至纳米级,主要包括高压均质法(high-pressure homogenization)和介质碾磨法(media milling method)。“自下而上”(Bottom-up)技术,又称控制沉淀技术,是通过将药物溶解于有机相后,分散于水相中,并通过控制相关条件,除去有机溶剂,得到纳米级晶体。联用技术则是将两种方法联合使用,主要通过碾磨或高压均质将沉淀法得到纳米混悬剂,然后进一步粉碎,获得理想的纳米级药物粒子。具体选择哪一种方法要综合考虑粒径大小、纳米混悬液的稳定性、成本以及药物的理化性质等各方面因素,必要时可采用联用技术[6]。
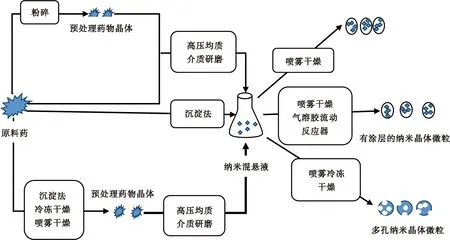
图1 纳米制剂制备方法流程
1.1 高压均质法
高压均质法的原理是,物料以超高流速通过可调缝隙的均质阀中,通过剪切、撞击和空穴3种效应,将物料粉碎至纳米级别,并降低药物粒径的多分散性(PDI)。此方法适用范围广、制备过程简单,可避免有机溶剂的加入,并且高压均质过程会对细菌产生破碎作用,因此特别适用于无菌纳米注射混悬剂的制备[7-8]。该法制备的药物纳米晶体的粒径主要与药物本身的硬度、稳定剂类型、均质压力、循环次数等因素有关。其中表面活性剂种类对纳米粒粒径影响程度较小,匀质压力和循环次数是决定纳米粒粒径的最主要因素。
严红梅等[9]以难溶性药物黄芩素为模型,以卵磷脂和波洛沙姆-188 联用作为稳定剂,采用高压均质法制备BA-NS,所制备的BA-NS粒径小、分散较均匀并且能显著提高黄芩素的体外溶出度。Alireza等[10]研究发现,通过高压均质法对姜黄素进行处理,得到的姜黄素混悬制剂粒径更小、再分散性更好、具有更高的溶解性和溶解。这为中兽药产品的开发提供了一定的思路和启发。
阮祥春等[11]通过改变均质机的压力及均质的循环次数来进一步控制氟苯尼考纳米混悬剂中药物的粒径,所得混悬液为乳白色,通针性良好,3 h内的沉降体积比达到96%以上,长时间放置分层后,轻摇即可迅速重新分散均匀,重分散性较好。余鹏灵[12]在制备恩诺沙星纳米混悬注射剂过程中,发现在一定范围内,粒径变化与均质压力、均质次数成相关性,随着压力、均质次数的增加,粒径逐渐变小,当压力超过1 00 MPa,适度增大压力,粒径变化不明显。
1.2 介质研磨法
介质研磨法,又称球磨法、珍珠碾磨法等,其原理是药物在研磨室内与研磨介质(玻璃、氧化锆或聚苯乙烯树脂等球状物)快速转动,相互碰撞,被研磨成纳米级粒子[13]。该方法制备过程中温度可控,特别适合热不稳定的药物,但研磨过程中,研磨介质可能会脱落,因此不太适宜注射用纳米混悬液的制备[14]。该方法制备的药物纳米粒径主要与研磨介质的种类和大小、机械转速、表面活性剂种类、药物浓度及研磨时间有关[15]。
徐林林等[16]采用微型化介质研磨法使塞来昔布原料药纳米化,能够增加其体外溶出度。连王权等[17]采用研磨介质体积10 mL,转速1 600 r/min,研磨时间4 h的工艺条件制备的延胡索乙素纳米混悬剂,体外溶出效果明显优于药物的粗混悬液,能更快、更有效、更稳定地发挥其镇痛作用。王镜等[18]采用微型化介质研磨制备的银杏内酯B纳米混悬剂(GB-NS),平均粒径(PS)为(180±7)nm,多分散指数(PDI)为0.196±0.036;扫描电镜(SEM)显示GB-NS呈棒状或不规则的颗粒状,结晶度较银杏内酯B原料药(GB)明显减弱;体外溶出试验结果显示GB-NS在30 min内累积溶出度接近90%,显著优于GB原料药。
1.3 沉淀法
沉淀法是先将药物溶于溶剂(通常为可与水互溶的有机溶剂)中,后将药液加入相关其他溶剂中,此过程药物因局部过饱和,迅速析出形成纳米结晶。该方法,操作简单,易于工业生产[19],但形成的纳米晶体粒径较难控制,且多处于无定型状态,易结团形成大颗粒,并存在有机溶剂残留的风险[20]。该制备方法的控制条件:表面活性剂种类及浓度、药物浓度、油水比、搅拌速度、温度等[21]。
刘锦妮等[22]研制的穿心莲内酯纳米混悬剂,是将F68和吐温-80作为稳定剂,反溶剂和溶剂体积比20∶1,药物浓度40 mg/mL,搅拌速率1 400 r/min,搅拌时间80 min,所制得的穿心莲内酯纳米混悬液粒径为(568.51±13.74)nm,药物呈大小均一的球形颗粒,分布均匀。连王权等[23]采用pH值依赖的溶解/沉淀法制备美洛昔康纳米混悬剂,使用泊洛沙姆407与吐温-80比例为1∶1,作为稳定剂,其用量与主药比例为1∶2;以13 000 r/min的速率高速剪切2 min,所得产品的平均粒径均在200 nm以内,PDI值约0.2,并可显著改善体外溶出度。王一安等[24]通过反沉淀法制备舒林酸纳米混悬剂,并通过乳腺癌MCF-7细胞、4T1细胞肿瘤模型进行体外药效评价,其抑制效果较游离药有了显著的提升(P<0.01),拓宽了舒林酸的给药途径,并为其他非甾体类抗炎药纳米制剂的开发提供了借鉴作用。
1.4 乳化法
乳化法是先将难溶性药物溶于有机溶剂中,形成O/W型乳剂,后采用不同(减压蒸馏、超声破碎、匀质化、微流化、对流匀质等)方法控制药物在乳滴中的大小,形成纳米混悬制剂[25]。该方法适合用于能溶解于有机溶解性的药物,无法用于水溶性药物和有机溶剂溶解性较差的药物,并且此生产方法可能会造成有机溶剂残留等问题,对环境也有一定的污染[26]。该制备方法属于Bottom-up法,影响纳米粒径的因素与沉淀法相似,其中最重要的因素是有机溶剂的选择。
Ahmed等[27]对降血脂药物阿托伐他汀/依折麦布(ATV/EZT)复方制剂进行研究发现,与纯药物混悬液相比,通过乳化法负载的ATV/EZT可提高口服生物利用度,并更有效地控制血清胆固醇水平。Moataz等[28]采用乳化法通过筛选不同的油、表面活性剂和助表面活性剂,得到的最终样品,能有效提高坎地沙坦酯/氢氯噻嗪(CAN/HCTZ)的溶解性和溶解度,从而提高其口服生物利用度和生物活性。陈胡羚[29]采用乳化法研制的氟苯尼考纳米晶,有机相与水相体积比为1∶2,泊洛沙姆188的浓度为5%,匀浆速度和时间分别为7 000 r/min和5 min,匀质压力和次数分别为300 bar和3次,得到的氟苯尼考纳米晶粒径分布平均,粒径为(226.1±11.3)nm,PDI平均值为0.29±0.03。
1.5 联用技术
将“自下而上”技术和“自上而下”技术联用,可避免单独使用带来的弊端,得到的纳米晶体粒径更小、分布更窄。一般情况下,高压均质技术为联用技术的技术核心,先通过沉淀法等Bottom-up技术得的基础纳米混悬制剂,后用高压均质法获得粒径更均匀的纳米混悬制剂。目前常用的方法有:沉淀—均质、喷雾干燥—均质、冷冻干燥—均质等[30-31]。
王卉[32]采用溶剂反溶剂-高压均质法制备大豆苷元、 沙棘黄酮的纳米混悬剂,可有效地提高它们的溶解度、口服生物利用度;表明纳米混悬剂技术是改善难溶性中药黄酮类成分口服吸收的有效、可行手段,为中药黄酮类成分相关制剂的研究开发提供参考。曾艳玲等[33]采用超声辅助沉淀法制备盐酸齐拉西酮纳米混悬剂,该方法中超声波在液体里的分散作用主要依赖于液体的超声空化作用,采用冷冻干燥法对纳米混悬剂进行了固化研究及对固化后的粉末进行了表征。 固化后纳米混悬剂粉末外观良好,粒径、多分 散性指数复溶后变化不大。葸慧荣等[34]通过反溶剂沉淀-高剪切法制备淫羊藿苷纳米微粒,经单因素试验法考察了不同稳定剂对纳米微粒的影响,逐步优化处方,最终获得粒径较小、载药量较高且相对稳定的淫羊藿苷纳米混悬液。
2 给药途径
纳米混悬制剂,能增加难溶性药物的生物利用度,提高药效,可应用于多种给药途径,包括口服给药、注射给药、眼部给药、肺部给药、吸入给药、皮肤给药等[35]。本文将重点介绍纳米混悬制剂在口服给药、注射给药、吸入给药以及皮肤给药等方面的应用。
2.1 口服给药
口服给药是兽用制剂最常见的给药方式,使用方便、安全,目前市售兽用纳米混悬制剂大部分产品为口服给药[36]。口服给药时,因部分药物首过效应代谢失效,导致生物利用率低,纳米混悬制剂,药物包裹于内部,可介导药物的肠道淋巴途径转运,从而克服首过效应。此外,纳米混悬制剂,药物粒径小,表面积大,对肠道黏膜有一定的黏附作用,可延长药物在肠道内的滞留时间,增加吸收比例,提高药物的生物利用度[37]。陈胡羚[29]以氟苯尼考计,按20 mg/kg剂量给鸡灌胃给药氟苯尼考原粉和氟苯尼考纳米晶,发现与氟苯尼考原粉组相比,氟苯尼考纳米晶组的达峰时间(Tmax)缩短,药时曲线下面积(AUC0-∞)和峰浓度(Cmax)均明显提高,氟苯尼考纳米晶组的相对生物利用度是氟苯尼考原粉组的3.6倍。
2.2 注射给药
注射给药能够达到某些治疗效果,例如:起效快速、缓释作用、靶向作用、降低过敏反应、降低毒性、避免首过效应,具有一定的治疗优势[37]。纳米混悬制剂注射给药,通过界面扩散进入血液,延缓药物释放,起到缓释作用[38]。纳米混悬制剂中的药物溶出非瞬时完成,可以达到静注贮库效应,避免了药物瞬间浓度过高而引起的毒性,此外药用辅料少,不但能降低毒性,还可降低过敏反应及阻塞毛细管的风险[39]。纳米混悬制剂,注射给药,具有被动靶向作用,从而增强了药效。Duong等[8]研制的用于治疗预防放射治疗和细胞毒性药物化疗引起的恶心呕吐的盐酸昂丹司琼注射液,在大鼠皮下注射给药后,与溶液制剂相比,优化后的盐酸昂丹司琼混悬注射液,药物释放可达到96 h,延长了平均驻留时间。余鹏灵[12]按恩诺沙星计2.5 mg/kg单剂量分别给猪肌注2.5%自制恩诺沙星纳米混悬注射剂和拜有利注射剂,通过对主要药动学参数进行比较,Tmax、消除半衰期(t1/2β)、驻留时间(MRT)统计学差异显著,表明恩诺沙星纳米混悬注射剂在猪体内具有一定的缓释作用、且消除缓慢;自制恩诺沙星纳米混悬注射剂的AUC0-last稍高于拜有利注射剂,相对生物利用度为105.2%,表明用高压均质技术制备得恩诺沙星纳米混悬注射剂具有相对较好的吸收程度。
2.3 吸入给药
通常吸入给药的气雾剂粒子在0.5~5 μm范围内最为适宜。纳米混悬制剂能够改善药物在载体药分布不均匀的状况,显著增加呼吸道的药物吸收,减少全身性吸收[40]。有研究表明,将纳米混悬制剂的粒径从4.4 μm减小至0.73 μm,吸入量可从227 μg升至421 μg。纳米混悬制剂对肺泡巨噬细胞的靶向给药,也是目前的研究重点:能够提高靶细胞内的药物浓度,降低全身性药物浓度,从而减少用药次数,降低药物的潜在毒性。畜禽呼吸系统疾病是我国许多规模化养殖场和农村养殖大户十分关注的问题之一,如繁殖与呼吸综合征、猪传染性胸膜肺炎、猪传染性萎缩性鼻炎、禽流感、鸡传染性支气管炎、新城疫等。畜禽呼吸道疾病的药物治疗疗效一般,生物利用度低[41]。如果利用纳米混悬剂的肺靶向优势,将药物制作成纳米混悬剂,可为我们研究治疗呼吸系统疾病的新兽药提供新的思路和途径。
2.4 其他给药方式
纳米混悬技术还可以制成透皮制剂用于宠物医疗领域,将恩诺沙星制成纳米混悬制剂[42],可对皮肤角质层的结构产生改变,对胶原纤维原有的排列造成影响,从而提高药物在皮肤的渗透吸收。兰莹[43]研制的复方酮康唑纳米乳,药效比原料药有所提高,杀菌时间短,可能因为复方酮康唑纳米乳粒径较小,容易透过真菌的细胞膜,并且能与细胞膜上的甾醇化合物反应,从而使抑菌的效果得到了很大程度提高。复方酮康唑纳米乳具有缓释作用,当药物进入菌体后便慢慢释放,延长了药物在菌体内停留的时间,抑菌、杀螨效果都很理想。
3 结语
纳米混悬制剂,不仅能解决药物溶解性和溶出度问题,还能改变药物在体内药代动力学特征,提高生物利用度,提高药物的安全性和有效性。目前,兽用纳米混悬制剂重点开发剂型为口服制剂,主要优势为增加药物的溶解度和溶出度。相信随着纳米混悬技术在基础理论研究方面的不断深入以及无毒、无刺激性、生物相容性好的新材料的开发,其在给药系统中的应用前景将会更加广阔,未来将有更多基于纳米混悬技术开发的产品上市。

