ZEA、DON及其联合作用对李斯特菌感染小鼠血清免疫相关细胞因子的影响
许晴雨,夏苏干,蔡国栋,邹辉,顾建红,袁燕,刘学忠,刘宗平,卞建春*
(1. 扬州大学兽医学院,江苏 扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
霉菌毒素主要是指霉菌在其污染的饲料和食品中产生的有毒代谢产物,据不完全统计,世界上每年大约有20%~25%的谷物遭受多种霉菌的污染,尤以高温高湿的季节和地区受污染最为严重[1]。动物食用霉菌毒素污染的饲料后会产生一系列的不良反应,如免疫抑制、采食量降低、不孕流产等[2-3]。玉米赤霉烯酮(zearalenone,ZEA)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)在我国饲料中较为常见,是影响我国养殖业的主要霉菌毒素,近年来二者污染呈上升趋势[4],而且它们常常是同时存在于被污染饲料及其产品中。研究显示,ZEA和DON中毒皆能产生严重的免疫毒性[5-6],但相关研究采取的毒素作用剂量常较大[7-8],且多以研究单一毒素的中毒较为多见,而研究二者的联合作用下对机体影响的研究相对较少[9-10]。
李斯特菌(Listeria)是环境和饲料中常见的病原微生物,免疫功能正常的动物对这些细菌的入侵具有一定的抵御能力。动物感染李斯特菌后,体内免疫相关细胞因子的表达水平将发生变化,进一步诱导机体产生体液免疫和细胞免疫应答[11]。可以设想,如果动物在受到ZEA、DON等霉菌毒素影响的前提下再遭遇李斯特菌等病菌威胁,情况会变得复杂。因此,搞清ZEA、DON及其联合作用背景下动物对李斯特菌等细菌感染防御能力的影响及其机制显得尤为重要和迫切。细胞因子是一类小分子多肽因子,由各种免疫细胞合成、分泌,在免疫系统中起调控作用[12]。为此,本试验应用抗体芯片技术,研究了低剂量的ZEA、DON及其联合作用下李斯特菌诱导的血清中多种白介素、集落刺激因子、趋化因子和基质金属蛋白酶蛋白表达水平,以揭示ZEA、DON及其联合作用对细菌感染动物防御能力的影响及其机制,为更全面地认识ZEA与DON免疫毒性的特征及其防控研究提供理论依据。
1 材料与方法
1.1 实验动物及主要试剂
SPF级 C57BL/ 6小鼠,雌性,6~8周龄,体重(20±2)g,购自扬州大学实验动物中心。所有涉及动物的试验(包括安乐死)均经扬州大学动物保护与利用委员会批准,ID:SYXK(SU)2017-0044。
李斯特菌参考菌株(EGD 编号BAA-679,血清型1/2b)由浙江大学方维焕教授馈赠。ZEA、DON购自美国 Sigma公司。小鼠炎症抗体阵列G1系列(AAM-INF-G1)试剂盒购自广州瑞博奥生物科技有限公司。
1.2 动物分组与处理
将 90只 C57 BL/ 6小鼠随机均分为5组,分别为对照组(Con)、李斯特菌组(Lis)、ZEA+Lis组、DON+Lis组、ZEA+DON+Lis组。小鼠置于聚丙烯笼中饲养,每笼 3只。笼子放置在通风架上,均设独立的空气循环系统,无化学污染和病原体污染。温度为 (22±2)℃,湿度为 (55±15)%,每日自8:00至20:00照明12 h。每千克体重灌胃剂量为:ZEA=10 mg,DON=1 mg,ZEA+DON联合=10 mg ZEA+1 mg DON。
先对ZEA组、DON组和 ZEA+DON组小鼠用对应剂量毒素进行连续7 d的灌胃处理。Con组和Lis组用相同容积的双蒸水灌胃。于第 8天通过尾静脉注射 5×104CFU的李斯特菌标准株以建立小鼠感染模型,Con组注射生理盐水,感染期间持续对小鼠进行毒素灌胃。在感染第7天时将小鼠麻醉进行心脏采血,后脱颈椎处死。
1.3 抗体芯片对血清样本的检测
根据试剂盒说明书的方法,将玻片芯片室温平衡20~30 min,然后将芯片室温干燥2 h。 每个芯片孔中加入100 μL的1×封闭液,室温摇床上孵育1 h,避免产生气泡;1 h后抽去封闭液,每个孔中添加100 μL样品(血清2倍稀释上样),一个阵列一个样品(4 ℃振荡过夜孵育)。使用Thermo Scientific Wellwash Versa芯片洗板机清洗玻片,先用1×洗液Ⅰ进行清洗,每孔250 μL的1×洗液Ⅰ,清洗10次,每次震荡10 s,震荡选择高强度,用去离子水稀释20×洗液Ⅰ。后换用1×洗液Ⅱ通道进行清洗,每孔250 μL的1×洗液Ⅱ,清洗6次,每次震荡10 s,震荡选择高强度,用去离子水稀释20×洗液Ⅱ。每孔加入70 μL生物素标记抗体;室温孵育2 h后再次清洗,方法同上。每孔加入70 μL的1 500倍稀释的荧光剂-链霉亲和素,用密封条贴住玻片,然后用铝箔纸包住玻片避光4 ℃过夜孵育。再次清洗,方法同上。
将玻片框架拆掉,小心不要用手接触到玻片印制抗体的一面。使用InnoScan 300,采用Cy3通道,激发频率=532 nm。荧光检测白细胞介素IL-1α、IL-1β、IL-6、IL-17、IL-10、IL-3、IL-13、IL-4、IL-9、IL-12p40/p70、IL-2,基质金属蛋白酶TIMP-1、TIMP-2,趋化因子KC、LIX、MIG、BLC,集落刺激因子GCSF、MCSF、GM-CSF等40种免疫相关细胞因子表达水平。采用芯片分析软件提取数据,采用AAM-INF-G1的数据分析软件进行数据分析。
1.4 数据统计与分析
所有数据以 “平均值±标准差”表示,用 Grahpad Prism 8.0软件进行单因素方差分析,组间比较采用配对t检验,P<0.05有差异且有统计学意义。
2 结果
2.1 白细胞介素表达水平变化
各试验组白细胞介素的表达水平见图1。与Con组相比,Lis组IL-1β与IL-12P40/P70显著升高(P<0.05)。与Lis组相比,ZEA+Lis、DON+Lis组和ZEA+DON+Lis组的IL-1β显著下降(P<0.05);DON+Lis组和ZEA+DON+Lis组IL-12P40/P70显著下降(P<0.05)。与ZEA+Lis处理组相比,ZEA+DON+Lis组IL-6显著上升(P<0.05)。与DON+Lis处理组相比,ZEA+DON+Lis组白介素均无显著差异(P>0.05)。

与空白组相比,*表示P<0.05,**表示P<0.01;与Lis组相比,#表示P<0.05,##表示P<0.01;与ZEA+DON+Lis组相比,^表示P<0.05,^^表示P<0.01。下同
2.2 集落刺激因子表达水平变化
各试验组集落刺激因子的表达水平见图2。与Con组相比,Lis组GM-CSF显著下降(P<0.05),MCSF显著升高(P<0.05)。与Lis组相比,ZEA+Lis处理组集落刺激因子均无显著差异(P>0.05);DON+Lis处理组MCSF显著下降(P<0.05);ZEA+DON+Lis组GCSF显著升高(P<0.05)。与ZEA+Lis处理组相比,ZEA+DON+Lis组集落刺激因子均无显著差异(P>0.05)。与DON+Lis处理组相比,ZEA+DON+Lis组GCSF显著升高(P<0.05),MCSF极显著升高(P<0.01)。
2.3 趋化因子表达水平变化
各试验组趋化因子的表达水平见图3和图4。由图可知,与Con组相比,Lis组MIG显著升高(P<0.05)。与Lis组相比,ZEA+Lis处理组趋化因子均无显著差异(P>0.05);DON+Lis组和ZEA+DON+Lis组BLC显著升高(P<0.05);ZEA+DON+Lis组MIG极显著升高(P<0.01)。与ZEA+Lis处理组相比,ZEA+DON+Lis组MIG与MIP-1α显著升高(P<0.05),LIX显著下降(P<0.05)。与DON+Lis处理组相比,ZEA+DON+Lis组MIP-1α极显著升高(P<0.01)。
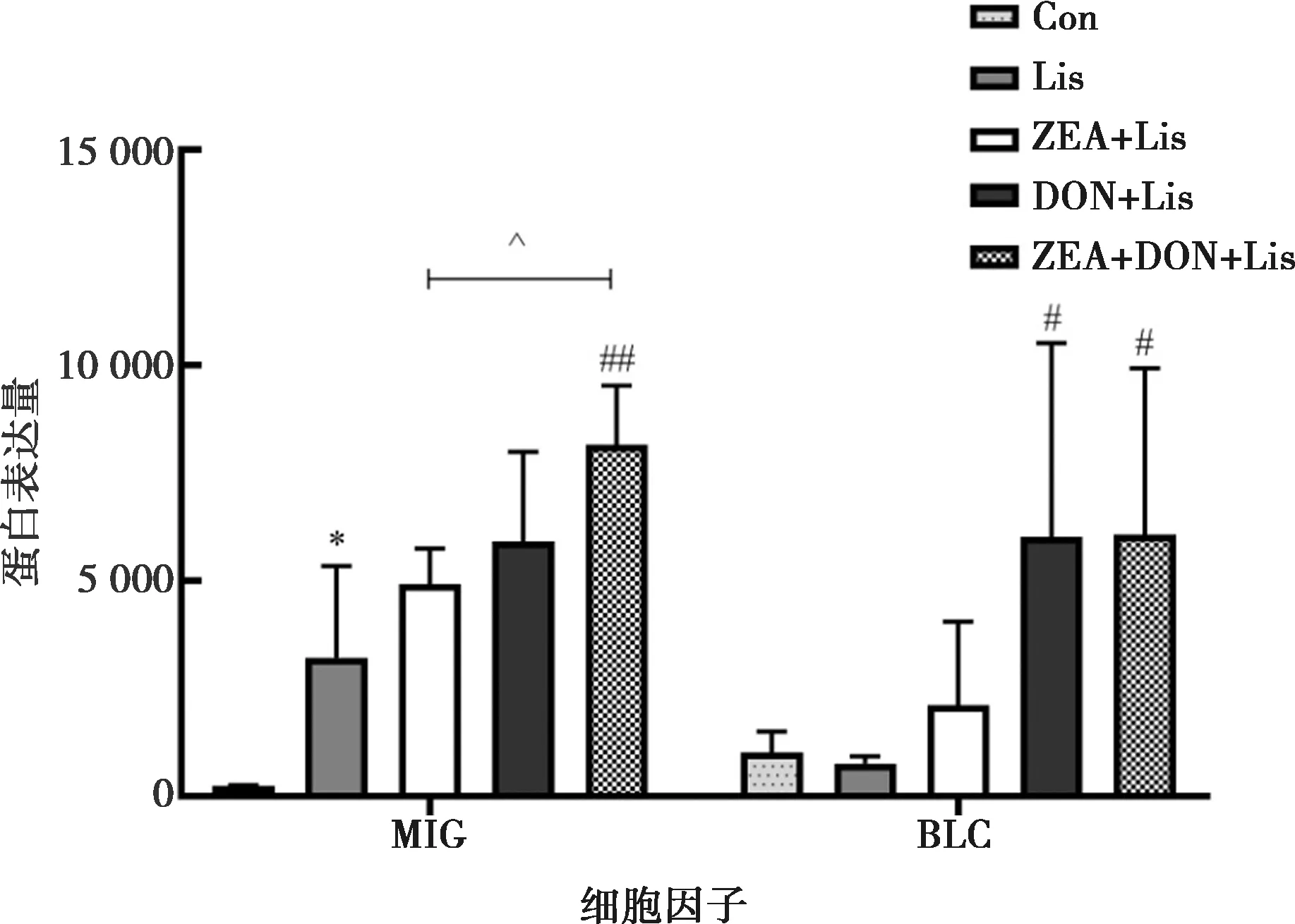
图3 ZEA、DON及其联合作用对李斯特菌感染小鼠血清的趋化因子1含量的影响
2.4 基质金属蛋白酶表达水平变化
各试验组基质金属蛋白酶的表达水平见图5。由图5可知,与Con组相比,Lis组基质金属蛋白酶均无显著差异(P>0.05)。与Lis组相比,ZEA+Lis组、DON+Lis组和ZEA+DON+Lis组TIMP-1均显著升高(P<0.05)。与ZEA+Lis处理组相比,ZEA+DON+Lis组TIMP-1显著升高(P<0.05)。与DON+Lis处理组相比,ZEA+DON+Lis组MIP-1α基质金属蛋白酶均无显著差异(P>0.05)。
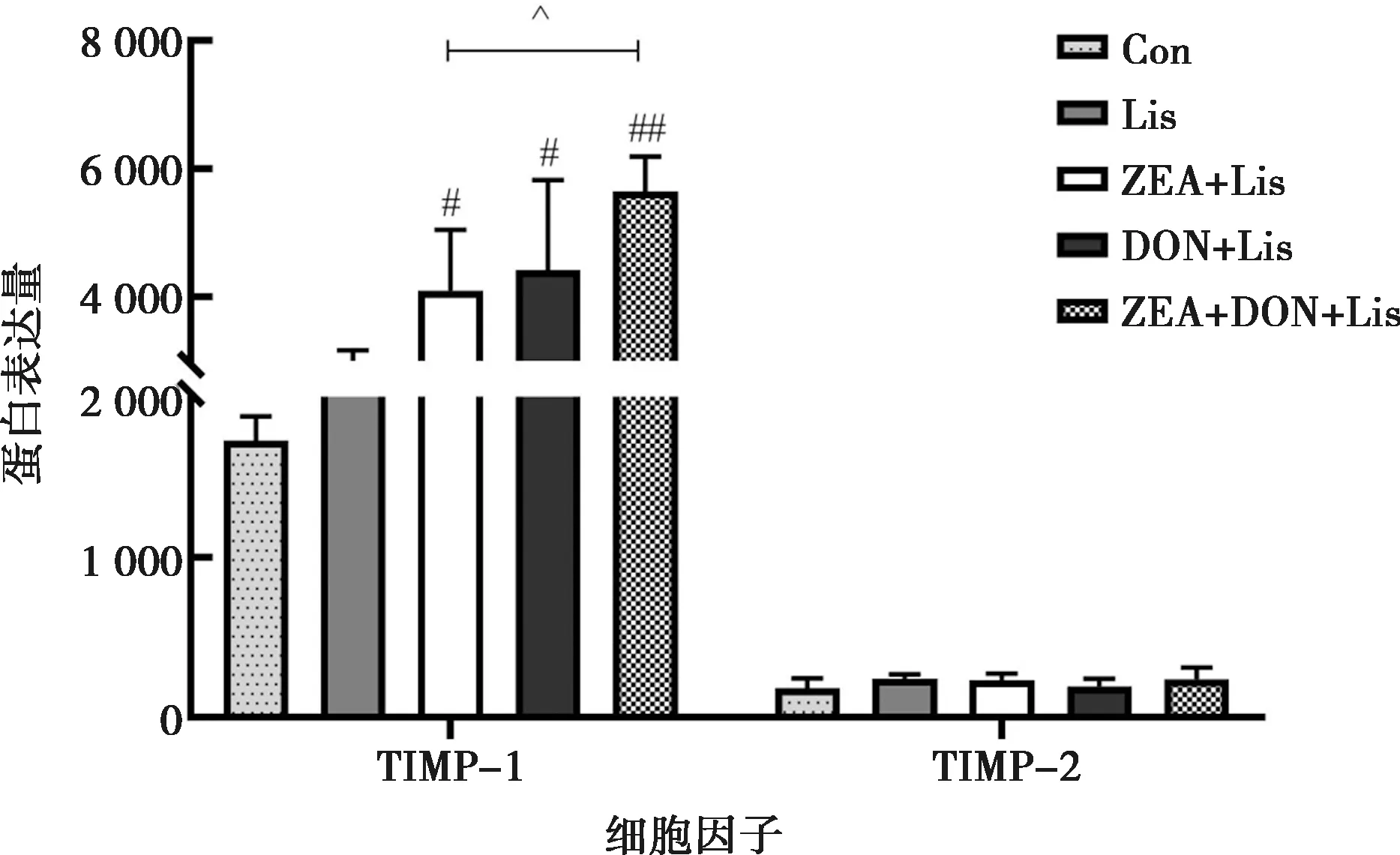
图5 ZEA、DON及其联合作用对李斯特菌感染小鼠血清的基质金属蛋白酶含量的影响
3 讨论
研究表明,ZEA与DON都会影响动物的免疫细胞和基本免疫功能[13-14]。摄入一定量的ZEA时机体抵抗力会有所下降,脾脏淋巴细胞产生氧化损伤,甚至部分会发生凋亡[15]。细胞因子能在细胞间传递信息,是具有免疫调节和效应功能的蛋白质或小分子多肽,为非特异性免疫效应物质。在机体受到某些外界或内部刺激时,细胞因子的平衡便会被打破,从而激发一系列的免疫反应[16-17]。Ren等[9,18]分别报道了DON和ZEA联合染毒可降低小鼠血清IL-4和IFN-γ的浓度,但对血清中其他细胞因子特别是集落刺激因子和趋化因子等研究较少。另外,自然条件下霉菌毒素常常载饲料中混合存在,因此研究不同霉菌毒素的联合毒性作用意义更大。不同霉菌毒素共同存在下的毒性情况不能简单根据其各自的毒性来预测,它们之间可以有拮抗作用、相加作用或协同作用[19]。为此,本试验通过研究低剂量ZEA、DON及其联合作用对李斯特菌感染小鼠血清免疫相关细胞因子表达水平的影响,来更深入地探讨ZEA及DON的免疫毒性。
李斯特菌的清除主要依赖于CD4+T细胞,很多细胞因子例如IL-4[20-21]会影响CD4+T细胞的活化,当血清中的相关细胞因子受到抑制时,会使得CD4+T细胞活化受阻或功能造成破坏,机体对李斯特菌的免疫抵抗能力会急剧下降,动物会发生严重的感染甚至死亡[22],造成一定的生产经济损失。
抗体芯片技术是蛋白质组学芯片技术的一种,其技术原理是有序的将各种抗体固定在滤膜、载玻片等载体上,利用抗原-抗体特异性结合反应来捕捉样本中待检测的抗原,然后用标记的有特定荧光物质的抗体与芯片上对应的蛋白质结合,抗体上的荧光将指示对应蛋白质的表达情况。该技术利用少量样本可筛选多项指标,具有微型化、集成化、高通量的特点,在研究信号转导异常、蛋白质组学、肿瘤标志物、免疫和细胞周期调控等领域有广泛的应用。
白介素是白细胞或免疫细胞间相互作用的淋巴因子,它和血细胞生长因子同属细胞因子。两者相互协调,相互作用,共同完成造血和免疫调节功能。白介素在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用。白介素IL-1β主要刺激机体B细胞分化生长以及刺激CD4+T细胞活化[23];IL-12P40/P70促进活化的T细胞增殖与CD56分子的表达;白介素IL-6会刺激机体内T细胞增殖并发生CTL的活化[24]。本研究结果显示,Lis组与Con组相比,血清中的IL-1β与IL-12P40/P70显著升高;ZEA+Lis组与Lis组相比,IL-1β显著下降;DON+Lis组与Lis组相比,IL-1β与IL-12P40/P70水平显著下降;ZEA+DON+Lis组与Lis组相比,IL-1β,IL-12P40/P70显著下降;ZEA+DON+Lis组与ZEA+Lis组相比,IL-6显著上升;ZEA+DON+Lis组与DON+Lis组相比白介素无显著差异。研究表明,低剂量的ZEA、DON单独处理皆可导致白介素降低,引起机体的免疫抑制;而ZEA+DON+Lis组的处理与单独的低剂量ZEA+Lis组相比所造成的的免疫抑制减少,而与低剂量DON+Lis相比无明显差异。钟昉等[25]研究由CD4+T细胞诱导的免疫应答中,用低剂量的ZEA+DON+Lis处理小鼠,T细胞活化信号CD44的表达显著高于DON+Lis处理组,CD223的表达显著高于ZEA+Lis处理组。本试验结果与之类似,证实了在低剂量的ZEA与DON联合作用下造成的免疫抑制确实具有一定的拮抗作用。
集落刺激因子可刺激不同的造血干细胞在半固体培养基中形成细胞集落。集落刺激因子GM-CSF能够刺激机体T细胞增殖,加强造血功能,诱导前体细胞增殖[26]。GCSF刺激造血细胞分化,活化。MCSF刺激机体破骨细胞的生成且可加强趋化活性和刺激吞噬。本研究结果显示,Lis组与Con组相比,GM-CSF显著下降,MCSF显著上升;DON+Lis组与Lis组相比,MCSF显著下降;ZEA+DON+Lis组与Lis组相比,GCSF显著上升;ZEA+DON+Lis组与DON+Lis组相比,GCSF显著上升,MCSF极显著上升。结果表明低剂量的DON会引起机体造血功能的减退,而ZEA+DON+Lis组与单独的低剂量的ZEA+Lis和DON+Lis处理组相比造血功能有所上升且加强了趋化活性,表明了ZEA+DON+Lis组对于免疫抑制存在一定的拮抗作用。
机体在防御和清除入侵病原体等异物时,趋化因子诱导附近反应细胞定向趋化。趋化因子MIG(CXCL9)作用于TH1细胞,刺激CD4+T细胞的活化。LIX(CXCL5)刺激CD8+T细胞。BLC(CXCL13)主要诱导CD8+效应记忆细胞[27-28]。MIP-1α(CCL3)作用于TH1和TH2细胞。本研究结果显示,Lis组与Con组相比,MIG显著上升;DON+Lis组与Lis组相比,BLC显著上升;ZEA+DON+Lis组与Lis组相比,BLC显著上升,MIG极显著上升;ZEA+DON+Lis组与ZEA+Lis组相比,MIG与MIP-1α显著上升,LIX显著下降;ZEA+DON+Lis组与DON+Lis组相比,MIP-1α显著上升。结果表明低剂量的ZEA、DON及其联合皆可引起机体趋化因子激活定向迁移从而产生免疫应答。
基质金属蛋白酶(MMPs)几乎能降解细胞外基质(ECM)中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障。基质金属蛋白酶TIMP-1主要降解ECM,是活性最强的基质金属蛋白酶抑制剂。在正常细胞中TIMP-1表达比例处于平衡状态,对组织重建、血管形成等具有重要作用[29-30]。本研究结果显示,ZEA+Lis组与DON+Lis组分别与Lis组相比TIMP-1水平皆显著升高;ZEA+DON+Lis组与ZEA+Lis组相比,TIMP-1也显著上升。结果表明低剂量的ZEA、DON及其联合皆会引起机体发生重塑。
综上所述,低剂量的ZEA、DON及其联合对于李斯特菌感染小鼠的免疫有不同程度的抑制作用,从而降低小鼠对李斯特菌感染的抵抗能力。然而低剂量的ZEA和DON联合使用对于小鼠的免疫抑制存在一定的拮抗作用,具体机制有待进一步研究。

